Insamling, expansion och differentiering av primära humana nasala epitelcellmodeller för kvantifiering av cilia beat-frekvens
Summary
Detta protokoll beskriver nasal epitelcellsamling, expansion och differentiering till organotypiska luftvägsepitelcellmodeller och kvantifiering av cilia beat-frekvens via levande cellavbildning och specialbyggda skript.
Abstract
Mätningar av ciliafunktion (slagfrekvens, mönster) har etablerats som diagnostiska verktyg för luftvägssjukdomar såsom primär ciliär dyskinesi. Den bredare tillämpningen av dessa tekniker begränsas emellertid av den extrema känsligheten hos ciliärfunktionen för förändringar i miljöfaktorer, t.ex. temperatur, fuktighet och pH. I luftvägarna hos patienter med cystisk fibros (CF) hindrar slemansamling flimmerhår. Flimmerhårsfunktionen har undersökts i primära luftvägscellmodeller som en indikator på CF Transmembrane conductance Regulator (CFTR) kanalaktivitet. Emellertid har betydande patient-till-patient-variabilitet i cilia-slagfrekvens hittats som svar på CFTR-modulerande läkemedel, även för patienter med samma CFTR-mutationer . Dessutom är effekten av dysfunktionell CFTR-reglerad kloridsekretion på ciliär funktion dåligt förstådd. Det finns för närvarande inget omfattande protokoll som visar provberedning av in vitro-luftvägsmodeller, bildförvärv och analys av Cilia Beat Frequency (CBF). Standardiserade odlingsförhållanden och bildförvärv som utförs i ett miljökontrollerat tillstånd skulle möjliggöra konsekvent, reproducerbar kvantifiering av CBF mellan individer och som svar på CFTR-modulerande läkemedel. Detta protokoll beskriver kvantifieringen av CBF i tre olika luftvägsepitelcellmodellsystem: 1) inbyggda epitelark, 2) luft-vätskegränssnittsmodeller avbildade på permeabla stödinsatser och 3) extracellulära matrisinbäddade tredimensionella organoider. De två senare replikerar in vivo lungfysiologi, med slående cilia och produktion av slem. Ciliärfunktionen fångas med hjälp av en höghastighetsvideokamera i en miljöstyrd kammare. Specialbyggda skript används för analys av CBF. Översättning av CBF-mätningar till kliniken är tänkt att vara ett viktigt kliniskt verktyg för att förutsäga svar på CFTR-modulerande läkemedel per patient.
Introduction
Mätningar av Cilia Beat Frequency (CBF) och mönster har etablerats som diagnostiska verktyg för luftvägssjukdomar såsom primär ciliär dyskinesi (PCD)1. Vid cystisk fibros (CF) orsakar dysfunktion i CF Transmembrane conductance Regulator (CFTR) kloridkanalen uttorkning av luftvägsytans vätska och nedsatt mucociliary clearance2. Ciliär funktion har undersökts in vitro i primära luftvägscellmodeller som en indikator på CFTR-kanalaktivitet3. Det finns dock betydande variationer mellan patienter i CBF som svar på CFTR-modulerande läkemedel, även för patienter med samma CFTR-mutationer 3. Dessutom är effekten av dysfunktionell CFTR-reglerad kloridsekretion på ciliär funktion dåligt förstådd. Det finns för närvarande inget omfattande protokoll som visar provberedning av in vitro-luftvägsmodeller, bildförvärv och analys av CBF.
Nasala epitelark isolerade från nässlemhinneborstningar används direkt för mätningar av ciliär funktion för PCD-diagnos4. Men även om det inte finns någon kontroll över storleken eller kvaliteten på de erhållna nasala epitelarken, varierar CBF beroende på om det mäts på enstaka celler eller cellark och på epitelark cilierade kanter som störs eller störs5. Som sådan kan sekundära dyskinesier orsakade av skador på celler under insamlingen av nässlemhinneborstningar påverka CBF. Primär cellodling av nasala epitelceller och deras differentiering vid luft-vätskegränssnitt (ALI) eller i tredimensionell källarmembranmatris till cilierade luftvägsepitelorganoider ger upphov till cilia som är fria från sekundära dyskinesier 4,6,7,8. Luftvägsepitelceller differentierade vid ALI (hädanefter kallade ALI-modeller) har ansetts vara ett viktigt sekundärt diagnostiskt hjälpmedel som replikerar de ciliära taktmönstren och frekvensen av ex vivo nässlemhinneborstningar6 och möjliggör analys av ciliär ultrastruktur, beatmönster och beatfrekvens samtidigt som patientspecifika defekter bibehålls9 . Ändå finns det skillnader i de metoder som används för att skapa dessa pseudostratifierade, mucociliära differentierade cellmodeller. Olika kulturutvidgnings- eller differentieringsprotokoll kan inducera distinkta epitelfenotyper (cilierade eller sekretoriska)10 och resultera i signifikanta skillnader i CBF11. CBF har kvantifierats i nasala epitelborstningar 4,6,12,13,14,15,16, luftvägsepitelorganoider 14,17,18 och ALI-modellerna 3,4,6,13,19,20, 21. Men bland dessa protokoll finns det stora variationer, och ofta kontrolleras inte många parametrar för. I vissa studier avbildas till exempel CBF på plats medan cellerna i ALI-modellen förblir på den permeabla stödinsatsen 3,19,20,21, medan andra skrapar cellerna från den permeabla stödinsatsen och avbildar dem upphängda i media 4,6,13.
Vidare begränsas den bredare tillämpningen av tekniker som mäter ciliär funktion av den extrema känsligheten hos ciliärfunktionen för förändringar i miljöfaktorer. Miljöfaktorer som temperatur22, luftfuktighet 23,24 och pH 25,26 påverkar ciliärfunktionen och måste regleras för att kvantifiera CBF exakt. De olika fysiologiska parametrarna som används i olika laboratorier och hur de påverkar CBF har granskats tidigare27.
Olika avbildningstekniker och tillvägagångssätt för CBF-mätningar rapporteras i litteraturen. För PCD-diagnostik används videomikroskopi för att mäta ciliär funktion28,29. Nyligen användes en videoanalysalgoritm baserad på differentiell dynamisk mikroskopi för att kvantifiera både CBF- och ciliakoordination i luftvägsepitelceller ALI-modeller 3,30. Denna metod möjliggör karakterisering av ciliär slagning i luftvägsepitelceller på ett snabbt och helautomatiskt sätt, utan att behöva segmentera eller välja regioner. Olika metoder för avbildning och kvantifiering av CBF kan öka skillnaderna som rapporterats i CBF i litteraturen (tilläggsfil 1).
Ett protokoll från kultur till kvantifiering för att effektivisera befintliga metoder, standardisering av kulturförhållanden och bildförvärv, utfört under strikt miljökontrollerade förhållanden, skulle möjliggöra konsekvent, reproducerbar kvantifiering av CBF inom och mellan individer.
Detta protokoll ger en fullständig beskrivning av samlingen av epitelceller, expansions- och differentieringsodlingsförhållanden och kvantifiering av CBF i tre olika luftvägsepitelcellmodellsystem av nasalt ursprung: 1) inbyggda epitelark, 2) ALI-modeller avbildade på permeabla stödinsatser och 3) Extracellulär matris (ECM) -inbäddade tredimensionella organoider (Figur 1 ). Nasala epitelceller erhållna från nasala underlägsna turbinatborstningar används som representanter för luftvägsepitelet eftersom de är ett effektivt surrogat för bronkialepitelceller31 samtidigt som de övervinner det invasiva förfarandet i samband med insamling av bronkialborstningar. Metoden Conditional Reprogramming Cell (CRC) används för att expandera primära luftvägsepitelceller för att skapa ALI-modeller och tredimensionella organoider. Villkorlig omprogrammering av luftvägsepitelceller till ett stamcellsliknande tillstånd induceras genom samodling med tillväxtarresterat fibroblastmatarcellsystem och Rho-associerat kinas (ROCK) -hämmare32. Viktigt är att CRC-metoden ökar befolkningens fördubbling i luftvägsepitelceller samtidigt som de behåller sin vävnadsspecifika differentieringspotential33,34. I alla luftvägsepitelcellmodeller fångas ciliärfunktionen i en temperaturkontrollerad kammare med hjälp av en höghastighetsvideokamera med standardiserade bildförvärvsinställningar. Specialbyggda skript används för kvantifiering av CBF.
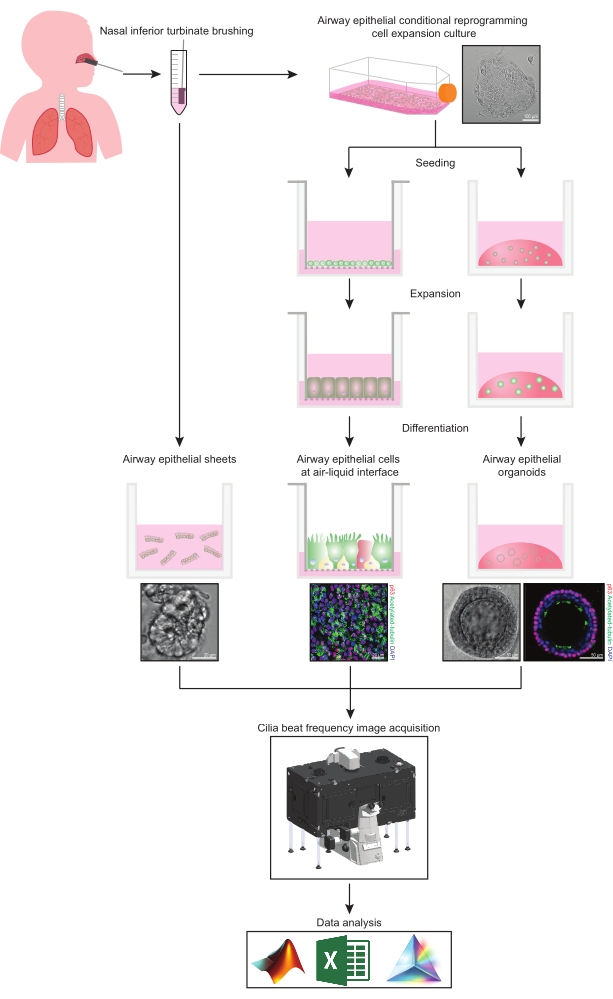
Bild 1: Schematisk beskrivning av arbetsflödet. Efter borstning av deltagarnas nasala underlägsna turbinat används luftvägsepitelceller på ett av två sätt. Antingen isoleras luftvägsepitelark och cilia beat-frekvensen avbildas omedelbart, eller så expanderas luftvägsepitelceller via den villkorliga omprogrammeringscellmetoden. CRC-expanderade luftvägsepitelceller differentieras för att etablera luftvägsepitelceller vid ett luft-vätskegränssnitt eller luftvägsepitelorganoidkulturer. Avbildning av ciliär taktfrekvens förvärvas med hjälp av ett levande cellavbildningsmikroskop med en värme- och fuktighetsmiljökammare och en snabb bildhastighet (>100Hz) vetenskaplig kamera. Dataanalys utförs med hjälp av specialbyggda skript. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Det finns flera faktorer som kan dölja kvantifieringen av CBF i nasala epitelark. Epitelblad bör avbildas inom 3-9 timmar efter provinsamling eftersom ciliärfunktionen är mest stabil under denna tid37. Mindre röda blodkroppar och skräp är mest optimala för avbildning eftersom dessa stör datainsamlingen. När du väljer en ROI för avbildning är det viktigt att välja ett epitelark som kanten inte har skadats eller störts under insamlingen av provet, och inte en enda obunden epitelcell, …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar studiedeltagarna och deras familjer för deras bidrag. Vi uppskattar hjälpen från Sydney Children’s Hospitals (SCH) Randwick andningsavdelning i organisationen och insamlingen av patientbiospecimens – särskilt tack till Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson och Rhonda Bell. Vi tar hjälp av Iveta Slapetova och Renee Whan från Katharina Gaus Light Microscopy Facility inom Mark Wainwright Analytical Centre vid UNSW Sydney. Detta arbete stöds av National Health and Medical Research Council (NHMRC) Australia (GNT1188987), CF Foundation Australia och Sydney Children’s Hospital Foundation. Författarna vill uppmärksamma Luminesce Alliance – Innovation for Children’s Health för dess bidrag och stöd. Luminesce Alliance – Innovation for Children’s Health är ett ideellt kooperativt joint venture mellan Sydney Children’s Hospitals Network, Children’s Medical Research Institute och Children’s Cancer Institute. Det har inrättats med stöd av NSW-regeringen för att samordna och integrera pediatrisk forskning. Luminesce Alliance är också anslutet till University of Sydney och University of New South Wales Sydney. KMA stöds av ett stipendium från Australian Government Research Training Program. LKF stöds av rotaryklubben i Sydney Cove/Sydney Children’s Hospital Foundation och UNSW Universitys stipendier för forskarutbildning.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

