Изготовление и эксплуатация системы микроэлектропорации непрерывного потока с обнаружением пермеабилизации
Summary
Этот протокол описывает методы микропроизводства, необходимые для создания микрофлюидного электропорационного устройства «лаборатория на чипе». Экспериментальная установка выполняет контролируемые одноклеточные трансфекции в непрерывном потоке и может быть расширена до более высокой пропускной способности с популяционным контролем. Представлен анализ, демонстрирующий возможность электрического мониторинга степени пермеабилизации клеточной мембраны в режиме реального времени.
Abstract
Современные терапевтические инновации, такие как CAR-T-клеточная терапия, в значительной степени зависят от вирусно-опосредованной доставки генов. Несмотря на эффективность, этот метод сопровождается высокими производственными затратами, что вызвало интерес к использованию альтернативных методов доставки генов. Электропорация — это электрофизический, невирусный подход к внутриклеточной доставке генов и других экзогенных материалов. При приложении электрического поля клеточная мембрана временно допускает молекулярную доставку в клетку. Как правило, электропорация выполняется на макромасштабе для обработки большого количества клеток. Однако такой подход требует обширной разработки эмпирического протокола, что является дорогостоящим при работе с первичными и труднотрансфектируемыми типами клеток. Длительная разработка протокола в сочетании с требованием больших напряжений для достижения достаточной напряженности электрического поля для проницаемости ячеек привела к разработке микромасштабных электропорационных устройств. Эти микроэлектропорационные устройства изготавливаются с использованием распространенных методов микрофабрикации и позволяют осуществлять более широкий экспериментальный контроль с потенциалом для поддержания высокой пропускной способности. Эта работа основана на микрофлюидно-электропорационной технологии, способной обнаруживать уровень пермеабилизации клеточной мембраны на уровне одной клетки при непрерывном потоке. Однако эта технология была ограничена 4 ячейками, обработанными в секунду, и поэтому здесь предложен и представлен новый подход к увеличению пропускной способности системы. Этот новый метод, обозначаемый как контроль обратной связи на основе клеточной популяции, рассматривает реакцию пермеабилизации клеток на различные условия пульсации электропорации и определяет наиболее подходящие условия импульса электропорации для тестируемого типа клеток. Затем используется режим с более высокой пропускной способностью, где этот «оптимальный» импульс подается на суспензию ячейки в пути. Подробно представлены этапы изготовления устройства, настройки и проведения микрофлюидных экспериментов, а также анализа результатов. Наконец, эта технология микроэлектропорации демонстрируется путем доставки плазмиды ДНК, кодирующей зеленый флуоресцентный белок (GFP), в клетки HEK293.
Introduction
Современные терапевтические инновации в биомедицинских исследованиях, такие как CAR-T (Chimeric Antigen Receptor Engineered T cell) клеточная терапия и генетическое редактирование с использованием CRISPR (кластеризованные регулярно чередующиеся короткие палиндромные повторяющиеся последовательности ДНК) / Cas9, в значительной степени зависят от способности успешно и эффективно доставлять экзогенный материал во внутриклеточное пространство1. В терапии CAR-T золотым стандартом для выполнения этапа доставки генов в производстве клеточной терапии является использование вирусных векторов2. Хотя вирусно-опосредованная доставка генов является эффективным методом доставки, она также имеет несколько недостатков. К ним относятся производственные затраты, цитотоксичность, иммуногенность, потенциал мутагенеза/опухолегенеза и ограничения по размеру гена (генов), который будет доставлен3. Эти ограничения привели к исследованиям и разработкам альтернативных, невирусных технологий доставки.
Электропорация, альтернатива вирусно-опосредованной доставке генов, опирается на применение оптимальной формы сигнала электрического импульса для выполнения трансфекции ДНК, РНК и белка клеток. После применения внешнего электрического поля клеточная мембрана ненадолго компрометируется, что делает клетку восприимчивой к внутриклеточной доставке в противном случае непроницаемых экзогенных материалов4. По сравнению с вирусно-опосредованной доставкой, электропорация выгодна, поскольку она, как правило, безопасна, проста в эксплуатации и имеет низкие эксплуатационные расходы. Электропорация может доставлять как мелкие, так и большие молекулярные грузы и может быть эффективной в трансфекции клеток независимо от линии5. Для достижения желаемых результатов после электропорации, т.е. хорошей жизнеспособности и хорошей эффективности электротрансфекции, необходимо совместно оптимизировать различные экспериментальные параметры. К ним относятся тип ячейки6, плотность клеток, концентрациямолекулы 7, свойства буфера электропорации (например, молекулярный состав, проводимость и осмолярность)8, размер /геометрия электрода9 и форма сигнала электрического импульса (форма, полярность, количество импульсов)10 (см. Рисунок 1 для иллюстрации). Хотя каждый из этих параметров может оказать значительное влияние на результаты экспериментов с электропорацией, форма импульсного сигнала была особенно изучена очень подробно, поскольку электрическая энергия приложенного импульса (импульсов) является корнем внутреннего компромисса между результирующей жизнеспособностью ячейки и эффективностью электротрансфекции8.
Как правило, эксперименты с электропорацией проводятся в макромасштабе, где ячейки суспендируются в 100 микролитров буфера между набором больших параллельно пластинчатых электродов внутри электропорационной кюветы. Электроды обычно изготавливаются из алюминия с расстоянием до электрода 1-4 мм. После того, как ячейки загружены вручную с помощью пипетки, кювета электрически подключается к громоздкому генератору электрических импульсов, где пользователь может установить и применить параметры импульсного сигнала для электропорации суспензии ячейки. Хотя макромасштабная или объемная электропорация может обрабатывать плотность ячеек >106 ячеек /мл, эта функция может быть расточительной при оптимизации настроек формы сигнала электрического импульса. Это особенно беспокоит при электропорации первичных типов клеток, где количество клеточных популяций может быть ограничено. Кроме того, из-за большого расстояния между электродами генератор импульсов должен быть в состоянии подавать большие напряжения для достижения напряженности электрического поля >1 кВ / см11. Эти высокие напряжения вызывают рассеивание резистивной мощности через буфер электролита, что приводит к джоулевому нагреву, что может нанести ущерб резистирующей жизнеспособности ячейки12. Наконец, выполнение электропорации на плотной суспензии ячеек будет последовательно обременено врожденной изменчивостью в результирующей эффективности электротрансфекции и жизнеспособности клеток. Каждая ячейка в суспензии может испытывать различную напряженность электрического поля из-за окружающих клеток. В зависимости от того, увеличивается или уменьшается напряженность испытываемого электрического поля, результирующая жизнеспособность ячейки или эффективность электротрансфекции могут отрицательно влиять накаждую из них 11. Эти недостатки макромасштабной электропорации привели к поиску и развитию альтернативных технологий, которые работают в микромасштабе и позволяют лучше контролировать на уровне одной ячейки.
Область BioMEMS, или биомедицинских микроэлектромеханических систем, проистекает из технологических достижений, сделанных в микроэлектронной промышленности. В частности, использование процессов микропроизводства для разработки микроустройств для продвижения биомедицинских исследований. Эти достижения включают разработку микроэлектродных матриц для электрического мониторинга in vivo 13, емкостных микроэлектродов для электропорации in situ14, миниатюрных устройств15 «орган на кристалле», микрофлюидной диагностики в местах оказания медицинской помощи16, биосенсоров17 и систем доставки лекарств18, включая нано- и микроэлектропорационные устройства 19,20,21 . Благодаря способности проектировать и производить устройства в том же масштабе, что и биологические клетки, нано- и микроэлектропорационные технологии являются выгодными по сравнению с их макромасштабным аналогом22,23. Эти электропорационные устройства устраняют необходимость высоковольтных импульсных применений, поскольку электродные наборы с интервалами от 10 до 100 секунд микрометров обычно интегрируются. Эта особенность резко снижает ток через электролит, что, в свою очередь, уменьшает накопление токсичных продуктов электролиза и эффекты джоульного нагрева в этих системах. Микромасштабные каналы также гарантируют, что гораздо более однородное электрическое поле надежно прикладывается к ячейкам во время применения импульса, что приводит к более последовательным результатам24. Кроме того, микроэлектропорационные устройства также являются обычным явлением для интеграции в микрофлюидную платформу, которая позволяет в будущем интегрироваться в полностью автоматизированную технологию, что является весьма желательной возможностью в производстве клеточной терапии25. Наконец, микромасштабная электропорация позволяет проводить электрический опрос событий электропорации. Например, степень пермеабилизации клеточной мембраны может контролироваться в режиме реального времени на уровне одной клетки26,27. Целью этого метода является описание микропроизводства, работы системы и анализа микрофлюидного одноэлектического микроэлектропорационного устройства, способного измерять степень пермеабилизации клеточной мембраны для оптимизации протоколов электропорации, но увеличивая пропускную способность по сравнению с предыдущим уровнем техники.
Выполнение одноэлементной электропорации больше не является новой техникой, как это было впервые продемонстрировано Рубинским и др. в 2001 году с разработкой технологии электропорации статических ячеек28. Их микроустройство было инновационным, поскольку они были первыми, кто продемонстрировал способность электрически контролировать событие электропорации. Это также привело к разработке статических одноэлементных электропорационных технологий, способных электрически определять степень пермеабилизации клеточной мембраны параллельным образом для увеличения пропускной способности устройств. Однако даже при распараллеливании и периодической обработке этим устройствам сильно не хватает общего количества ячеек, которые они могут обрабатывать в единицу времени29,30. Это ограничение привело к разработке проточных устройств, способных выполнять микроэлектропорацию на уровне одной ячейки при гораздо большей пропускной способности31. Этот переход устройства от статической к проточной среде ограничивает возможность электрического мониторинга степени пермеабилизации клеточной мембраны после применения электропорационного импульса. Метод, описанный в этой работе, устраняет разрыв между этими двумя технологиями, микроэлектропорационной технологией, способной электрически обнаруживать, пульсировать и контролировать степень пермеабилизации клеточной мембраны отдельных клеток непрерывным потоком, последовательным способом.
Эта технология была недавно описана в Zheng et al. В этой работе возможности этой технологии были представлены с завершением параметрического исследования, где как амплитуда, так и продолжительность электропорационного импульса варьировались, а последующий электрический сигнал, указывающий на пермеабилизацию клеточной мембраны, был исследован32. Результаты показали, что увеличение интенсивности электропорационного импульса (т.е. увеличение приложенного электрического поля или увеличение длительности импульса) вызывало увеличение измеряемой пермеабилизации клеточной мембраны. Для дальнейшей проверки системы к суспензии ячейки добавляли общий флуоресцентный индикатор успешной электропорации, йодид пропидия33, и сразу после применения электрического импульса было получено флуоресцентное изображение. Оптический сигнал, т.е. интенсивность флуоресценции йодида пропидия внутри ячейки, был сильно коррелирован с электрическим измерением степени пермеабилизации клеточной мембраны, что подтверждало надежность этого электрического измерения. Однако в этой работе рассматривалась только доставка небольшой молекулы йодида пропидия, которая практически не имеет переводимого значения.
В этой работе введено новое применение этой технологии для улучшения пропускной способности системы при доставке биологически активного вектора плазмидной ДНК (пДНК) и оценке эффективности электротрансфекции клеток, покрытых и культивируемых после электропорации. Хотя предыдущая работа превосходит существующие микроэлектропорационные технологии, которые способны электрически измерять событие электропорации, текущее состояние устройства по-прежнему требует длительного времени прохождения ячейки между набором электродов (~ 250 мс) для выполнения обнаружения ячейки, применения импульсов и измерения пермеабилизации клеточной мембраны. При использовании одного канала это ограничивает пропускную способность до 4 ячеек/с. Для борьбы с этим ограничением вводится новая концепция электропорации с обратной связью на основе клеточной популяции для выполнения электротрансфекции пДНК. Используя гипофизиологический буфер электропорации, эта система позволяет проводить электрический опрос отдельных клеток во множестве применений электропорационных импульсов. На основе электрического отклика затем определяется «оптимальный» импульс электропорации. Затем реализуется режим «высокой пропускной способности», в котором определение пермеабилизации клеточной мембраны сводится к нулю, скорость потока увеличивается, а рабочий цикл электропорационного импульса сопоставляется со временем прохождения ячейки, чтобы обеспечить один импульс на ячейку при прохождении между электродами. Эта работа предоставит подробную информацию о этапах микрофабрикации для изготовления микроустройства, материале / оборудовании и их настройке, необходимой для выполнения экспериментов, а также о работе / анализе устройства и его эффективности электротрансфекции (eTE).
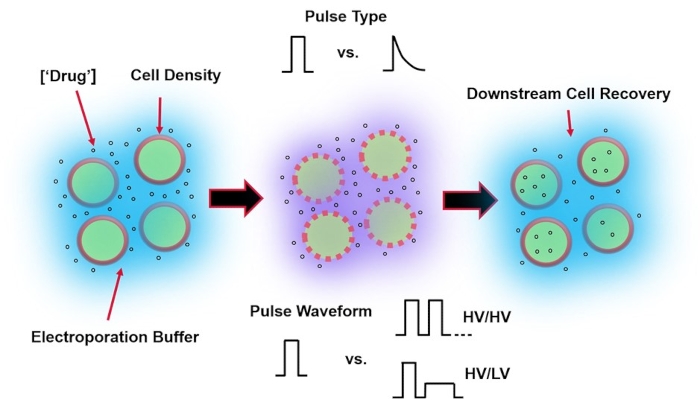
Рисунок 1: Экспериментальные факторы, влияющие на результаты электропорации. (Слева) Суспензия клетки – Важные факторы, которые следует учитывать до начала электропорации, включают: полезную нагрузку (в данном случае пДНК), концентрацию, плотность клеток и свойства буфера электропорации. Следует учитывать свойства электропорационного буфера: проводимость, осмолярность и точный молекулярный состав, способствующий этим значениям. (Средний) Применение импульса – Точный импульсный тип (квадратная волна против экспоненциального распада) и форма импульсного сигнала (одиночный импульс против импульсного поезда) должны быть оптимизированы для максимизации как результирующей жизнеспособности ячейки, так и эффективности электротрансфекции. Общие импульсные цепи, реализуемые в электропорационных процессах, обычно состоят из серии импульсов высокого напряжения (HV) или серии импульсов, вращающихся между величинами импульсов HV и низкого напряжения (LV). (Справа) Этапы обработки восстановления клеток вниз по потоку, в частности, среда культивирования клеток восстановления, в которую переносятся клетки, должны быть оптимизированы. Не показанные (крайний левый), дополнительные этапы обработки вышестоящих ячеек могут быть реализованы для общей оптимизации процесса электропорации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Методология, представленная в этом протоколе, в первую очередь фокусируется на микропроизводстве микрофлюидного устройства, которое затем интегрируется в специализированную экспериментальную установку электропорации. Термин «рецепт», который часто используется при описании специ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы отметить финансовую поддержку Со стороны Национального научного фонда (NSF CBET 0967598, DBI IDBR 1353918) и Аспирантуры Министерства образования США в новых областях точной и персонализированной медицины (P200A150131) для финансирования аспиранта J.J.S. по стипендии.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

