透過処理検出機能付き連続フローマイクロエレクトロポレーションシステムの構築と運用
Summary
このプロトコルでは、ラボオンチップのマイクロ流体エレクトロポレーションデバイスを構築するために必要な微細加工技術について説明します。実験セットアップは、制御された単一細胞レベルのトランスフェクションを連続フローで実行し、集団ベースの制御により、より高いスループットに拡張することができます。細胞膜透過の程度をリアルタイムで電気的に監視する機能を示す分析が提供されます。
Abstract
CAR-T細胞療法などの現在の治療革新は、ウイルスを介した遺伝子送達に大きく依存しています。この技術は効率的ですが、製造コストが高いため、遺伝子導入に代替方法を使用することに関心が寄せられています。エレクトロポレーションは、遺伝子やその他の外因性物質の細胞内送達のための電気物理学的非ウイルス的アプローチです。電界を印加すると、細胞膜は一時的に細胞内への分子送達を可能にする。典型的には、エレクトロポレーションは、多数の細胞を処理するためにマクロスケールで実行される。ただし、このアプローチでは広範な経験的プロトコル開発が必要であり、初代細胞タイプやトランスフェクションが困難な細胞タイプを扱う場合はコストがかかります。長いプロトコル開発は、細胞を透過するのに十分な電界強度を達成するための大きな電圧の要件と相まって、マイクロスケールのエレクトロポレーションデバイスの開発につながりました。これらのマイクロエレクトロポレーションデバイスは、一般的な微細加工技術を使用して製造されており、高いスループット能力を維持する可能性のある、より優れた実験制御を可能にします。この研究は、連続フロー下で単一細胞レベルで細胞膜透過処理のレベルを検出できるマイクロ流体エレクトロポレーション技術を構築しています。しかし、この技術は毎秒4セルの処理に制限されていたため、システムのスループットを向上させるための新しいアプローチが提案され、ここで提示されます。この新しい手法は、細胞集団ベースのフィードバック制御と呼ばれ、さまざまなエレクトロポレーションパルス条件に対する細胞透過応答を考慮し、テスト対象の細胞タイプに最適なエレクトロポレーションパルス条件を決定します。次に、この「最適な」パルスが輸送中の細胞懸濁液に適用されるハイスループットモードが使用されます。デバイスの作製、マイクロ流体実験のセットアップと実行、および結果の分析の手順が詳細に示されています。最後に、このマイクロエレクトロポレーション技術は、緑色蛍光タンパク質(GFP)をコードするDNAプラスミドをHEK293細胞に送達することによって実証されます。
Introduction
CAR-T(キメラ抗原受容体改変T細胞)細胞療法やCRISPR(クラスター化された規則的に間隔を空けた短い回文反復DNA配列)/Cas9を使用した遺伝子編集など、生物医学研究における現在の治療革新は、外因性物質を細胞内空間にうまく効率的に送達する能力に大きく依存しています1。CAR-T療法において、細胞治療製造における遺伝子送達工程を行うゴールドスタンダードは、ウイルスベクター2を用いることである。ウイルス媒介遺伝子送達は効率的な送達モダリティであるが、いくつかの欠点もある。これらには、製造コスト、細胞毒性、免疫原性、突然変異誘発/腫瘍形成の可能性、および送達される遺伝子のサイズ制限が含まれます3。これらの制限は、代替の非ウイルス送達技術の研究開発につながっています。
ウイルスを介した遺伝子送達に代わるエレクトロポレーションは、細胞のDNA、RNA、およびタンパク質トランスフェクションを実行するために、最適な電気パルス波形の適用に依存しています。外部電界の適用後、細胞膜は一時的に損なわれ、細胞は、そうでなければ不透過性の外因性物質の細胞内送達の影響を受けやすくなる4。ウイルス媒介送達と比較して、エレクトロポレーションは、一般的に安全で、操作が容易で、運用コストが低いため、有利です。エレクトロポレーションは、低分子と高分子の両方の貨物を送達でき、系統に関係なく細胞のトランスフェクションに効率的です5。エレクトロポレーション後に望ましい結果、すなわち良好な生存率と良好なエレクトロトランスフェクション効率を達成するには、さまざまな実験パラメータを共最適化する必要があります。これらには、細胞タイプ6、細胞密度、分子濃度7、エレクトロポレーションバッファー特性(分子組成、導電率、浸透圧など)8、電極サイズ/形状9、および電気パルス波形(形状、極性、パルス数)10 が含まれます(図 1 を参照)。これらの各パラメータはエレクトロポレーション実験の結果に大きな影響を与える可能性がありますが、印加されたパルスの電気エネルギーが、結果として生じる細胞生存率とエレクトロトランスフェクション効率との間の固有のトレードオフの根源であるため、パルス波形は特に詳細に研究されています8。
通常、エレクトロポレーション実験はマクロスケールで行われ、細胞はエレクトロポレーションキュベット内の大きな平行平板電極のセットの間に数百マイクロリットルのバッファーに懸濁されます。電極は通常、電極距離が1〜4mmのアルミニウムで製造されます。細胞がピペットで手動でロードされると、キュベットはかさばる電気パルス発生器に電気的に接続され、ユーザーはパルス波形パラメータを設定して適用し、細胞懸濁液をエレクトロポレーションすることができます。マクロスケールまたはバルクエレクトロポレーションは細胞密度>106 cells/mLを処理できますが、この機能は電気パルス波形設定を最適化するときに無駄になる可能性があります。これは、細胞集団数が制限される可能性のある初代細胞タイプをエレクトロポレーションする場合に特に懸念される。さらに、電極間の距離が大きいため、パルス発生器は電界強度>1kV / cm11を達成するために大きな電圧を供給できなければなりません。これらの高電圧は、電解質バッファーを介した抵抗性電力散逸を引き起こし、ジュール加熱をもたらし、結果として生じるセル生存率に有害であり得る12。最後に、細胞の高密度懸濁液に対してエレクトロポレーションを行うことは、結果として生じるエレクトロトランスフェクション効率と細胞生存率の生来の変動性を一貫して負担します。懸濁液中の各細胞は、周囲の細胞のために異なる電界強度を経験する可能性があります。経験した電界強度が増加するか減少するかに応じて、結果として生じる細胞の生存率または電気トランスフェクション効率はそれぞれ悪影響を受ける可能性があります11。マクロスケールのエレクトロポレーションのこれらの欠点は、マイクロスケールで動作し、単一細胞レベルでのより良い制御を可能にする代替技術の追求と開発につながっています。
BioMEMS、または生物医学マイクロ電気機械システムの分野は、マイクロエレクトロニクス業界で行われた技術の進歩に由来しています。具体的には、微細加工プロセスを利用して、バイオメディカル研究の進歩のためのマイクロデバイスを開発します。これらの進歩には、in vivo電気モニタリング用の微小電極アレイ13、in situエレクトロポレーション用の容量性微小電極14、小型化された臓器オンチップデバイス15、マイクロ流体ポイントオブケア診断16、バイオセンサー17、およびナノおよびマイクロエレクトロポレーションデバイス19,20,21を含む薬物送達システム18の開発が含まれます。.生物学的細胞と同じサイズスケールでデバイスを設計および製造する能力のために、ナノおよびマイクロエレクトロポレーション技術は、それらのマクロスケールの対応物と比較して有利である22,23。これらのエレクトロポレーションデバイスは、通常、数十から数百マイクロメートルの間隔の電極セットが統合されているため、高電圧パルスアプリケーションの要件を排除します。この機能により、電解液を流れる電流が大幅に減少し、有毒な電解生成物の蓄積とこれらのシステムでのジュール加熱の影響が減少します。マイクロスケールチャネルはまた、パルス印加中にはるかに均一な電界が細胞に確実に印加されることを保証し、より一貫した結果をもたらす24。さらに、マイクロエレクトロポレーションデバイスがマイクロ流体プラットフォームに統合されることも一般的であり、これは完全に自動化された技術への将来の統合に役立ち、細胞治療製造において非常に望ましい機能である25。最後に、マイクロスケールのエレクトロポレーションは、エレクトロポレーションイベントの電気的尋問を可能にする。例えば、細胞膜透過処理の程度は、単一細胞レベルでリアルタイムでモニターすることができる26、27。この方法の目的は、エレクトロポレーションプロトコルを最適化するために細胞膜透過の程度を測定できるマイクロ流体シングルセルマイクロエレクトロポレーションデバイスの微細加工、システム操作、および分析を説明することですが、以前の最先端よりもスループットを向上させます。
シングルセルレベルのエレクトロポレーションを実行することは、静的セルエレクトロポレーション技術の開発により2001年にRubinskyらによって最初に実証されたため、もはや新しい技術ではありません28。彼らのマイクロデバイスは、エレクトロポレーションのイベントを電気的に監視する能力を最初に実証したため、革新的でした。これにより、細胞膜透過の程度を並列に電気的に検出してデバイスのスループットを向上させることができる静的な単一細胞エレクトロポレーション技術の開発にさらにつながりました。ただし、並列化とバッチ処理を行っても、これらのデバイスは、単位時間29,30あたりに処理できるセルの総数を大幅に欠いています。この制限は、はるかに高いスループットで単一セルレベルのマイクロエレクトロポレーションを行うことができるフロースルーデバイスの開発につながった31。静的環境からフロースルー環境へのこのデバイス移行は、エレクトロポレーションパルスの適用後の細胞膜透過の程度を電気的に監視する能力を制限する。この研究で説明した方法は、これら2つの技術、つまり個々の細胞の細胞膜透過の程度を連続的に連続的に検出、パルス、および監視できるマイクロエレクトロポレーション技術の間のギャップを埋めます。
この技術は最近、Zhengらで説明されました。その作業では、この技術の機能は、エレクトロポレーションパルスの振幅と持続時間の両方を変化させ、細胞膜透過処理を示すその後の電気信号が調査されたパラメトリック研究の完了とともに導入されました32。結果は、エレクトロポレーションパルスの強度の増加(すなわち、印加電界の増加またはパルス持続時間の増加)が、測定された細胞膜透過処理の増加を引き起こすことを示した。系をさらに検証するために、エレクトロポレーションの成功を示す一般的な蛍光指標であるヨウ化プロピジウム33を細胞懸濁液に添加し、電気パルスを印加した直後に蛍光画像を撮影しました。光信号、すなわち細胞内のヨウ化プロピジウムの蛍光強度は、細胞膜透過度の電気的測定と強く相関し、この電気的測定の信頼性を検証した。しかし、この研究では、翻訳可能な重要性がほとんどまたはまったくないヨウ化プロピジウムの送達のみを考慮しました。
この研究では、生物学的に活性なプラスミドDNA(pDNA)ベクターを送達し、エレクトロポレーション後に再播種および培養された細胞の電気トランスフェクション効率を評価しながら、システムのスループットを改善するために、この技術の新しいアプリケーションを紹介します。以前の研究は、エレクトロポレーションのイベントを電気的に測定できる既存のマイクロエレクトロポレーション技術よりも優れていますが、デバイスの現在の状態では、細胞検出、パルス印加、および細胞膜透過測定を実行するために、電極セット間の長い細胞通過時間(~250ミリ秒)が必要です。単一チャネルでは、スループットが 4 セル/秒に制限されます。この制限に対処するために、細胞集団ベースのフィードバック制御エレクトロポレーションの新しい概念が導入され、pDNAエレクトロトランスフェクションが実行されます。低生理伝導率エレクトロポレーションバッファーを使用することにより、このシステムは、多数のエレクトロポレーションパルスアプリケーションにわたって単一細胞の電気的問い合わせを可能にします。次に、電気的応答に基づいて、「最適な」エレクトロポレーションパルスが決定されます。次に、「ハイスループット」モードが実装され、細胞膜透過処理の決定が無効になり、流量が増加し、エレクトロポレーションパルスデューティサイクルが細胞の通過時間に一致して、電極間を通過するセルあたり1パルスが保証されます。この作業では、マイクロデバイスの製造のための微細加工手順、実験を実行するために必要な材料/機器とそのセットアップ、およびデバイスの操作/分析とその電気トランスフェクション効率(eTE)について詳しく説明します。
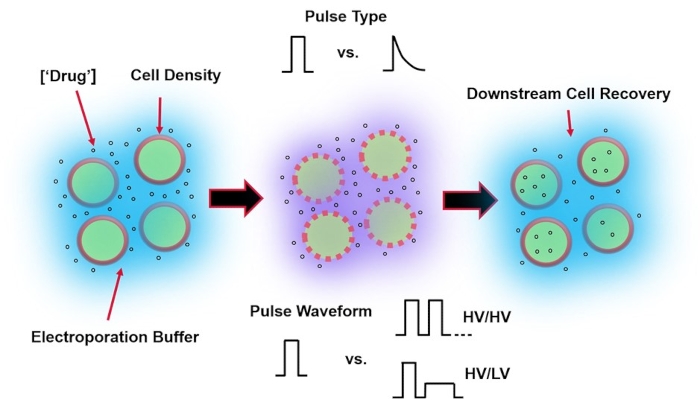
図1:エレクトロポレーションの結果に影響を与える実験的要因 。 (左)細胞懸濁液-エレクトロポレーションの開始前に考慮すべき重要な要素には、ペイロード(この場合はpDNA)、濃度、細胞密度、およびエレクトロポレーションバッファーの特性が含まれます。考慮すべきエレクトロポレーションバッファーの特性は、導電率、浸透圧、およびこれらの値に寄与する正確な分子組成です。(中)パルスアプリケーション-正確なパルスタイプ(方形波対指数関数的減衰)およびパルス波形(単一パルス対パルス列)を最適化して、結果として得られる細胞生存率と電気トランスフェクション効率の両方を最大化する必要があります。エレクトロポレーションプロセスで実装される一般的なパルス列は、通常、一連の高電圧(HV)パルス、またはHVパルスと低電圧(LV)パルス振幅の間で回転する一連のパルスで構成されます。(右)細胞回収-下流処理ステップ、特に細胞が転送される回収細胞培養培地を最適化する必要があります。特徴のない(左端)、エレクトロポレーションプロセス全体の最適化のために、追加のアップストリームセル処理ステップを実装できます。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
このプロトコル内で提示される方法論は、主にマイクロ流体デバイスの微細加工に焦点を当てており、その後、特殊なエレクトロポレーション実験セットアップに統合されます。微細加工プロセスの詳細を説明するときによく使用される「レシピ」という用語は、機能するデバイスを正常に製造するために各ステップに従う/最適化することの重要性を示唆しています。ただし、UV露光時間/エ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、全米科学財団(NSF CBET 0967598、DBI IDBR 1353918)および米国教育省の精密および個別化医療の新興分野における大学院トレーニング(P200A150131)による、大学院生J.J.S.のフェローシップへの資金提供に対する財政的支援に感謝したいと思います。
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

