De fabricage en werking van een continu flow, micro-elektroporatiesysteem met permeabilisatiedetectie
Summary
Dit protocol beschrijft de microfabricagetechnieken die nodig zijn om een lab-on-a-chip, microfluïdisch elektroporatieapparaat te bouwen. De experimentele opstelling voert gecontroleerde transfecties op één celniveau uit in een continue stroom en kan worden uitgebreid naar hogere doorvoersnelheden met populatiegebaseerde controle. Er wordt een analyse verstrekt die de mogelijkheid toont om de mate van celmembraanpermeabilisatie in realtime elektrisch te bewaken.
Abstract
Huidige therapeutische innovaties, zoals CAR-T-celtherapie, zijn sterk afhankelijk van viraal gemedieerde genafgifte. Hoewel efficiënt, gaat deze techniek gepaard met hoge productiekosten, wat heeft geleid tot een interesse in het gebruik van alternatieve methoden voor genafgifte. Elektroporatie is een elektrofysische, niet-virale benadering voor de intracellulaire afgifte van genen en andere exogene materialen. Bij het aanbrengen van een elektrisch veld maakt het celmembraan tijdelijk moleculaire afgifte in de cel mogelijk. Meestal wordt elektroporatie uitgevoerd op de macroschaal om grote aantallen cellen te verwerken. Deze aanpak vereist echter uitgebreide empirische protocolontwikkeling, wat kostbaar is bij het werken met primaire en moeilijk te transfecteren celtypen. Langdurige protocolontwikkeling, in combinatie met de vereiste van grote spanningen om voldoende elektrische veldsterkten te bereiken om de cellen te permeabiliseren, heeft geleid tot de ontwikkeling van elektroporatie-apparaten op microschaal. Deze micro-elektroporatie-apparaten worden vervaardigd met behulp van gangbare microfabricagetechnieken en zorgen voor een grotere experimentele controle met het potentieel om hoge doorvoermogelijkheden te behouden. Dit werk bouwt voort op een microfluïdische elektroporatietechnologie die in staat is om het niveau van celmembraanpermeabilisatie op eencellig niveau onder continue stroom te detecteren. Deze technologie was echter beperkt tot 4 cellen die per seconde werden verwerkt, en daarom wordt hier een nieuwe aanpak voor het verhogen van de systeemdoorvoer voorgesteld en gepresenteerd. Deze nieuwe techniek, aangeduid als celpopulatie-gebaseerde feedbackcontrole, beschouwt de celpermeabilisatierespons op een verscheidenheid aan elektroporatiepulserende omstandigheden en bepaalt de meest geschikte elektroporatiepulsomstandigheden voor het celtype dat wordt getest. Vervolgens wordt een modus met een hogere doorvoer gebruikt, waarbij deze ‘optimale’ puls wordt toegepast op de celsuspensie tijdens het transport. De stappen voor het fabriceren van het apparaat, het opzetten en uitvoeren van de microfluïdische experimenten en het analyseren van de resultaten worden in detail gepresenteerd. Ten slotte wordt deze micro-elektroporatietechnologie gedemonstreerd door een DNA-plasmide af te leveren dat codeert voor groen fluorescerend eiwit (GFP) in HEK293-cellen.
Introduction
Huidige therapeutische innovaties in biomedisch onderzoek, zoals CAR-T (Chimeric Antigen Receptor Engineered T cell) celtherapie en genetische bewerking met behulp van CRISPR (clustered regular interspaced short palindromic repeat DNA sequences)/Cas9, zijn sterk afhankelijk van het vermogen om exogene stof zowel succesvol als efficiënt in de intracellulaire ruimte af te leveren1. In CAR-T-therapie is de gouden standaard om de genafgiftestap uit te voeren in de productie van celtherapie het gebruik van virale vectoren2. Hoewel viraal-gemedieerde genafgifte een efficiënte leveringsmodaliteit is, heeft het ook verschillende nadelen. Deze omvatten productiekosten, cytotoxiciteit, immunogeniciteit, mutagenese/tumorigenesepotentieel en groottebeperkingen op het te leveren gen(en)3. Deze beperkingen hebben geleid tot het onderzoek en de ontwikkeling van alternatieve, niet-virale toedieningstechnologieën.
Elektroporatie, een alternatief voor virale gemedieerde genafgifte, vertrouwt op de toepassing van een optimale elektrische pulsgolfvorm om DNA-, RNA- en eiwittransfecties van cellen uit te voeren. Na de toepassing van een extern elektrisch veld wordt het celmembraan kortstondig aangetast, waardoor de cel gevoelig wordt voor de intracellulaire afgifte van anders ondoordringbare exogene materialen4. In vergelijking met virale gemedieerde toediening is elektroporatie voordelig omdat het over het algemeen veilig is, gemakkelijk te bedienen en lage bedrijfskosten heeft. Elektroporatie kan zowel kleine als grote moleculaire lading leveren en kan efficiënt zijn in het transfecteren van cellen, ongeacht afstamming5. Om gewenste resultaten na elektroporatie te bereiken, d.w.z. een goede levensvatbaarheid en een goede elektrotransfectie-efficiëntie, moeten verschillende experimentele parameters worden geco-geoptimaliseerd. Deze omvatten celtype6, celdichtheid, molecuulconcentratie7, elektroporatiebuffereigenschappen (bijv. Moleculaire samenstelling, geleidbaarheid en osmolariteit)8, elektrodegrootte/geometrie9 en elektrische pulsgolfvorm (vorm, polariteit, aantal pulsen)10 (zie figuur 1 voor een illustratie). Hoewel elk van deze parameters een significant effect kan hebben op de uitkomsten van elektroporatie-experimenten, is de pulsgolfvorm vooral in detail bestudeerd, omdat de elektrische energie van de toegepaste puls (en) de wortel is van de intrinsieke afweging tussen de resulterende cel levensvatbaarheid en elektrotransfectie-efficiëntie8.
Typisch worden elektroporatie-experimenten uitgevoerd op macroschaal, waarbij cellen worden opgehangen in 100s microliter buffer tussen een set grote, parallelle plaatelektroden in een elektroporatiecuvet. De elektroden worden meestal vervaardigd uit aluminium met een elektrodeafstand van 1-4 mm. Zodra de cellen handmatig via de pipet zijn geladen, wordt de cuvette elektrisch verbonden met een omvangrijke, elektrische pulsgenerator waar de gebruiker de pulsgolfvormparameters kan instellen en toepassen om de celsuspensie te elektropoteren. Hoewel macroschaal of bulkelektroporatie celdichtheden > 106 cellen / ml kan verwerken, kan deze functie verspillend zijn bij het optimaliseren van de instellingen voor de elektrische pulsgolfvorm. Dit is met name van belang bij het elektropoderen van primaire celtypen waarbij de celpopulatieaantallen beperkt kunnen zijn. Bovendien moet de pulsgenerator vanwege de grote afstand tussen de elektroden grote spanningen kunnen leveren om elektrische veldsterktes te bereiken >1kV / cm11. Deze hoge spanningen veroorzaken resistieve vermogensdissipatie door de elektrolytenbuffer, wat resulteert in Joule-verwarming, wat schadelijk kan zijn voor de resulterende levensvatbaarheid van de cel12. Ten slotte zal het uitvoeren van elektroporatie op een dichte suspensie van cellen consequent worden belast met een aangeboren variabiliteit in de resulterende elektrotransfectie-efficiëntie en cel levensvatbaarheid. Elke cel in suspensie kan een andere elektrische veldsterkte ervaren als gevolg van de omliggende cellen. Afhankelijk van of de ervaren elektrische veldsterkte wordt verhoogd of verlaagd, kan de resulterende levensvatbaarheid van de cel of de efficiëntie van elektrotransfectie elk negatief worden beïnvloed11. Deze nadelen van elektroporatie op macroschaal hebben geleid tot het nastreven en ontwikkelen van alternatieve technologieën die op microschaal werken en een betere controle op het niveau van één cel mogelijk maken.
Het gebied van BioMEMS, of biomedische micro-elektromechanische systemen, komt voort uit de technologische vooruitgang in de micro-elektronica-industrie. In het bijzonder het gebruik van microfabricageprocessen om micro-apparaten te ontwikkelen voor de vooruitgang van biomedisch onderzoek. Deze ontwikkelingen omvatten de ontwikkeling van micro-elektrode-arrays voor in vivo elektrische monitoring13, capacitieve micro-elektroden voor in situ elektroporatie14, geminiaturiseerde organ-on-a-chip-apparaten15, microfluïdische point-of-care diagnostiek16, biosensoren17 en medicijnafgiftesystemen18, inclusief nano- en micro-elektroporatieapparaten 19,20,21 . Vanwege de mogelijkheid om apparaten te ontwerpen en te produceren op dezelfde schaal als biologische cellen, zijn nano- en micro-elektroporatietechnologieën voordelig in vergelijking met hun tegenhanger op macroschaal22,23. Deze elektroporatie-apparaten elimineren de vereiste van hoogspanningspulstoepassingen, omdat elektrodesets met afstanden van 10s tot 100s van micrometers meestal zijn geïntegreerd. Deze functie vermindert de stroom door de elektrolyt drastisch, wat op zijn beurt de accumulatie van toxische elektrolyseproducten en de effecten van Joule-verwarming in deze systemen vermindert. De kanalen op microschaal zorgen er ook voor dat een veel uniformer elektrisch veld betrouwbaar wordt toegepast op de cellen tijdens de pulstoepassing, wat resulteert in consistentere resultaten24. Daarnaast is het ook gebruikelijk dat micro-elektroporatie-apparaten worden geïntegreerd in een microfluïdisch platform dat zich leent voor toekomstige integratie in een volledig geautomatiseerde technologie, een zeer wenselijke mogelijkheid in de productie van celtherapie25. Ten slotte maakt elektroporatie op microschaal de elektrische ondervraging van elektroporatiegebeurtenissen mogelijk. De mate van celmembraanpermeabilisatie kan bijvoorbeeld in realtime worden bewaakt op een enkel celniveau26,27. Het doel van deze methode is om de microfabricage, systeemwerking en analyse te beschrijven van een microfluïdisch, eencellig micro-elektroporatieapparaat dat in staat is om de mate van celmembraanpermeabilisatie te meten voor het optimaliseren van elektroporatieprotocollen, maar toch de doorvoer te verhogen ten opzichte van de vorige state-of-the-art.
Het uitvoeren van elektroporatie op eencellig niveau is niet langer een nieuwe techniek, zoals het voor het eerst werd aangetoond door Rubinsky et al. in 2001 met de ontwikkeling van een statische celelektroporatietechnologie28. Hun micro-apparaat was innovatief omdat ze de eersten waren die het vermogen demonstreerden om het geval van elektroporatie elektrisch te volgen. Dit heeft verder geleid tot de ontwikkeling van statische, eencellige elektroporatietechnologieën die in staat zijn om de mate van celmembraanpermeabilisatie op een parallelle manier elektrisch te detecteren om de doorvoer van de apparaten te verhogen. Maar zelfs met parallellisatie en batchverwerking missen deze apparaten ernstig het totale aantal cellen dat ze per tijdseenheidkunnen verwerken 29,30. Deze beperking heeft geleid tot de ontwikkeling van doorstroomapparaten die in staat zijn om micro-elektroporatie op eencellig niveau uit te voeren met een veel grotere doorvoer31. Deze apparaatovergang, van statische naar doorstroomomgeving, beperkt de mogelijkheid om de mate van celmembraanpermeabilisatie elektrisch te bewaken na de toepassing van de elektroporatiepuls. De methode die in dit werk wordt beschreven, overbrugt de kloof tussen deze twee technologieën, een micro-elektroporatietechnologie die in staat is om de mate van celmembraanpermeabilisatie van individuele cellen elektrisch te detecteren, pulseren en bewaken, op een continue stroom, seriële manier.
Deze technologie werd onlangs beschreven in Zheng et al. In dat werk werden de mogelijkheden van deze technologie geïntroduceerd met de voltooiing van een parametrische studie, waarbij zowel de amplitude als de duur van de elektroporatiepuls werden gevarieerd en het daaropvolgende elektrische signaal, indicatief voor celmembraanpermeabilisatie, werd onderzocht32. De resultaten toonden aan dat een toename van de intensiteit van de elektroporatiepuls (d.w.z. toename van het toegepaste elektrische veld of toename van de pulsduur) een toename van de gemeten celmembraanpermeabilisatie veroorzaakte. Om het systeem verder te valideren, werd een gemeenschappelijke fluorescerende indicator van succesvolle elektroporatie, propidiumjodide33, toegevoegd aan de celsuspensie en werd een fluorescentiebeeld vastgelegd onmiddellijk na het aanbrengen van de elektrische puls. Het optische signaal, d.w.z. de fluorescentie-intensiteit van propidiumjodide in de cel, was sterk gecorreleerd met de elektrische meting van de mate van celmembraanpermeabilisatie, waardoor de betrouwbaarheid van deze elektrische meting werd geverifieerd. Dit werk hield echter alleen rekening met de levering van het kleine molecuul propidiumjodide, dat weinig tot geen vertaalbare betekenis heeft.
In dit werk wordt een nieuwe toepassing van deze technologie geïntroduceerd om de doorvoer van het systeem te verbeteren, terwijl een biologisch actieve plasmide-DNA (pDNA) -vector wordt afgeleverd en de elektrotransfectie-efficiëntie van cellen die opnieuw worden geplateerd en gekweekt na elektroporatie wordt beoordeeld. Hoewel het vorige werk beter presteert dan bestaande micro-elektroporatietechnologieën die in staat zijn om elektrisch de gebeurtenis van elektroporatie te meten, vereist de huidige toestand van het apparaat nog steeds lange celtransittijden tussen de elektrodenset (~ 250 ms) om de celdetectie, pulstoepassing en de celmembraanpermeabilisatiemeting uit te voeren. Met een enkel kanaal beperkt dit de doorvoer tot 4 cellen/s. Om deze beperking te bestrijden, wordt een nieuw concept van op celpopulatie gebaseerde feedbackgestuurde elektroporatie geïntroduceerd om pDNA-elektrotransfectie uit te voeren. Door gebruik te maken van een hypofysiologische geleidbaarheid elektroporatiebuffer, maakt dit systeem de elektrische ondervraging van afzonderlijke cellen mogelijk in een groot aantal elektroporatiepulstoepassingen. Op basis van de elektrische respons wordt vervolgens een ‘optimale’ elektroporatiepuls bepaald. Vervolgens wordt een ‘high-throughput’-modus geïmplementeerd waarbij de bepaling van de celmembraanpermeabilisatie teniet wordt gedaan, het debiet wordt verhoogd en de duty cycle van de elektroporatiepuls wordt afgestemd op de transittijd van de cel om één puls per cel in transit tussen de elektroden te garanderen. Dit werk zal uitgebreide details geven over de microfabricagestappen voor de productie van het micro-apparaat, het materiaal / de apparatuur en hun opstelling die nodig is om de experimenten uit te voeren, en de werking / analyse van het apparaat en zijn elektrotransfectie-efficiëntie (eTE).
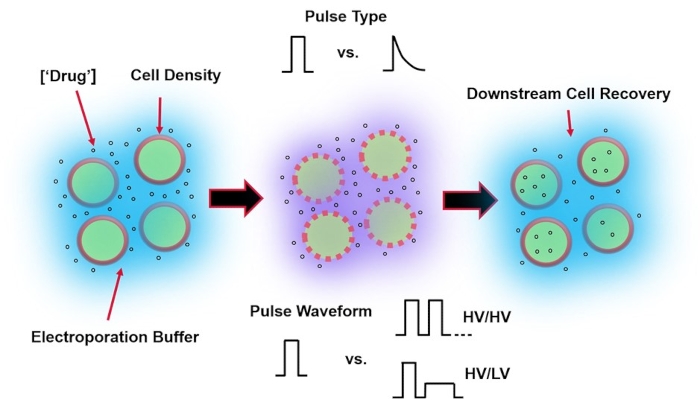
Figuur 1: Experimentele factoren die van invloed zijn op de uitkomsten van elektroporatie. (Links) Celsuspensie-Belangrijke factoren om te overwegen voorafgaand aan het begin van elektroporatie zijn: Payload (in dit geval pDNA), concentratie, celdichtheid en elektroporatiebuffereigenschappen. Elektroporatiebuffereigenschappen om te overwegen zijn geleidbaarheid, osmolariteit en de exacte moleculaire samenstelling die bijdraagt aan deze waarden. (Midden) Pulstoepassing – Het exacte pulstype (blokgolf versus exponentieel verval) en pulsgolfvorm (enkele puls versus pulstrein) moeten worden geoptimaliseerd om zowel de resulterende levensvatbaarheid van de cel als de efficiëntie van elektrotransfectie te maximaliseren. Gemeenschappelijke pulstreinen die worden geïmplementeerd in elektroporatieprocessen zijn meestal samengesteld uit een reeks hoogspanningspulsen (HV) of een reeks pulsen die roteren tussen HV- en laagspanningspulsen (LV). (Rechts) Cell Recovery-Down-stream verwerkingsstappen, in het bijzonder de recovery cell culture media waar cellen naar worden overgebracht, moeten worden geoptimaliseerd. Niet weergegeven (uiterst links), kunnen extra upstream celverwerkingsstappen worden geïmplementeerd voor algehele elektroporatieprocesoptimalisatie. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De methodologie die in dit protocol wordt gepresenteerd, richt zich voornamelijk op de microfabricage van een microfluïdisch apparaat dat vervolgens wordt geïntegreerd in een gespecialiseerde elektroporatie-experimentele opstelling. De term ‘recept’, die vaak wordt gebruikt bij het beschrijven van de specifieke kenmerken van het microfabricageproces, wijst op het belang van het volgen / optimaliseren van elke stap om een werkend apparaat met succes te fabriceren. Bepaalde kritieke stappen binnen het proces, wanneer ze …
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs willen graag financiële steun erkennen van de National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) en de Graduate Training van het Amerikaanse ministerie van Onderwijs in opkomende gebieden van precisie en gepersonaliseerde geneeskunde (P200A150131) voor het financieren van afgestudeerde student J.J.S. op fellowship.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

