Fabrikasjon og drift av et kontinuerlig strømnings-, mikroelektroporeringssystem med permeabiliseringsdeteksjon
Summary
Denne protokollen beskriver mikrofabrikasjonsteknikkene som kreves for å bygge en lab-on-a-chip, mikrofluidisk elektroporeringsenhet. Det eksperimentelle oppsettet utfører kontrollerte transfeksjoner på enkeltcellenivå i en kontinuerlig flyt og kan utvides til høyere gjennomstrømning med populasjonsbasert kontroll. En analyse er gitt som viser evnen til elektrisk å overvåke graden av cellemembranpermeabilisering i sanntid.
Abstract
Nåværende terapeutiske innovasjoner, som CAR-T-celleterapi, er sterkt avhengige av virusmediert genlevering. Selv om den er effektiv, er denne teknikken ledsaget av høye produksjonskostnader, noe som har ført til interesse for å bruke alternative metoder for genlevering. Elektroporering er en elektrofysisk, ikke-viral tilnærming for intracellulær levering av gener og andre eksogene materialer. Ved påføring av et elektrisk felt tillater cellemembranen midlertidig molekylær levering inn i cellen. Vanligvis utføres elektroporering på makroskala for å behandle et stort antall celler. Denne tilnærmingen krever imidlertid omfattende empirisk protokollutvikling, noe som er kostbart når man arbeider med primære og vanskelige å transfekte celletyper. Langvarig protokollutvikling, kombinert med kravet om store spenninger for å oppnå tilstrekkelige elektriske feltstyrker for å gjennomsyre cellene, har ført til utvikling av mikroskala elektroporeringsenheter. Disse mikroelektroporeringsenhetene er produsert ved hjelp av vanlige mikrofabrikasjonsteknikker og gir mulighet for større eksperimentell kontroll med potensial til å opprettholde høy gjennomstrømningskapasitet. Dette arbeidet bygger på en mikrofluidisk-elektroporeringsteknologi som er i stand til å oppdage nivået av cellemembranpermeabilisering på enkeltcellenivå under kontinuerlig strømning. Imidlertid ble denne teknologien begrenset til 4 celler behandlet per sekund, og dermed foreslås og presenteres en ny tilnærming for å øke systemgjennomstrømningen her. Denne nye teknikken, betegnet som cellepopulasjonsbasert tilbakemeldingskontroll, vurderer cellepermeabiliseringsresponsen på en rekke elektroporeringspulserende forhold og bestemmer de best egnede elektroporasjonspulsforholdene for celletypen som testes. Deretter brukes en høyere gjennomstrømningsmodus, hvor denne “optimale” pulsen påføres cellesuspensjonen under transport. Trinnene for å fremstille enheten, sette opp og kjøre mikrofluidiske eksperimenter og analysere resultatene presenteres i detalj. Til slutt demonstreres denne mikroelektroporeringsteknologien ved å levere en DNA-plasmidkoding for grønt fluorescerende protein (GFP) i HEK293-celler.
Introduction
Nåværende terapeutiske innovasjoner innen biomedisinsk forskning, som CAR-T (Chimeric Antigen Receptor Engineered T cell) celleterapi og genetisk redigering ved hjelp av CRISPR (gruppert regelmessig interspaced korte palindromiske repeterende DNA-sekvenser) / Cas9, er sterkt avhengig av evnen til å levere eksogent materiale både vellykket og effektivt inn i det intracellulære rommet1. I CAR-T-terapi er gullstandarden for å utføre genleveringstrinnet i celleterapiproduksjon ved bruk av virale vektorer2. Selv om virusmediert genlevering er en effektiv leveringsmodalitet, har den også flere ulemper. Disse inkluderer produksjonskostnader, cytotoksisitet, immunogenisitet, mutagenese / tumorigenese potensial, og størrelsesbegrensninger på genet (e) som skal leveres3. Disse begrensningene har ført til forskning og utvikling av alternative, ikke-virale leveringsteknologier.
Elektroporering, et alternativ til virusmediert genlevering, er avhengig av anvendelse av en optimal elektrisk pulsbølgeform for å utføre DNA-, RNA- og proteintransfeksjoner av celler. Etter påføring av et eksternt elektrisk felt, blir cellemembranen kort kompromittert, noe som gjør cellen utsatt for intracellulær levering av ellers ugjennomtrengelige eksogene materialer4. Sammenlignet med virusmediert levering er elektroporering fordelaktig, da det generelt er trygt, enkelt å betjene og har lave driftskostnader. Elektroporering kan levere både liten og stor molekylær last og kan være effektiv i transfektering av celler uavhengig av avstamning5. For å oppnå ønskelige resultater etter elektroporering, dvs. god levedyktighet og god elektrotransfeksjonseffektivitet, må en rekke eksperimentelle parametere samoptimaliseres. Disse inkluderer celletype6, celletetthet, molekylkonsentrasjon7, elektroporeringsbufferegenskaper (f.eks. molekylær sammensetning, ledningsevne og osmolaritet)8, elektrodestørrelse/geometri9 og elektrisk pulsbølgeform (form, polaritet, antall pulser)10 (se figur 1 for illustrasjon). Selv om hver av disse parametrene kan ha en betydelig effekt på resultatene av elektroporeringseksperimenter, har pulsbølgeform blitt spesielt studert i detalj, da den elektriske energien til den påførte pulsen (e) er roten til den iboende avveiningen mellom den resulterende cellens levedyktighet og elektrotransfeksjonseffektivitet8.
Vanligvis utføres elektroporeringseksperimenter på makroskalaen, hvor celler suspenderes i 100-tallet av mikroliter buffer mellom et sett med store, parallelle plateelektroder i en elektroporasjonskyvett. Elektrodene er vanligvis produsert av aluminium med en elektrodeavstand på 1-4 mm. Når cellene er lastet manuelt via pipette, kobles kyvetten elektrisk til en klumpete, elektrisk pulsgenerator hvor brukeren kan stille inn og bruke pulsbølgeformparametrene for å elektroporere cellesuspensjonen. Selv om makroskala eller bulkelektroporering kan behandle celletettheter >106 celler / ml, kan denne funksjonen være bortkastet når du optimaliserer innstillingene for elektrisk pulsbølgeform. Dette er spesielt bekymringsfullt ved elektropulering av primære celletyper der cellepopulasjonstallene kan begrenses. I tillegg, på grunn av den store avstanden mellom elektrodene, må pulsgeneratoren kunne levere store spenninger for å oppnå elektriske feltstyrker >1kV / cm11. Disse høye spenningene forårsaker resistiv strømspredning gjennom elektrolyttbufferen som resulterer i Joule-oppvarming, noe som kan være skadelig for den resulterende cellens levedyktighet12. Til slutt vil elektroporering på en tett suspensjon av celler konsekvent bli belastet med en medfødt variasjon i den resulterende elektrotransfeksjonseffektiviteten og cellens levedyktighet. Hver celle i suspensjon kan oppleve en annen elektrisk feltstyrke på grunn av de omkringliggende cellene. Avhengig av om den erfarne elektriske feltstyrken enten økes eller reduseres, kan den resulterende cellens levedyktighet eller elektrotransfeksjonseffektivitet hver bli negativt påvirket11. Disse ulempene med makroskala elektroporering har ført til jakten og utviklingen av alternative teknologier som opererer på mikroskala og gir bedre kontroll på enkeltcellenivå.
Feltet BioMEMS, eller biomedisinske mikro-elektromekaniske systemer, stammer fra de teknologiske fremskrittene som er gjort i mikroelektronikkindustrien. Spesielt ved hjelp av mikrofabrikasjonsprosesser for å utvikle mikro-enheter for å fremme biomedisinsk forskning. Disse fremskrittene inkluderer utvikling av mikroelektrodearrayer for in vivo elektrisk overvåking 13, kapasitive mikroelektroder for in situ elektroporering 14, miniatyriserte organ-on-a-chip-enheter15, mikrofluidisk pasientnær diagnostikk 16, biosensorer 17 og legemiddelleveringssystemer 18, inkludert nano- og mikroelektroporeringsenheter 19,20,21 . På grunn av evnen til å designe og produsere enheter i samme størrelsesskala som biologiske celler, er nano- og mikroelektroporeringsteknologier fordelaktige sammenlignet med deres makroskala motpart22,23. Disse elektroporeringsenhetene eliminerer kravet til høyspenningspulsapplikasjoner, da elektrodesett med avstander på 10s til 100s mikrometer vanligvis er integrert. Denne funksjonen reduserer strømmen drastisk gjennom elektrolytten, noe som igjen reduserer akkumuleringen av giftige elektrolyseprodukter og effekten av Joule-oppvarming i disse systemene. Mikroskalakanalene sikrer også at et mye mer ensartet elektrisk felt påføres cellene pålitelig under pulspåføring, noe som resulterer i mer konsistente utfall24. I tillegg er det også vanlig at mikroelektroporeringsenheter integreres i en mikrofluidisk plattform som egner seg for fremtidig integrering i en helautomatisk teknologi, en svært ønskelig evne i celleterapiproduksjon25. Til slutt tillater mikroskala elektroporering elektrisk avhør av elektroporeringshendelser. For eksempel kan graden av cellemembranpermeabilisering overvåkes i sanntid på et enkeltcellenivå26,27. Formålet med denne metoden er å beskrive mikrofabrikasjon, systemoperasjon og analyse av en mikrofluidisk, encellet mikroelektroporeringsenhet som er i stand til å måle graden av cellemembranpermeabilisering for optimalisering av elektroporeringsprotokoller, men likevel øke gjennomstrømningen i forhold til den forrige toppmoderne.
Å utføre encellet nivå elektroporering er ikke lenger en ny teknikk, som den først ble demonstrert av Rubinsky et al. i 2001 med utviklingen av en statisk celleelektroporeringsteknologi28. Deres mikro-enhet var nyskapende som de var de første til å demonstrere evnen til å elektrisk overvåke hendelsen av elektroporering. Dette har videre ført til utvikling av statiske, encellede elektroporeringsteknologier som er i stand til elektrisk å oppdage graden av cellemembranpermeabilisering på en parallellisert måte for å øke gjennomstrømningen til enhetene. Men selv med parallellisering og batchbehandling mangler disse enhetene alvorlig det totale antallet celler de kan behandle per tidsenhet29,30. Denne begrensningen har ført til utvikling av gjennomstrømningsanordninger som er i stand til å utføre mikroelektroporering på enkeltcellenivå ved mye større gjennomstrømninger31. Denne enhetsovergangen, fra statisk til gjennomstrømningsmiljø, begrenser muligheten til elektrisk overvåking av graden av cellemembranpermeabilisering etter påføring av elektroporasjonspulsen. Metoden beskrevet i dette arbeidet bygger bro over gapet mellom disse to teknologiene, en mikroelektroporeringsteknologi som er i stand til elektrisk å oppdage, pulsere og overvåke graden av cellemembranpermeabilisering av individuelle celler, på en kontinuerlig strømning, seriell måte.
Denne teknologien ble nylig beskrevet i Zheng et al. I det arbeidet ble evnen til denne teknologien introdusert med ferdigstillelsen av en parametrisk studie, hvor både amplituden og varigheten av elektroporasjonspulsen ble variert, og det påfølgende elektriske signalet, som indikerer cellemembranpermeabilisering, ble utforsket32. Resultatene viste at en økning i intensiteten til elektroporasjonspulsen (dvs. økning i påført elektrisk felt eller økning i pulsvarighet) forårsaket en økning i den målte cellemembranpermeabiliseringen. For ytterligere å validere systemet ble en vanlig fluorescerende indikator for vellykket elektroporering, propidiumjodid33, tilsatt til cellesuspensjonen, og et fluorescensbilde ble tatt umiddelbart etter påføring av den elektriske pulsen. Det optiske signalet, dvs. fluorescensintensiteten av propidiumjodid inne i cellen, var sterkt korrelert med den elektriske målingen av graden av cellemembranpermeabilisering, og verifiserte påliteligheten av denne elektriske målingen. Imidlertid vurderte dette arbeidet bare levering av det lille molekylet propidiumjodid, som har liten eller ingen oversettbar betydning.
I dette arbeidet introduseres en ny anvendelse av denne teknologien for å forbedre systemets gjennomstrømning samtidig som den leverer en biologisk aktiv plasmid DNA (pDNA) vektor og vurderer elektrotransfeksjonseffektiviteten til celler som er replisert og dyrket etter elektroporering. Selv om det forrige arbeidet overgår eksisterende mikroelektroporeringsteknologier som er i stand til elektrisk å måle hendelsen av elektroporering, krever enhetens nåværende tilstand fortsatt lange celletransittider mellom elektrodesettet (~ 250 ms) for å utføre celledeteksjon, pulsapplikasjon og måling av cellemembranpermeabilisering. Med en enkelt kanal begrenser dette gjennomstrømningen til 4 celler/er. For å bekjempe denne begrensningen introduseres et nytt konsept for cellepopulasjonsbasert tilbakemeldingsstyrt elektroporering for å utføre pDNA-elektrotransfeksjon. Ved å bruke en hypofysiologisk ledningsevne elektroporeringsbuffer, tillater dette systemet elektrisk forhør av enkeltceller over en rekke elektroporeringspulsapplikasjoner. Basert på den elektriske responsen bestemmes deretter en “optimal” elektroporeringspuls. En “high-throughput” -modus implementeres deretter der bestemmelsen av cellemembranpermeabilisering oppheves, strømningshastigheten økes, og elektroporasjonspulsens driftssyklus tilpasses cellens transittid for å sikre en puls per celle i transitt mellom elektrodene. Dette arbeidet vil gi omfattende detaljer om mikrofabrikasjonstrinnene for produksjon av mikroenheten, materialet / utstyret og deres oppsett som kreves for å utføre eksperimenteringen, og drift / analyse av enheten og dens elektrotransfeksjonseffektivitet (eTE).
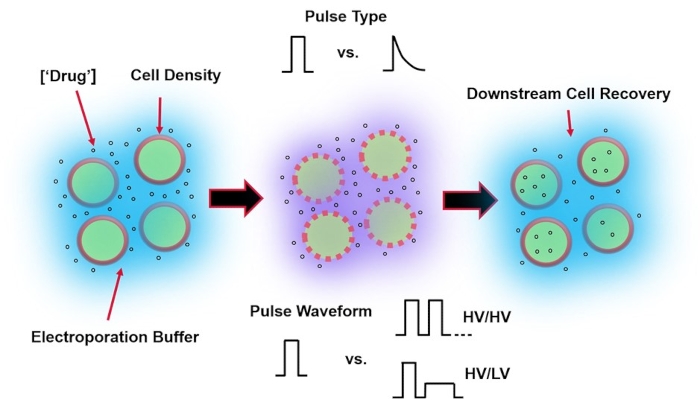
Figur 1: Eksperimentelle faktorer som påvirker utfallet av elektroporering. (Venstre) Cellesuspensjon – Viktige faktorer å vurdere før elektroporering begynner, inkluderer: Nyttelast (i dette tilfellet pDNA), konsentrasjon, celletetthet og elektroporeringsbufferegenskaper. Elektroporeringsbufferegenskaper å vurdere er ledningsevne, osmolaritet og den nøyaktige molekylære sammensetningen som bidrar til disse verdiene. (Midten) Pulsapplikasjon – Den nøyaktige pulstypen (firkantbølge vs. eksponentielt forfall) og pulsbølgeform (enkeltpuls vs. pulstog) må optimaliseres for å maksimere både den resulterende cellens levedyktighet og elektrotransfeksjonseffektivitet. Vanlige pulstog implementert i elektroporeringsprosesser består vanligvis av en serie høyspenningspulser (HV) eller serier av pulser som roterer mellom HV og lavspennings (LV) pulsstørrelser. (Høyre) Cell Recovery-Down-stream behandlingstrinn, spesielt gjenopprettingscellekulturmediet som cellene overføres til, bør optimaliseres. Ikke omtalt (Far Left), ytterligere oppstrøms cellebehandlingstrinn kan implementeres for generell elektroporeringsprosessoptimalisering. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Metodikken som presenteres i denne protokollen fokuserer primært på mikrofabrikasjon av en mikrofluidisk enhet som deretter integreres i et spesialisert elektroporeringseksperimentelt oppsett. Begrepet “oppskrift”, som ofte brukes når man beskriver detaljene i mikrofabrikasjonsprosessen, antyder viktigheten av å følge / optimalisere hvert trinn for å kunne fremstille en fungerende enhet. Imidlertid kan visse kritiske trinn i prosessen, når de ikke er optimalisert, for eksempel UV-eksponeringstid / energi, PVD-sput…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne ønsker å anerkjenne økonomisk støtte fra National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) og US Department of Education’s Graduate Training in Emerging Areas of Precision and Personalized Medicine (P200A150131) for finansiering av kandidatstudent JJS på fellesskap.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

