Summary
Dieses Protokoll beschreibt die Mikrofabrikationstechniken, die erforderlich sind, um ein mikrofluidisches Lab-on-a-Chip-Elektroporationsgerät zu bauen. Der Versuchsaufbau führt kontrollierte Transfektionen auf Einzelzellebene in einem kontinuierlichen Fluss durch und kann mit populationsbasierter Kontrolle auf höhere Durchsätze erweitert werden. Es wird eine Analyse bereitgestellt, die die Fähigkeit zeigt, den Grad der Permeabilisierung der Zellmembran in Echtzeit elektrisch zu überwachen.
Abstract
Aktuelle therapeutische Innovationen, wie die CAR-T-Zelltherapie, sind stark von der viral-vermittelten Genabgabe abhängig. Obwohl diese Technik effizient ist, geht sie mit hohen Herstellungskosten einher, was zu einem Interesse an der Verwendung alternativer Methoden für die Genlieferung geführt hat. Die Elektroporation ist ein elektrophysikalischer, nicht-viraler Ansatz zur intrazellulären Abgabe von Genen und anderen exogenen Materialien. Bei Anlegen eines elektrischen Feldes ermöglicht die Zellmembran vorübergehend die molekulare Abgabe in die Zelle. Typischerweise wird die Elektroporation auf der Makroskala durchgeführt, um eine große Anzahl von Zellen zu verarbeiten. Dieser Ansatz erfordert jedoch eine umfangreiche empirische Protokollentwicklung, die bei der Arbeit mit primären und schwer zu transfizierenden Zelltypen kostspielig ist. Langwierige Protokollentwicklung, gepaart mit der Anforderung großer Spannungen, um ausreichende elektrische Feldstärken zur Permeabilisierung der Zellen zu erreichen, hat zur Entwicklung von Elektroporationsgeräten im Mikromaßstab geführt. Diese Mikroelektroporationsgeräte werden mit gängigen Mikrofabrikationstechniken hergestellt und ermöglichen eine bessere experimentelle Kontrolle mit dem Potenzial, hohe Durchsatzfähigkeiten aufrechtzuerhalten. Diese Arbeit baut auf einer mikrofluidischen Elektroporationstechnologie auf, die in der Lage ist, den Grad der Zellmembranpermeabilisierung auf Einzelzellebene unter kontinuierlichem Fluss zu detektieren. Diese Technologie war jedoch auf 4 pro Sekunde verarbeitete Zellen beschränkt, so dass hier ein neuer Ansatz zur Erhöhung des Systemdurchsatzes vorgeschlagen und vorgestellt wird. Diese neue Technik, die als zellpopulationsbasierte Rückkopplungskontrolle bezeichnet wird, berücksichtigt die Zellpermeabilisierungsantwort auf eine Vielzahl von Elektroporationspulsbedingungen und bestimmt die am besten geeigneten Elektroporationspulsbedingungen für den zu testenden Zelltyp. Anschließend wird ein Modus mit höherem Durchsatz verwendet, bei dem dieser “optimale” Impuls auf die Zellsuspension während des Transports angewendet wird. Die Schritte zur Herstellung des Geräts, zum Aufbau und zur Durchführung der mikrofluidischen Experimente und zur Analyse der Ergebnisse werden detailliert vorgestellt. Schließlich wird diese Mikroelektroporationstechnologie demonstriert, indem ein DNA-Plasmid, das für grün fluoreszierendes Protein (GFP) kodiert, in HEK293-Zellen eingebracht wird.
Introduction
Aktuelle therapeutische Innovationen in der biomedizinischen Forschung, wie die CAR-T-Zelltherapie (Chimeric Antigen Receptor Engineered T cell) und die genetische Editierung mittels CRISPR (Clustered regularly interspaced short palindromic repeat DNA sequences)/Cas9, hängen stark von der Fähigkeit ab, exogenes Material sowohl erfolgreich als auch effizient in den intrazellulären Raum zu bringen1. In der CAR-T-Therapie ist der Goldstandard für die Durchführung des Genabgabeschritts bei der Zelltherapieherstellung die Verwendung viraler Vektoren2. Obwohl die viral vermittelte Genabgabe eine effiziente Verabreichungsmodalität ist, hat sie auch mehrere Nachteile. Dazu gehören Herstellungskosten, Zytotoxizität, Immunogenität, Mutagenese/Tumorgenesepotenzial und Größenbeschränkungen für das/die zu liefernde(n) Gen(e)3. Diese Einschränkungen haben zur Erforschung und Entwicklung alternativer, nicht-viraler Verabreichungstechnologien geführt.
Die Elektroporation, eine Alternative zur viral vermittelten Genabgabe, beruht auf der Anwendung einer optimalen elektrischen Pulswellenform, um DNA-, RNA- und Proteintransfektionen von Zellen durchzuführen. Nach dem Anlegen eines externen elektrischen Feldes wird die Zellmembran kurzzeitig kompromittiert, wodurch die Zelle anfällig für die intrazelluläre Abgabe von ansonsten undurchlässigen exogenen Materialienwird 4. Im Vergleich zur viralvermittelten Verabreichung ist die Elektroporation vorteilhaft, da sie im Allgemeinen sicher, einfach zu bedienen und mit niedrigen Betriebskosten verbunden ist. Die Elektroporation kann sowohl kleine als auch große molekulare Fracht liefern und kann bei der Transfizierung von Zellen unabhängig von der Linie5 effizient sein. Um wünschenswerte Ergebnisse nach der Elektroporation zu erzielen, d.h. gute Lebensfähigkeit und gute Elektrotransfektionseffizienz, müssen eine Vielzahl von experimentellen Parametern co-optimiert werden. Dazu gehören Zelltyp6, Zelldichte, Molekülkonzentration7, Elektroporationspuffereigenschaften (z. B. molekulare Zusammensetzung, Leitfähigkeit und Osmolarität)8, Elektrodengröße/-geometrie9 und elektrische Pulswellenform (Form, Polarität, Anzahl der Impulse)10 (siehe Abbildung 1 für eine Abbildung). Obwohl jeder dieser Parameter einen signifikanten Einfluss auf die Ergebnisse von Elektroporationsexperimenten haben kann, wurde die Pulswellenform besonders detailliert untersucht, da die elektrische Energie des angelegten Impulses (der angelegten Impulse) die Wurzel des intrinsischen Kompromisses zwischen der resultierenden Zelllebensfähigkeit und der Elektrotransfektionseffizienz ist8.
Typischerweise werden Elektroporationsexperimente auf der Makroskala durchgeführt, wo Zellen in 100 Mikrolitern Puffer zwischen einem Satz großer, paralleler Plattenelektroden innerhalb einer Elektroporationsküvette suspendiert werden. Die Elektroden werden üblicherweise aus Aluminium mit einem Elektrodenabstand von 1-4 mm hergestellt. Sobald die Zellen manuell per Pipette geladen sind, wird die Küvette elektrisch mit einem sperrigen, elektrischen Impulsgenerator verbunden, wo der Benutzer die Pulswellenformparameter einstellen und anwenden kann, um die Zellsuspension elektropolieren. Obwohl die Makro- oder Massenelektroporation Zelldichten >106 Zellen / ml verarbeiten kann, kann diese Funktion bei der Optimierung der Einstellungen der elektrischen Pulswellenform verschwenderisch sein. Dies ist besonders besorgniserregend, wenn primäre Zelltypen galoppieren, bei denen die Anzahl der Zellpopulationen begrenzt werden kann. Zusätzlich muss der Impulsgeber aufgrund des großen Abstands zwischen den Elektroden in der Lage sein, große Spannungen zu liefern, um elektrische Feldstärken >1kV/cm11 zu erreichen. Diese hohen Spannungen verursachen eine Widerstandsverlustleistung durch den Elektrolytpuffer, was zu einer Joule-Erwärmung führt, die sich nachteilig auf die resultierende Zelllebensfähigkeit auswirken kann12. Schließlich wird die Durchführung der Elektroporation an einer dichten Zellsuspension konsequent mit einer angeborenen Variabilität der resultierenden Elektrotransfektionseffizienz und Zelllebensfähigkeit belastet. Jede Zelle in Suspension könnte aufgrund der umgebenden Zellen eine andere elektrische Feldstärke erfahren. Je nachdem, ob die erlebte elektrische Feldstärke erhöht oder verringert wird, kann die resultierende Zelllebensfähigkeit oder die Elektrotransfektionseffizienz jeweils negativ beeinflusst werden11. Diese Nachteile der Elektroporation im Makromaßstab haben zur Verfolgung und Entwicklung alternativer Technologien geführt, die auf der Mikroskala arbeiten und eine bessere Kontrolle auf Einzelzellebene ermöglichen.
Das Gebiet der BioMEMS oder biomedizinischen mikroelektromechanischen Systeme stammt aus den technologischen Fortschritten in der Mikroelektronikindustrie. Insbesondere die Verwendung von Mikrofabrikationsprozessen zur Entwicklung von Mikrogeräten für die Förderung der biomedizinischen Forschung. Diese Fortschritte umfassen die Entwicklung von Mikroelektrodenarrays für die elektrische In-vivo-Überwachung 13, kapazitive Mikroelektroden für die In-situ-Elektroporation 14, miniaturisierte Organ-on-a-Chip-Geräte 15, mikrofluidische Point-of-Care-Diagnostik 16, Biosensoren 17 und Arzneimittelabgabesysteme18, einschließlich Nano- und Mikroelektroporationsvorrichtungen 19,20,21 . Aufgrund der Fähigkeit, Geräte im gleichen Größenmaßstab wie biologische Zellen zu entwerfen und herzustellen, sind Nano- und Mikroelektroporationstechnologien im Vergleich zu ihrem makroskaligen Gegenstück22,23 vorteilhaft. Diese Elektroporationsgeräte machen Hochspannungsimpulsanwendungen überflüssig, da typischerweise Elektrodensätze mit Abständen von 10s bis 100s Mikrometern integriert sind. Diese Eigenschaft reduziert den Strom durch den Elektrolyten drastisch, was wiederum die Ansammlung toxischer Elektrolyseprodukte und die Auswirkungen der Joule-Erwärmung in diesen Systemen reduziert. Die mikroskaligen Kanäle stellen auch sicher, dass während der Pulsapplikation zuverlässig ein viel gleichmäßigeres elektrisches Feld an die Zellen angelegt wird, was zu konsistenteren Ergebnissen führt24. Darüber hinaus ist es auch üblich, dass Mikroelektroporationsgeräte in eine mikrofluidische Plattform integriert werden, die sich für die zukünftige Integration in eine vollautomatische Technologie eignet, eine höchst wünschenswerte Fähigkeit bei der Herstellung von Zelltherapien25. Schließlich ermöglicht die Elektroporation im Mikromaßstab die elektrische Abfrage von Elektroporationsereignissen. Zum Beispiel kann der Grad der Zellmembranpermeabilisierung in Echtzeit auf Einzelzellebene überwacht werden26,27. Der Zweck dieser Methode besteht darin, die Mikrofabrikation, den Systembetrieb und die Analyse einer mikrofluidischen, einzelligen Mikroelektroporationsvorrichtung zu beschreiben, die in der Lage ist, den Grad der Zellmembranpermeabilisierung zur Optimierung von Elektroporationsprotokollen zu messen und gleichzeitig den Durchsatz gegenüber dem vorherigen Stand der Technik zu erhöhen.
Die Durchführung der Elektroporation auf Einzelzellebene ist keine neuartige Technik mehr, wie Rubinsky et al. erstmals 2001 mit der Entwicklung einer statischen Zellelektroporationstechnologiedemonstrierten 28. Ihr Mikrogerät war innovativ, da sie die ersten waren, die die Fähigkeit demonstrierten, das Ereignis der Elektroporation elektrisch zu überwachen. Dies hat weiter zur Entwicklung statischer, einzelliger Elektroporationstechnologien geführt, die in der Lage sind, den Grad der Permeabilisierung der Zellmembran parallel elektrisch zu erfassen, um den Durchsatz der Geräte zu erhöhen. Aber selbst bei Parallelisierung und Stapelverarbeitung fehlt diesen Geräten die Gesamtzahl der Zellen, die sie pro Zeiteinheit verarbeiten können,29,30. Diese Einschränkung hat zur Entwicklung von Durchflussvorrichtungen geführt, die in der Lage sind, Mikroelektroporation auf Einzelzellebene bei viel größeren Durchsätzen durchzuführen31. Dieser Geräteübergang von der statischen zur Durchflussumgebung begrenzt die Fähigkeit, den Grad der Permeabilisierung der Zellmembran nach der Anwendung des Elektroporationsimpulses elektrisch zu überwachen. Die in dieser Arbeit beschriebene Methode schließt die Lücke zwischen diesen beiden Technologien, eine Mikroelektroporationstechnologie, die in der Lage ist, den Grad der Zellmembranpermeabilisierung einzelner Zellen kontinuierlich seriell zu detektieren, zu pulsieren und zu überwachen.
Diese Technologie wurde kürzlich in Zheng et al. In dieser Arbeit wurden die Fähigkeiten dieser Technologie mit dem Abschluss einer parametrischen Studie eingeführt, bei der sowohl die Amplitude als auch die Dauer des Elektroporationsimpulses variiert wurden und das daraus resultierende elektrische Signal, das auf eine Permeabilisierung der Zellmembran hinweist, untersucht wurde32. Die Ergebnisse zeigten, dass eine Zunahme der Intensität des Elektroporationsimpulses (d.h. Zunahme des angelegten elektrischen Feldes oder Erhöhung der Pulsdauer) eine Erhöhung der gemessenen Zellmembranpermeabilisierung verursachte. Um das System weiter zu validieren, wurde der Zellsuspension ein üblicher Fluoreszenzindikator für eine erfolgreiche Elektroporation, Propidiumiodid33, zugegeben, und unmittelbar nach der Anwendung des elektrischen Impulses wurde ein Fluoreszenzbild aufgenommen. Das optische Signal, d.h. die Fluoreszenzintensität von Propidiumiodid in der Zelle, korrelierte stark mit der elektrischen Messung des Permeabilisierungsgrades der Zellmembran, was die Zuverlässigkeit dieser elektrischen Messung bestätigte. Diese Arbeit betrachtete jedoch nur die Abgabe des niedermolekularen Propidiumiodids, das wenig bis gar keine übersetzbare Bedeutung hat.
In dieser Arbeit wird eine neue Anwendung dieser Technologie vorgestellt, um den Durchsatz des Systems zu verbessern und gleichzeitig einen biologisch aktiven Plasmid-DNA-Vektor (pDNA) zu liefern und die Elektrotransfektionseffizienz von Zellen zu bewerten, die nach der Elektroporation neu plattiert und kultiviert werden. Obwohl die vorherige Arbeit bestehende Mikroelektroporationstechnologien übertrifft, die in der Lage sind, das Ereignis der Elektroporation elektrisch zu messen, erfordert der aktuelle Zustand des Geräts immer noch lange Zelllaufzeiten zwischen dem Elektrodensatz (~ 250 ms), um die Zellerkennung, die Pulsanwendung und die Permeabilisierungsmessung der Zellmembran durchzuführen. Bei einem einzigen Kanal begrenzt dies den Durchsatz auf 4 Zellen/s. Um diese Einschränkung zu bekämpfen, wird ein neues Konzept der zellpopulationsbasierten rückkopplungsgesteuerten Elektroporation eingeführt, um pDNA-Elektrotransfektion durchzuführen. Durch die Verwendung eines hypophysiologischen Leitfähigkeits-Elektroporationspuffers ermöglicht dieses System die elektrische Abfrage einzelner Zellen über eine Vielzahl von Elektroporationspulsanwendungen. Basierend auf der elektrischen Reaktion wird dann ein “optimaler” Elektroporationsimpuls bestimmt. Anschließend wird ein “Hochdurchsatz”-Modus implementiert, bei dem die Bestimmung der Permeabilisierung der Zellmembran aufgehoben, die Flussrate erhöht und der Tastverhältnis des Elektroporationsimpulses an die Zelllaufzeit angepasst wird, um einen Impuls pro Zelle im Transit zwischen den Elektroden sicherzustellen. Diese Arbeit wird umfangreiche Details zu den Mikrofabrikationsschritten für die Herstellung des Mikrogeräts, dem Material / der Ausrüstung und deren Aufbau liefern, die für die Durchführung des Experiments erforderlich sind, sowie dem Betrieb / der Analyse des Geräts und seiner Elektrotransfektionseffizienz (eTE).
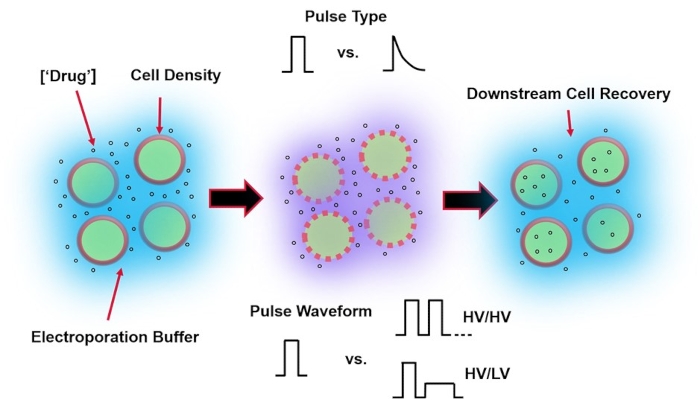
Abbildung 1: Experimentelle Faktoren, die die Ergebnisse der Elektroporation beeinflussen. (Links) Zellsuspension-Wichtige Faktoren, die vor Beginn der Elektroporation zu berücksichtigen sind, sind: Nutzlast (in diesem Fall pDNA), Konzentration, Zelldichte und Elektroporationspuffereigenschaften. Zu berücksichtigende Eigenschaften des Elektroporationspuffers sind Leitfähigkeit, Osmolarität und die genaue molekulare Zusammensetzung, die zu diesen Werten beiträgt. (Mitte) Pulsanwendung – Der genaue Pulstyp (Rechteckwelle vs. exponentieller Zerfall) und die Pulswellenform (Einzelpuls vs. Pulsfolge) müssen optimiert werden, um sowohl die resultierende Zelllebensfähigkeit als auch die Elektrotransfektionseffizienz zu maximieren. Übliche Pulsfolgen, die in Elektroporationsprozessen implementiert werden, bestehen typischerweise aus einer Reihe von Hochspannungsimpulsen (HV) oder einer Reihe von Impulsen, die zwischen HV- und Niederspannungsimpulsgrößen (LV) rotieren. (Rechts) Zellwiederherstellung-Nachgelagerte Verarbeitungsschritte, insbesondere die Rückgewinnungszellkulturmedien, auf die Zellen übertragen werden, sollten optimiert werden. Nicht vorgestellt (ganz links) können zusätzliche vorgeschaltete Zellverarbeitungsschritte zur Optimierung des gesamten Elektroporationsprozesses implementiert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die in diesem Protokoll vorgestellte Methodik konzentriert sich in erster Linie auf die Mikrofabrikation eines mikrofluidischen Geräts, das dann in einen speziellen Elektroporationsversuchsaufbau integriert wird. Der Begriff “Rezept”, der häufig zur Beschreibung der Besonderheiten des Mikrofabrikationsprozesses verwendet wird, deutet darauf hin, wie wichtig es ist, jeden Schritt zu befolgen / zu optimieren, um ein funktionierendes Gerät erfolgreich herzustellen. Bestimmte kritische Schritte innerhalb des Prozesses, we…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken der National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) und der Graduate Training in Emerging Areas of Precision and Personalized Medicine (P200A150131) des US-Bildungsministeriums für die Finanzierung des Doktoranden J.J.S. auf Stipendium.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

