Sürekli akışlı, permeabilizasyon algılamalı mikro-elektroporasyon sisteminin imalatı ve işletilmesi
Summary
Bu protokol, çip üzerinde laboratuvar, mikroakışkan elektroporasyon cihazı oluşturmak için gereken mikrofabrikasyon tekniklerini açıklar. Deney düzeneği, sürekli bir akışta kontrollü, tek hücre düzeyinde transfeksiyonlar gerçekleştirir ve popülasyon tabanlı kontrol ile daha yüksek verimlere genişletilebilir. Hücre zarı geçirgenliğinin derecesini gerçek zamanlı olarak elektriksel olarak izleme yeteneğini gösteren bir analiz sağlanmıştır.
Abstract
CAR-T hücre tedavisi gibi mevcut terapötik yenilikler, viral aracılı gen dağıtımına büyük ölçüde bağımlıdır. Verimli olmasına rağmen, bu tekniğe yüksek üretim maliyetleri eşlik eder ve bu da gen dağıtımı için alternatif yöntemler kullanmaya ilgi duyulmasını sağlamıştır. Elektroporasyon, genlerin ve diğer eksojen materyallerin hücre içi iletimi için elektro-fiziksel, viral olmayan bir yaklaşımdır. Bir elektrik alanın uygulanması üzerine, hücre zarı geçici olarak hücreye moleküler olarak verilmesine izin verir. Tipik olarak, elektroporasyon çok sayıda hücreyi işlemek için makro ölçekte gerçekleştirilir. Bununla birlikte, bu yaklaşım, birincil ve transfekte edilmesi zor hücre tipleriyle çalışırken maliyetli olan kapsamlı ampirik protokol geliştirmeyi gerektirir. Uzun protokol geliştirme, hücreleri geçirgenleştirmek için yeterli elektrik alanı kuvvetlerini elde etmek için büyük voltajların gerekliliği ile birleştiğinde, mikro ölçekli elektroporasyon cihazlarının geliştirilmesine yol açmıştır. Bu mikro-elektroporasyon cihazları, yaygın mikrofabrikasyon teknikleri kullanılarak üretilir ve yüksek verim yeteneklerini sürdürme potansiyeli ile daha fazla deneysel kontrol sağlar. Bu çalışma, sürekli akış altında tek hücre seviyesinde hücre zarı geçirgenliği seviyesini tespit edebilen bir mikroakışkan-elektroporasyon teknolojisi geliştirmektedir. Bununla birlikte, bu teknoloji saniyede işlenen 4 hücre ile sınırlıydı ve bu nedenle sistem verimini artırmak için yeni bir yaklaşım önerildi ve burada sunuldu. Hücre popülasyonuna dayalı geri besleme kontrolü olarak belirtilen bu yeni teknik, çeşitli elektroporasyon titreşim koşullarına hücre geçirgenliği tepkisini dikkate alır ve test edilen hücre tipi için en uygun elektroporasyon darbe koşullarını belirler. Daha sonra, bu ‘optimal’ darbenin geçiş halindeki hücre süspansiyonuna uygulandığı daha yüksek bir verim modu kullanılır. Cihazın üretilmesi, mikroakışkan deneylerin kurulması ve çalıştırılması ve sonuçların analiz edilmesi adımları ayrıntılı olarak sunulmaktadır. Son olarak, bu mikro-elektroporasyon teknolojisi, HEK293 hücrelerine yeşil floresan protein (GFP) için bir DNA plazmid kodlaması göndererek gösterilmiştir.
Introduction
CAR-T (Kimerik Antijen Reseptör Engineered T hücresi) hücre tedavisi ve CRISPR (kümelenmiş düzenli aralıklarla kısa palindromik tekrarlayan DNA dizileri) / Cas9 kullanılarak genetik düzenleme gibi biyomedikal araştırmalardaki mevcut terapötik yenilikler, eksojen materyali hücre içi boşluğa hem başarılı hem de verimli bir şekilde iletme yeteneğine büyük ölçüde güvenmektedir1. CAR-T tedavisinde, hücre tedavisi üretiminde gen verme adımını gerçekleştirmek için altın standart viral vektörlerkullanmaktır 2. Viral aracılı gen iletimi etkili bir dağıtım yöntemi olmasına rağmen, bazı dezavantajları da vardır. Bunlar arasında üretim maliyetleri, sitotoksisite, immünojenisite, mutagenez/tümörigenez potansiyeli ve verilecek gen(ler) üzerindeki boyut sınırlamalarıyer alır 3. Bu sınırlamalar, alternatif, viral olmayan dağıtım teknolojilerinin araştırılmasına ve geliştirilmesine yol açmıştır.
Viral aracılı gen dağıtımına bir alternatif olan elektroporasyon, hücrelerin DNA, RNA ve protein transfeksiyonlarını gerçekleştirmek için optimal bir elektriksel darbe dalga formunun uygulanmasına dayanır. Harici bir elektrik alanının uygulanmasını takiben, hücre zarı kısa bir süre tehlikeye girer ve hücreyi, aksi takdirde geçirimsiz eksojen materyallerin hücre içi iletimine duyarlı hale getirir4. Viral aracılı teslimatla karşılaştırıldığında, elektroporasyon genellikle güvenli, kullanımı kolay ve düşük işletme maliyetlerine sahip olduğu için avantajlıdır. Elektroporasyon hem küçük hem de büyük moleküler kargo sağlayabilir ve soy5’ten bağımsız olarak hücrelerin transfeksiyonunda etkili olabilir. Elektroporasyondan sonra arzu edilen sonuçları, yani iyi yaşayabilirliği ve iyi elektro-transfeksiyon verimliliğini elde etmek için, çeşitli deneysel parametrelerin birlikte optimize edilmesi gerekir. Bunlar arasında hücre tipi6, hücre yoğunluğu, molekül konsantrasyonu7, elektroporasyon tampon özellikleri (örneğin, moleküler bileşim, iletkenlik ve ozmolarite)8, elektrot boyutu/geometrisi9 ve elektriksel darbe dalga formu (şekil, polarite, darbe sayısı)10 (bir örnek için Şekil 1’e bakınız) bulunur. Bu parametrelerin her birinin elektroporasyon deneylerinin sonuçları üzerinde önemli bir etkisi olmasına rağmen, darbe dalga formu özellikle ayrıntılı olarak incelenmiştir, çünkü uygulanan darbe (ler) in elektrik enerjisi, ortaya çıkan hücre canlılığı ile elektro-transfeksiyon verimliliği arasındaki içsel dengenin köküdür8.
Tipik olarak, elektroporasyon deneyleri, hücrelerin bir elektroporasyon küveti içindeki bir dizi büyük, paralel plakalı elektrot arasında 100’lerce mikrolitre tamponda askıya alındığı makro ölçekte gerçekleştirilir. Elektrotlar genellikle 1-4 mm’lik bir elektrot mesafesine sahip alüminyumdan üretilir. Hücreler pipet aracılığıyla manuel olarak yüklendikten sonra, küvet, kullanıcının hücre süspansiyonunu elektroporat etmek için darbe dalga formu parametrelerini ayarlayabileceği ve uygulayabileceği hacimli, elektrikli bir darbe jeneratörüne elektriksel olarak bağlanır. Makro ölçekli veya toplu elektroporasyon, hücre yoğunluklarını >106 hücre / mL’yi işleyebilse de, bu özellik elektriksel darbe dalga formu ayarlarını optimize ederken israf edici olabilir. Bu, özellikle hücre popülasyon sayılarının sınırlı olabileceği birincil hücre tiplerini elektroporize ederken endişe vericidir. Ek olarak, elektrotlar arasındaki büyük mesafe nedeniyle, darbe jeneratörü elektrik alan mukavemetlerini >1kV / cm11) elde etmek için büyük voltajlar sağlayabilmelidir. Bu yüksek voltajlar, elektrolit tamponu boyunca dirençli güç dağılımına neden olur ve Joule’un ısınmasına neden olur ve bu da ortaya çıkan hücre canlılığına zarar verebilir12. Son olarak, yoğun bir hücre süspansiyonu üzerinde elektroporasyon yapmak, ortaya çıkan elektro-transfeksiyon verimliliğinde ve hücre canlılığında doğuştan gelen bir değişkenlik ile sürekli olarak yüklenecektir. Süspansiyondaki her hücre, çevreleyen hücreler nedeniyle farklı bir elektrik alan kuvveti yaşayabilir. Deneyimli elektrik alan kuvvetinin artmasına veya azalmasına bağlı olarak, ortaya çıkan hücre canlılığı veya elektro-transfeksiyon verimliliğinin her biri olumsuz etkilenebilir11. Makro ölçekli elektroporasyonun bu dezavantajları, mikro ölçekte çalışan ve tek hücre düzeyinde daha iyi kontrol sağlayan alternatif teknolojilerin izlenmesine ve geliştirilmesine yol açmıştır.
BioMEMS veya biyomedikal mikro-elektro-mekanik sistemler alanı, mikroelektronik endüstrisinde yapılan teknolojik gelişmelerden kaynaklanmaktadır. Özellikle, biyomedikal araştırmaların ilerlemesi için mikro cihazlar geliştirmek için mikrofabrikasyon süreçlerini kullanmak. Bu ilerlemeler arasında in vivo elektriksel izleme için mikro-elektrot dizilerinin geliştirilmesi13, in situ elektroporasyon için kapasitif mikro-elektrotlar 14, çip üzerinde minyatür organ cihazları 15, mikroakışkan bakım noktası teşhisi 16, biyosensörler 17 ve nano ve mikro-elektroporasyon cihazları dahil olmak üzere ilaç dağıtım sistemleri 18 19,20,21 bulunmaktadır. . Biyolojik hücrelerle aynı büyüklükte cihazlar tasarlama ve üretme kabiliyeti nedeniyle, nano ve mikro elektroporasyon teknolojileri, makro ölçekli muadilleri22,23 ile karşılaştırıldığında avantajlıdır. Bu elektroporasyon cihazları, yüksek voltajlı darbe uygulamalarının gerekliliğini ortadan kaldırır, çünkü 10’lar ila 100’lerce mikrometre aralığına sahip elektrot setleri tipik olarak entegre edilir. Bu özellik, elektrolit yoluyla akımı büyük ölçüde azaltır, bu da toksik elektroliz ürünlerinin birikimini ve bu sistemlerde Joule ısıtmasının etkilerini azaltır. Mikro ölçekli kanallar ayrıca, darbe uygulaması sırasında hücrelere çok daha düzgün bir elektrik alanının güvenilir bir şekilde uygulanmasını sağlar ve bu da daha tutarlı sonuçlar elde edilmesini sağlar24. Ek olarak, mikro-elektroporasyon cihazlarının, hücre terapisi üretiminde oldukça arzu edilen bir yetenek olan tam otomatik bir teknolojiye gelecekteki entegrasyon için kendisini ödünç veren mikroakışkan bir platforma entegre edilmesi de yaygındır25. Son olarak, mikro ölçekli elektroporasyon, elektroporasyon olaylarının elektriksel sorgulamasına izin verir. Örneğin, hücre zarı geçirgenliğinin derecesi, tek bir hücre seviyesinde gerçek zamanlı olarak izlenebilir26,27. Bu yöntemin amacı, elektroporasyon protokollerini optimize etmek için hücre zarı geçirgenliğinin derecesini ölçebilen, ancak önceki son teknolojiye göre verimi artıran bir mikroakışkan, tek hücreli mikro-elektroporasyon cihazının mikrofabrikasyonunu, sistem çalışmasını ve analizini tanımlamaktır.
Tek hücreli elektroporasyon yapmak artık yeni bir teknik değildir, çünkü ilk olarak Rubinsky ve ark. tarafından 2001 yılında statik hücre elektroporasyon teknolojisinin geliştirilmesi ile gösterilmiştir28. Mikro cihazları, elektroporasyon olayını elektriksel olarak izleme yeteneğini gösteren ilk kişi oldukları için yenilikçiydi. Bu, cihazların verimlerini artırmak için hücre zarı geçirgenliğinin derecesini paralel bir şekilde elektriksel olarak tespit edebilen statik, tek hücreli elektroporasyon teknolojilerinin geliştirilmesine yol açmıştır. Bununla birlikte, paralelleştirme ve toplu işleme ile bile, bu cihazlar birim zaman başına işleyebilecekleri toplam hücre sayısı 29,30’dan ciddi şekilde yoksundur. Bu sınırlama, çok daha yüksek verimlerde tek hücre düzeyinde mikro-elektroporasyon yapabilen akış cihazlarının geliştirilmesine yol açmıştır31. Statikten akış ortamına bu cihaz geçişi, elektroporasyon darbesinin uygulanmasını takiben hücre zarı geçirgenliğinin derecesini elektriksel olarak izleme yeteneğini sınırlar. Bu çalışmada açıklanan yöntem, bu iki teknoloji arasındaki boşluğu doldurur; bu, sürekli akışlı, seri bir şekilde, bireysel hücrelerin hücre zarı geçirgenlik derecesini elektriksel olarak tespit edebilen, darbeleyen ve izleyebilen bir mikro-elektroporasyon teknolojisidir.
Bu teknoloji yakın zamanda Zheng ve ark. Bu çalışmada, elektroporasyon darbesinin hem genliğinin hem de süresinin değiştiği parametrik bir çalışmanın tamamlanmasıyla bu teknolojinin yetenekleri tanıtıldı ve hücre zarı geçirgenliğinin göstergesi olan takip eden elektrik sinyali araştırıldı32. Sonuçlar, elektroporasyon darbesinin yoğunluğundaki bir artışın (yani, uygulanan elektrik alanındaki artış veya nabız süresindeki artış) ölçülen hücre zarı geçirgenliğinde bir artışa neden olduğunu göstermiştir. Sistemi daha da doğrulamak için, başarılı elektroporasyonun ortak bir floresan göstergesi olan propidium iyodür33, hücre süspansiyonuna eklendi ve elektrik darbesinin uygulanmasından hemen sonra bir floresan görüntüsü yakalandı. Optik sinyal, yani hücre içindeki propidyum iyodürün floresan yoğunluğu, hücre zarı geçirgenlik derecesinin elektriksel ölçümü ile güçlü bir şekilde ilişkiliydi ve bu elektriksel ölçümün güvenilirliğini doğruladı. Bununla birlikte, bu çalışma sadece çevrilebilir önemi çok az olan veya hiç olmayan küçük moleküllü propidium iyodürün verilmesini dikkate aldı.
Bu çalışmada, biyolojik olarak aktif bir plazmid DNA (pDNA) vektörü sunarken ve elektroporasyondan sonra yeniden kaplanan ve kültürlenen hücrelerin elektro-transfeksiyon verimliliğini değerlendirirken sistemin verimini iyileştirmek için bu teknolojinin yeni bir uygulaması tanıtılmıştır. Önceki çalışma, elektroporasyon olayını elektriksel olarak ölçebilen mevcut mikro-elektroporasyon teknolojilerinden daha iyi performans göstermesine rağmen, cihazın mevcut durumu, hücre tespitini, darbe uygulamasını ve hücre zarı geçirgenlik ölçümünü gerçekleştirmek için elektrot seti (~ 250 ms) arasında uzun hücre geçiş süreleri gerektirir. Tek bir kanalla bu, aktarım hızını 4 hücre/sn ile sınırlar. Bu sınırlamayla mücadele etmek için, pDNA elektro-transfeksiyonunu gerçekleştirmek için hücre popülasyonuna dayalı geri besleme kontrollü elektroporasyonun yeni bir kavramı tanıtılmıştır. Bir hipofizyolojik iletkenlik elektroporasyon tamponu kullanarak, bu sistem çok sayıda elektroporasyon darbe uygulamasında tek hücrelerin elektriksel sorgulamasına izin verir. Elektrik tepkisine dayanarak, daha sonra ‘optimal’ bir elektroporasyon darbesi belirlenir. Daha sonra, hücre zarı geçirgenlik tayininin geçersiz kılındığı, akış hızının arttırıldığı ve elektroporasyon darbe görev döngüsünün, elektrotlar arasında geçişte hücre başına bir darbe sağlamak için hücre geçiş süresiyle eşleştirildiği bir ‘yüksek verim’ modu uygulanır. Bu çalışma, mikro cihazın üretimi için mikrofabrikasyon adımları, deneyi gerçekleştirmek için gereken malzeme / ekipman ve kurulumları ve cihazın çalışması / analizi ve elektro-transfeksiyon verimliliği (eTE) hakkında kapsamlı ayrıntılar sağlayacaktır.
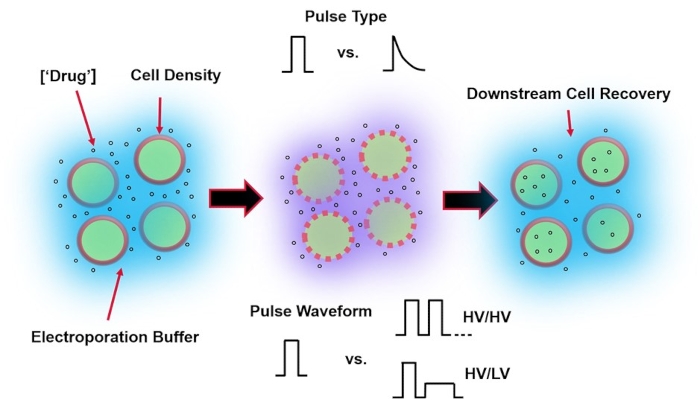
Şekil 1: Elektroporasyon sonuçlarını etkileyen deneysel faktörler. (Sol) Hücre Süspansiyonu-Elektroporasyonun başlamasından önce göz önünde bulundurulması gereken önemli faktörler şunlardır: Yük taşıma yükü (bu durumda, pDNA), konsantrasyon, hücre yoğunluğu ve elektroporasyon tampon özellikleri. Elektroporasyon tamponunun dikkate alınması gereken özellikleri iletkenlik, ozmolarite ve bu değerlere katkıda bulunan tam moleküler bileşimdir. (Orta) Darbe Uygulaması-Tam darbe tipi (kare dalgaya karşı üstel bozunum) ve darbe dalga formu (tek darbeye karşı darbe treni), hem ortaya çıkan hücre canlılığını hem de elektro-transfeksiyon verimliliğini en üst düzeye çıkarmak için optimize edilmelidir. Elektroporasyon işlemlerinde uygulanan yaygın darbe trenleri tipik olarak bir dizi Yüksek Gerilim (HV) darbesinden veya YG ve Alçak Gerilim (LV) darbe büyüklükleri arasında dönen bir dizi darbeden oluşur. (Sağda) Hücre Geri Kazanımı-Aşağı akış işleme adımları, özellikle hücrelerin aktarıldığı geri kazanım hücre kültürü ortamı optimize edilmelidir. Öne çıkmayan (En Sol), genel elektroporasyon işlemi optimizasyonu için ek yukarı akış hücresi işleme adımları uygulanabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu protokolde sunulan metodoloji öncelikle mikroakışkan bir cihazın mikrofabrikasyonuna odaklanır ve daha sonra özel bir elektroporasyon deney düzeneğine entegre edilir. Mikrofabrikasyon sürecinin özelliklerini tanımlarken sıklıkla kullanılan ‘tarif’ terimi, işleyen bir cihazı başarılı bir şekilde üretmek için her adımı takip etmenin / optimize etmenin önemine işaret eder. Bununla birlikte, UV maruz kalma süresi/enerjisi, PVD püskürtme hızları/süreleri ve oksijen plazma jeneratörü ayarla…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, Ulusal Bilim Vakfı (NSF CBET 0967598, DBI IDBR 1353918) ve ABD Eğitim Bakanlığı’nın Gelişmekte Olan Hassas ve Kişiselleştirilmiş Tıp Alanlarında Lisansüstü Eğitim (P200A150131) tarafından lisansüstü öğrenci J.J.S.’nin burs olarak finanse edilmesi için finansal desteğe teşekkür etmek istemektedir.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

