परमेबिलाइजेशन डिटेक्शन के साथ एक निरंतर प्रवाह, माइक्रो-इलेक्ट्रोपोरेशन सिस्टम का निर्माण और संचालन
Summary
यह प्रोटोकॉल लैब-ऑन-ए-चिप, माइक्रोफ्लुइडिक इलेक्ट्रोपोरेशन डिवाइस बनाने के लिए आवश्यक माइक्रोफैब्रिकेशन तकनीकों का वर्णन करता है। प्रायोगिक सेटअप एक निरंतर प्रवाह में नियंत्रित, एकल-सेल-स्तरीय अभिकर्मक करता है और इसे जनसंख्या-आधारित नियंत्रण के साथ उच्च थ्रूपुट तक बढ़ाया जा सकता है। वास्तविक समय में कोशिका झिल्ली परमेबिलाइजेशन की डिग्री की विद्युत रूप से निगरानी करने की क्षमता का प्रदर्शन करते हुए एक विश्लेषण प्रदान किया जाता है।
Abstract
वर्तमान चिकित्सीय नवाचार, जैसे कि सीएआर-टी सेल थेरेपी, वायरल-मध्यस्थता जीन वितरण पर बहुत अधिक निर्भर हैं। हालांकि कुशल, यह तकनीक उच्च विनिर्माण लागत के साथ है, जिसने जीन वितरण के लिए वैकल्पिक तरीकों का उपयोग करने में रुचि लाई है। इलेक्ट्रोपोरेशन जीन और अन्य बहिर्जात सामग्रियों के इंट्रासेल्युलर वितरण के लिए एक इलेक्ट्रो-भौतिक, गैर-वायरल दृष्टिकोण है। एक विद्युत क्षेत्र के आवेदन पर, कोशिका झिल्ली अस्थायी रूप से कोशिका में आणविक वितरण की अनुमति देती है। आमतौर पर, बड़ी संख्या में कोशिकाओं को संसाधित करने के लिए मैक्रोस्केल पर इलेक्ट्रोपोरेशन किया जाता है। हालांकि, इस दृष्टिकोण के लिए व्यापक अनुभवजन्य प्रोटोकॉल विकास की आवश्यकता होती है, जो प्राथमिक और मुश्किल-से-ट्रांसक्रिप्ट सेल प्रकारों के साथ काम करते समय महंगा है। लंबे प्रोटोकॉल विकास, कोशिकाओं को स्थिर करने के लिए पर्याप्त विद्युत-क्षेत्र शक्तियों को प्राप्त करने के लिए बड़े वोल्टेज की आवश्यकता के साथ मिलकर, माइक्रो-स्केल इलेक्ट्रोपोरेशन उपकरणों के विकास का नेतृत्व किया है। इन सूक्ष्म-इलेक्ट्रोपोरेशन उपकरणों को सामान्य माइक्रोफैब्रिकेशन तकनीकों का उपयोग करके निर्मित किया जाता है और उच्च थ्रूपुट क्षमताओं को बनाए रखने की क्षमता के साथ अधिक प्रयोगात्मक नियंत्रण की अनुमति देता है। यह काम एक माइक्रोफ्लुइडिक-इलेक्ट्रोपोरेशन तकनीक का निर्माण करता है जो निरंतर प्रवाह के तहत एकल-कोशिका स्तर पर कोशिका झिल्ली पारगम्यता के स्तर का पता लगाने में सक्षम है। हालांकि, यह तकनीक प्रति सेकंड संसाधित 4 कोशिकाओं तक सीमित थी, और इस प्रकार सिस्टम थ्रूपुट को बढ़ाने के लिए एक नया दृष्टिकोण प्रस्तावित और यहां प्रस्तुत किया गया है। सेल-जनसंख्या-आधारित प्रतिक्रिया नियंत्रण के रूप में निरूपित यह नई तकनीक, विभिन्न प्रकार की इलेक्ट्रोपोरेशन स्पंदन स्थितियों के लिए सेल परमेबिलाइजेशन प्रतिक्रिया पर विचार करती है और परीक्षण के तहत सेल प्रकार के लिए सबसे उपयुक्त इलेक्ट्रोपोरेशन पल्स स्थितियों को निर्धारित करती है। एक उच्च-थ्रूपुट मोड का उपयोग किया जाता है, जहां इस ‘इष्टतम’ पल्स को पारगमन में सेल निलंबन पर लागू किया जाता है। डिवाइस को बनाने, माइक्रोफ्लुइडिक प्रयोगों को स्थापित करने और चलाने और परिणामों का विश्लेषण करने के चरणों को विस्तार से प्रस्तुत किया गया है। अंत में, इस माइक्रो-इलेक्ट्रोपोरेशन तकनीक को हरे फ्लोरोसेंट प्रोटीन (जीएफपी) के लिए एचईके 293 कोशिकाओं में डीएनए प्लास्मिड एन्कोडिंग प्रदान करके प्रदर्शित किया जाता है।
Introduction
बायोमेडिकल अनुसंधान में वर्तमान चिकित्सीय नवाचार, जैसे कि सीएआर-टी (चिमेरिक एंटीजन रिसेप्टर इंजीनियर्ड टी सेल) सेल थेरेपी और सीआरआईएसपीआर (क्लस्टर नियमित रूप से इंटरस्पेस्ड शॉर्ट पैलिंड्रोमिक रिपीट डीएनए अनुक्रमों) / सीएएस 9 का उपयोग करके आनुवंशिक संपादन, इंट्रासेल्युलर स्पेस1 में बहिर्जात सामग्री को सफलतापूर्वक और कुशलता से वितरित करने की क्षमता पर बहुत अधिक निर्भर करता है। सीएआर-टी थेरेपी में, सेल थेरेपी निर्माण में जीन वितरण चरण करने के लिए स्वर्ण मानक वायरल वैक्टर2 का उपयोग कर रहा है। हालांकि वायरल-मध्यस्थता जीन वितरण एक कुशल वितरण पद्धति है, लेकिन इसमें कई कमियां भी हैं। इनमें विनिर्माण लागत, साइटोटॉक्सिसिटी, इम्युनोजेनेसिस, म्यूटेनेसिस / ट्यूमरजेनिसिस क्षमता, और वितरित किए जाने वाले जीन (ओं) पर आकार सीमाएं शामिलहैं। इन सीमाओं ने वैकल्पिक, गैर-वायरल वितरण प्रौद्योगिकियों के अनुसंधान और विकास को जन्म दिया है।
इलेक्ट्रोपोरेशन, वायरल-मध्यस्थता जीन वितरण का एक विकल्प, कोशिकाओं के डीएनए, आरएनए और प्रोटीन अभिकर्मक करने के लिए एक इष्टतम विद्युत पल्स वेवफॉर्म के आवेदन पर निर्भर करता है। बाहरी विद्युत क्षेत्र के आवेदन के बाद, कोशिका झिल्ली से संक्षेप में समझौता किया जाता है, जिससे सेल अन्यथा अभेद्य बहिर्जात सामग्री के इंट्रासेल्युलर वितरण के लिए अतिसंवेदनशील होजाता है। वायरल-मध्यस्थता वितरण की तुलना में, इलेक्ट्रोपोरेशन फायदेमंद है क्योंकि यह आम तौर पर सुरक्षित है, संचालित करने में आसान है, और इसमें कम परिचालन लागत है। इलेक्ट्रोपोरेशन छोटे और बड़े आणविक कार्गो दोनों को वितरित कर सकता है और वंश 5 की परवाह किए बिना कोशिकाओं को स्थानांतरित करने में कुशल हो सकताहै। इलेक्ट्रोपोरेशन के बाद वांछनीय परिणाम प्राप्त करने के लिए, यानी, अच्छी व्यवहार्यता और अच्छी इलेक्ट्रो-अभिकर्मक दक्षता, विभिन्न प्रकार के प्रयोगात्मक मापदंडों को सह-अनुकूलित करने की आवश्यकता है। इनमें सेल प्रकार6, सेल घनत्व, अणु एकाग्रता7, इलेक्ट्रोपोरेशन बफर गुण (जैसे, आणविक संरचना, चालकता और परासरण) 8, इलेक्ट्रोड आकार / ज्यामिति9, और विद्युत पल्स वेवफॉर्म (आकार, ध्रुवीयता, दालों की संख्या) 10 (एक चित्रण के लिए चित्रा 1 देखें) शामिल हैं। यद्यपि इनमें से प्रत्येक पैरामीटर इलेक्ट्रोपोरेशन प्रयोगों के परिणामों पर महत्वपूर्ण प्रभाव डाल सकता है, पल्स वेवफॉर्म का विशेष रूप से बहुत विस्तार से अध्ययन किया गया है, क्योंकि लागू पल्स (एस) की विद्युत ऊर्जा परिणामी सेल व्यवहार्यता और इलेक्ट्रो-अभिकर्मक दक्षता8 के बीच आंतरिक व्यापार-बंद की जड़ है।
आमतौर पर, इलेक्ट्रोपोरेशन प्रयोग मैक्रो-स्केल पर किए जाते हैं, जहां कोशिकाओं को इलेक्ट्रोपोरेशन क्यूवेट के भीतर बड़े, समानांतर-प्लेट इलेक्ट्रोड के एक सेट के बीच बफर के माइक्रोलीटर के 100 एस में निलंबित कर दिया जाता है। इलेक्ट्रोड आमतौर पर 1-4 मिमी की इलेक्ट्रोड दूरी के साथ एल्यूमीनियम से निर्मित होते हैं। एक बार जब कोशिकाओं को पिपेट के माध्यम से मैन्युअल रूप से लोड किया जाता है, तो क्यूवेट विद्युत रूप से एक भारी, विद्युत पल्स जनरेटर से जुड़ा होता है जहां उपयोगकर्ता सेल निलंबन को इलेक्ट्रोपोरेट करने के लिए पल्स वेवफॉर्म पैरामीटर सेट और लागू कर सकता है। यद्यपि मैक्रो-स्केल या बल्क इलेक्ट्रोपोरेशन सेल घनत्व >106 सेल / एमएल को संसाधित कर सकता है, लेकिन विद्युत पल्स वेवफॉर्म सेटिंग्स को अनुकूलित करते समय यह सुविधा बेकार हो सकती है। यह विशेष रूप से चिंता का विषय है जब प्राथमिक सेल प्रकारों को इलेक्ट्रोपोरेट किया जाता है जहां सेल जनसंख्या संख्या सीमित हो सकती है। इसके अतिरिक्त, इलेक्ट्रोड के बीच बड़ी दूरी के कारण, पल्स जनरेटर को विद्युत क्षेत्र की ताकत >1kV/ cm 11 प्राप्त करने के लिए बड़े वोल्टेज की आपूर्ति करने में सक्षम होना चाहिए। ये उच्च वोल्टेज इलेक्ट्रोलाइट बफर के माध्यम से प्रतिरोधक शक्ति अपव्यय का कारण बनते हैं जिसके परिणामस्वरूप जूल हीटिंग होती है, जो परिणामस्वरूप सेल व्यवहार्यता12 के लिए हानिकारक हो सकती है। अंत में, कोशिकाओं के घने निलंबन पर इलेक्ट्रोपोरेशन करने से परिणामस्वरूप इलेक्ट्रो-अभिकर्मक दक्षता और सेल व्यवहार्यता में जन्मजात परिवर्तनशीलता का बोझ लगातार पड़ेगा। निलंबन में प्रत्येक सेल आसपास की कोशिकाओं के कारण एक अलग विद्युत क्षेत्र की ताकत का अनुभव कर सकता है। इस बात पर निर्भर करता है कि अनुभवी विद्युत क्षेत्र की ताकत या तो बढ़ी है या कम हो गई है, परिणामस्वरूप सेल व्यवहार्यता या इलेक्ट्रो-अभिकर्मक दक्षता प्रत्येक नकारात्मक रूप से प्रभावित हो सकतीहै। मैक्रो-स्केल इलेक्ट्रोपोरेशन के इन डाउनसाइड्स ने वैकल्पिक प्रौद्योगिकियों की खोज और विकास को जन्म दिया है जो माइक्रो-स्केल पर काम करते हैं और एकल-सेल स्तर पर बेहतर नियंत्रण की अनुमति देते हैं।
बायोएमईएमएस, या बायोमेडिकल माइक्रो-इलेक्ट्रो-मैकेनिकल सिस्टम का क्षेत्र, माइक्रोइलेक्ट्रॉनिक उद्योग में की गई तकनीकी प्रगति से उपजा है। विशेष रूप से, बायोमेडिकल अनुसंधान की प्रगति के लिए माइक्रो-डिवाइस विकसित करने के लिए माइक्रोफैब्रिकेशन प्रक्रियाओं का उपयोग करना। इन प्रगतियों में विवो इलेक्ट्रिकल मॉनिटरिंग13 के लिए माइक्रो-इलेक्ट्रोड सरणियों का विकास, सीटू इलेक्ट्रोपोरेशन14 के लिए कैपेसिटिव माइक्रो-इलेक्ट्रोड, लघु अंग-ऑन-ए-चिप डिवाइस15, माइक्रोफ्लुइडिक पॉइंट-ऑफ-केयर डायग्नोस्टिक्स16, बायोसेंसर17, और दवा वितरण प्रणाली18 शामिल हैं, जिसमें नैनो और माइक्रो-इलेक्ट्रोपोरेशन डिवाइस 19,20,21 शामिल हैं। . जैविक कोशिकाओं के समान आकार के पैमाने पर उपकरणों को डिजाइन और निर्माण करने की क्षमता के कारण, नैनो- और माइक्रो-इलेक्ट्रोपोरेशन प्रौद्योगिकियां उनके मैक्रो-स्केल समकक्ष22,23 की तुलना में फायदेमंद हैं। ये इलेक्ट्रोपोरेशन डिवाइस उच्च वोल्टेज पल्स अनुप्रयोगों की आवश्यकता को समाप्त करते हैं, क्योंकि माइक्रोमीटर के 10 से 100 के बीच की दूरी वाले इलेक्ट्रोड सेट आमतौर पर एकीकृत होते हैं। यह सुविधा इलेक्ट्रोलाइट के माध्यम से वर्तमान को काफी कम कर देती है, जो बदले में विषाक्त इलेक्ट्रोलिसिस उत्पादों के संचय और इन प्रणालियों में जूल हीटिंग के प्रभाव को कम करती है। सूक्ष्म पैमाने के चैनल यह भी सुनिश्चित करते हैं कि पल्स अनुप्रयोग के दौरान कोशिकाओं पर एक अधिक समान विद्युत क्षेत्र मज़बूती से लागू होता है, जिसके परिणामस्वरूप अधिक सुसंगत परिणामहोते हैं। इसके अलावा, माइक्रो-इलेक्ट्रोपोरेशन उपकरणों को माइक्रोफ्लुइडिक प्लेटफॉर्म में एकीकृत करना भी आम है जो भविष्य में पूरी तरह से स्वचालित तकनीक में एकीकरण के लिए खुद को उधार देताहै, सेल थेरेपी निर्माण में एक अत्यधिक वांछनीय क्षमता। अंत में, माइक्रो-स्केल इलेक्ट्रोपोरेशन इलेक्ट्रोपोरेशन घटनाओं की विद्युत पूछताछ की अनुमति देता है। उदाहरण के लिए, सेल झिल्ली परमेबिलाइजेशन की डिग्री को वास्तविक समय में एकल कोशिका स्तर26,27 पर निगरानी की जा सकती है। इस पद्धति का उद्देश्य माइक्रोफैब्रिकेशन, सिस्टम ऑपरेशन और माइक्रोफ्लुइडिक, सिंगल-सेल माइक्रो-इलेक्ट्रोपोरेशन डिवाइस के विश्लेषण का वर्णन करना है, जो इलेक्ट्रोपोरेशन प्रोटोकॉल को अनुकूलित करने के लिए सेल झिल्ली परमेबिलाइजेशन की डिग्री को मापने में सक्षम है, फिर भी पिछले अत्याधुनिक पर थ्रूपुट बढ़ रहा है।
एकल-कोशिका स्तर इलेक्ट्रोपोरेशन का प्रदर्शन अब एक नई तकनीक नहीं है, क्योंकि यह पहली बार 2001 में रुबिन्स्की एट अल द्वारा एक स्थिर सेल इलेक्ट्रोपोरेशन तकनीक28 के विकास के साथ प्रदर्शित किया गया था। उनका माइक्रो-डिवाइस अभिनव था क्योंकि वे विद्युतीकरण की घटना की विद्युत निगरानी करने की क्षमता का प्रदर्शन करने वाले पहले व्यक्ति थे। इसने स्थैतिक, एकल-सेल इलेक्ट्रोपोरेशन प्रौद्योगिकियों के विकास को आगे बढ़ाया है जो उपकरणों के थ्रूपुट को बढ़ाने के लिए समानांतर तरीके से सेल झिल्ली परमेबिलाइजेशन की डिग्री का विद्युत रूप से पता लगाने में सक्षम हैं। हालांकि, समानांतरकरण और बैच प्रोसेसिंग के साथ भी, इन उपकरणों में कोशिकाओं की कुल संख्या की गंभीर रूप से कमी होती है जो वे प्रति यूनिट समय29,30 को संसाधित कर सकते हैं। इस सीमा ने प्रवाह-माध्यम उपकरणों के विकास को जन्म दिया है जो एकल-कोशिका स्तर के माइक्रो-इलेक्ट्रोपोरेशन को बहुत अधिक थ्रूपुट31 पर करने में सक्षम हैं। यह उपकरण संक्रमण, स्थिर से प्रवाह-माध्यम से पर्यावरण तक, इलेक्ट्रोपोरेशन पल्स के आवेदन के बाद कोशिका झिल्ली परमेबिलाइजेशन की डिग्री की विद्युत निगरानी की क्षमता को सीमित करता है। इस काम में वर्णित विधि इन दो प्रौद्योगिकियों के बीच की खाई को पुल करती है, एक सूक्ष्म-इलेक्ट्रोपोरेशन तकनीक जो विद्युत यी रूप से पता लगाने, स्पंदन करने और व्यक्तिगत कोशिकाओं के सेल झिल्ली परमेबिलाइजेशन की डिग्री की निगरानी करने में सक्षम है, एक निरंतर-प्रवाह, सीरियल फैशन में।
इस तकनीक को हाल ही में झेंग एट अल में वर्णित किया गया था। उस काम में, इस तकनीक की क्षमताओं को एक पैरामीट्रिक अध्ययन के पूरा होने के साथ पेश किया गया था, जहां इलेक्ट्रोपोरेशन पल्स के आयाम और अवधि दोनों विविध थे, और आगामी विद्युत संकेत, कोशिका झिल्ली परमेबिलाइजेशन का संकेत,32 का पता लगाया गया था। परिणामों से पता चला है कि इलेक्ट्रोपोरेशन पल्स की तीव्रता में वृद्धि (यानी, लागू विद्युत क्षेत्र में वृद्धि या पल्स अवधि में वृद्धि) ने मापा कोशिका झिल्ली परमेबिलाइजेशन में वृद्धि का कारण बना। सिस्टम को और मान्य करने के लिए, सफल इलेक्ट्रोपोरेशन का एक सामान्य फ्लोरोसेंट संकेतक, प्रोपिडियम आयोडाइड33, सेल निलंबन में जोड़ा गया था, और विद्युत पल्स के आवेदन के तुरंत बाद एक प्रतिदीप्ति छवि कैप्चर की गई थी। ऑप्टिकल सिग्नल, यानी, सेल के अंदर प्रोपिडियम आयोडाइड की प्रतिदीप्ति तीव्रता, इस विद्युत माप की विश्वसनीयता को सत्यापित करते हुए, कोशिका झिल्ली परमेबिलाइजेशन की डिग्री के विद्युत माप के साथ दृढ़ता से सहसंबद्ध थी। हालांकि, इस काम ने केवल छोटे अणु प्रोपिडियम आयोडाइड के वितरण पर विचार किया, जिसका कोई हस्तांतरणीय महत्व नहीं है।
इस काम में, जैविक रूप से सक्रिय प्लास्मिड डीएनए (पीडीएनए) वेक्टर प्रदान करते समय सिस्टम के थ्रूपुट में सुधार करने और इलेक्ट्रोपोरेशन के बाद पुन: उत्पन्न और सुसंस्कृत कोशिकाओं की इलेक्ट्रो-अभिकर्मक दक्षता का आकलन करने के लिए इस तकनीक का एक नया अनुप्रयोग पेश किया गया है। हालांकि पिछले काम ने मौजूदा माइक्रो-इलेक्ट्रोपोरेशन प्रौद्योगिकियों से बेहतर प्रदर्शन किया है जो विद्युतीकरण की घटना को विद्युत रूप से मापने में सक्षम हैं, डिवाइस की वर्तमान स्थिति को अभी भी सेल डिटेक्शन, पल्स एप्लिकेशन और सेल झिल्ली परमेबिलाइजेशन माप करने के लिए इलेक्ट्रोड सेट (~ 250 एमएस) के बीच लंबे सेल पारगमन समय की आवश्यकता होती है। एक एकल चैनल के साथ, यह थ्रूपुट को 4 कोशिकाओं / एस तक सीमित करता है। इस सीमा का मुकाबला करने के लिए, पीडीएनए इलेक्ट्रो-अभिकर्मक करने के लिए सेल-जनसंख्या-आधारित प्रतिक्रिया-नियंत्रित इलेक्ट्रोपोरेशन की एक नई अवधारणा पेश की गई है। हाइपो-फिजियोलॉजिकल चालकता इलेक्ट्रोपोरेशन बफर का उपयोग करके, यह प्रणाली इलेक्ट्रोपोरेशन पल्स अनुप्रयोगों की भीड़ में एकल कोशिकाओं की विद्युत पूछताछ की अनुमति देती है। विद्युत प्रतिक्रिया के आधार पर, एक ‘इष्टतम’ इलेक्ट्रोपोरेशन पल्स तब निर्धारित किया जाता है। एक ‘उच्च-थ्रूपुट’ मोड तब लागू किया जाता है जहां कोशिका झिल्ली पारगम्यता निर्धारण शून्य हो जाता है, प्रवाह दर बढ़ जाती है, और इलेक्ट्रोड के बीच पारगमन में प्रति सेल एक पल्स सुनिश्चित करने के लिए इलेक्ट्रोपोरेशन पल्स ड्यूटी चक्र को सेल ट्रांजिट समय से मिलान किया जाता है। यह काम माइक्रो-डिवाइस के निर्माण के लिए माइक्रोफैब्रिकेशन चरणों, प्रयोग करने के लिए आवश्यक सामग्री / उपकरण और उनके सेटअप, और डिवाइस के संचालन / विश्लेषण और इसकी इलेक्ट्रो-अभिकर्मक दक्षता (ईटीई) में व्यापक विवरण प्रदान करेगा।
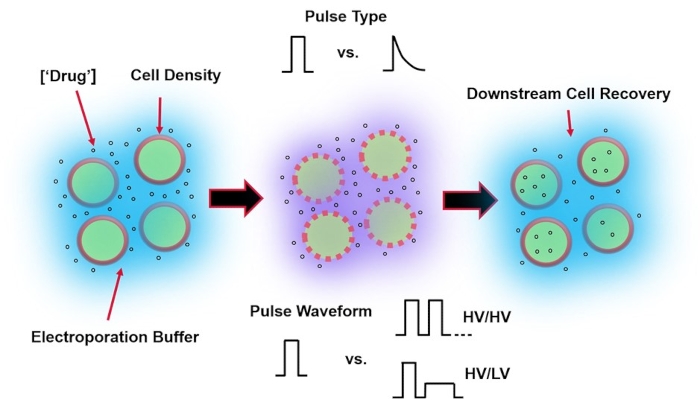
(बाएं) सेल सस्पेंशन- इलेक्ट्रोपोरेशन की शुरुआत से पहले विचार करने के लिए महत्वपूर्ण कारकों में शामिल हैं: पेलोड (इस मामले में, पीडीएनए), एकाग्रता, सेल घनत्व और इलेक्ट्रोपोरेशन बफर गुण। विचार करने के लिए इलेक्ट्रोपोरेशन बफर गुण चालकता, परासरण और इन मूल्यों में योगदान देने वाली सटीक आणविक संरचना हैं। (मध्य) पल्स अनुप्रयोग- सटीक पल्स-प्रकार (वर्ग तरंग बनाम घातीय क्षय) और पल्स वेवफॉर्म (एकल पल्स बनाम पल्स ट्रेन) को परिणामी सेल व्यवहार्यता और इलेक्ट्रो-अभिकर्मक दक्षता दोनों को अधिकतम करने के लिए अनुकूलित किया जाना चाहिए। इलेक्ट्रोपोरेशन प्रक्रियाओं में कार्यान्वित सामान्य पल्स ट्रेनें आमतौर पर उच्च वोल्टेज (एचवी) दालों की एक श्रृंखला या एचवी और लो वोल्टेज (एलवी) पल्स परिमाण के बीच घूमने वाली दालों की श्रृंखला से बनी होती हैं। (दाएं) सेल रिकवरी-डाउन-स्ट्रीम प्रोसेसिंग चरण, विशेष रूप से, रिकवरी सेल कल्चर मीडिया जिसे कोशिकाओं को स्थानांतरित किया जाता है, को अनुकूलित किया जाना चाहिए। चित्रित नहीं (सुदूर बाएं), समग्र इलेक्ट्रोपोरेशन प्रक्रिया अनुकूलन के लिए अतिरिक्त अपस्ट्रीम सेल प्रोसेसिंग चरणों को लागू किया जा सकता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
इस प्रोटोकॉल के भीतर प्रस्तुत पद्धति मुख्य रूप से एक माइक्रोफ्लुइडिक डिवाइस के माइक्रोफैब्रिकेशन पर केंद्रित है जिसे बाद में एक विशेष इलेक्ट्रोपोरेशन प्रयोगात्मक सेटअप में एकीकृत किया जाता है। शब?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
लेखक नेशनल साइंस फाउंडेशन (एनएसएफ सीबीईटी 0967598, डीबीआई आईडीबीआर 1353918) और यूएस डिपार्टमेंट ऑफ एजुकेशन के ग्रेजुएट ट्रेनिंग इन इमर्जिंग एरियाज प्रिसिजन एंड पर्सनलाइज्ड मेडिसिन (पी 200 ए 150131) द्वारा फेलोशिप पर स्नातक छात्र जेजेएस को वित्त पोषित करने के लिए वित्तीय सहायता को स्वीकार करना चाहते हैं।
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

