La fabbricazione e il funzionamento di un sistema di micro-elettroporazione a flusso continuo con rilevamento di permeabilizzazione
Summary
Questo protocollo descrive le tecniche di microfabbricazione necessarie per costruire un dispositivo di elettroporazione microfluidica lab-on-a-chip. La configurazione sperimentale esegue trasfezioni controllate a livello di singola cellula in un flusso continuo e può essere estesa a portate più elevate con controllo basato sulla popolazione. Viene fornita un’analisi che mostra la capacità di monitorare elettricamente il grado di permeabilizzazione della membrana cellulare in tempo reale.
Abstract
Le attuali innovazioni terapeutiche, come la terapia cellulare CAR-T, dipendono fortemente dalla somministrazione genica mediata da virus. Sebbene efficiente, questa tecnica è accompagnata da elevati costi di produzione, che hanno suscitato un interesse nell’utilizzo di metodi alternativi per la consegna genica. L’elettroporazione è un approccio elettrofisico non virale per la consegna intracellulare di geni e altri materiali esogeni. Dopo l’applicazione di un campo elettrico, la membrana cellulare consente temporaneamente la consegna molecolare nella cellula. Tipicamente, l’elettroporazione viene eseguita su macroscala per elaborare un gran numero di cellule. Tuttavia, questo approccio richiede un ampio sviluppo di protocolli empirici, che è costoso quando si lavora con tipi di cellule primarie e difficili da trasfettare. Il lungo sviluppo del protocollo, insieme alla necessità di grandi tensioni per ottenere sufficienti intensità di campo elettrico per permeabilizzare le celle, ha portato allo sviluppo di dispositivi di elettroporazione su microscala. Questi dispositivi di micro-elettroporazione sono fabbricati utilizzando tecniche di microfabbricazione comuni e consentono un maggiore controllo sperimentale con il potenziale di mantenere elevate capacità di produttività. Questo lavoro si basa su una tecnologia di elettroporazione microfluidica in grado di rilevare il livello di permeabilizzazione della membrana cellulare a livello di singola cellula in un flusso continuo. Tuttavia, questa tecnologia è stata limitata a 4 celle elaborate al secondo, e quindi un nuovo approccio per aumentare il throughput del sistema è proposto e presentato qui. Questa nuova tecnica, indicata come controllo di feedback basato sulla popolazione cellulare, considera la risposta di permeabilizzazione cellulare a una varietà di condizioni di impulso dell’elettroporazione e determina le condizioni di impulso di elettroporazione più adatte per il tipo di cellula in esame. Viene quindi utilizzata una modalità a throughput più elevato, in cui questo impulso “ottimale” viene applicato alla sospensione cellulare in transito. I passaggi per fabbricare il dispositivo, impostare e gestire gli esperimenti microfluidici e analizzare i risultati sono presentati in dettaglio. Infine, questa tecnologia di micro-elettroporazione è dimostrata fornendo un plasmide del DNA che codifica per la proteina fluorescente verde (GFP) nelle cellule HEK293.
Introduction
Le attuali innovazioni terapeutiche nella ricerca biomedica, come la terapia cellulare CAR-T (Chimeric Antigen Receptor Engineered T cell) e l’editing genetico utilizzando CRISPR (clustered regularly interspaced short palindromic repeat DNA sequences) / Cas9, si basano fortemente sulla capacità di fornire materiale esogeno sia con successo che in modo efficiente nello spazio intracellulare1. Nella terapia CAR-T, il gold standard per eseguire la fase di consegna genica nella produzione di terapia cellulare è l’utilizzo di vettori virali2. Sebbene la consegna genica mediata da virus sia una modalità di consegna efficiente, presenta anche diversi inconvenienti. Questi includono i costi di produzione, la citotossicità, l’immunogenicità, il potenziale di mutagenesi/tumorigenesi e le limitazioni delle dimensioni dei geni da somministrare3. Queste limitazioni hanno portato alla ricerca e allo sviluppo di tecnologie di somministrazione alternative e non virali.
L’elettroporazione, un’alternativa alla consegna genica mediata da virus, si basa sull’applicazione di una forma d’onda di impulso elettrico ottimale per eseguire trasfezioni di DNA, RNA e proteine delle cellule. A seguito dell’applicazione di un campo elettrico esterno, la membrana cellulare viene brevemente compromessa, rendendo la cellula suscettibile alla consegna intracellulare di materiali esogeni altrimenti impermeabili4. Rispetto alla somministrazione mediata da virus, l’elettroporazione è vantaggiosa in quanto è generalmente sicura, facile da usare e ha bassi costi operativi. L’elettroporazione può trasportare sia piccoli che grandi carichi molecolari e può essere efficiente nel trasfettare le cellule indipendentemente dal lignaggio5. Per ottenere risultati desiderabili dopo l’elettroporazione, cioè una buona vitalità e una buona efficienza di elettro-trasfezione, una varietà di parametri sperimentali deve essere co-ottimizzata. Questi includono il tipo di cella6, la densità cellulare, la concentrazione della molecola7, le proprietà del tampone di elettroporazione (ad esempio, composizione molecolare, conducibilità e osmolarità)8, dimensione/geometria dell’elettrodo9 e forma d’onda dell’impulso elettrico (forma, polarità, numero di impulsi)10 (fare riferimento alla Figura 1 per un’illustrazione). Sebbene ciascuno di questi parametri possa avere un effetto significativo sui risultati degli esperimenti di elettroporazione, la forma d’onda dell’impulso è stata studiata in modo particolarmente dettagliato, poiché l’energia elettrica degli impulsi applicati è la radice del compromesso intrinseco tra la vitalità cellulare risultante e l’efficienza di elettro-trasfezione8.
Tipicamente, gli esperimenti di elettroporazione vengono eseguiti su macro-scala, dove le celle sono sospese in 100 microlitri di tampone tra una serie di grandi elettrodi a piastra parallela all’interno di una cuvetta di elettroporazione. Gli elettrodi sono comunemente fabbricati in alluminio con una distanza dell’elettrodo di 1-4 mm. Una volta che le celle vengono caricate manualmente tramite pipetta, la cuvetta è collegata elettricamente a un ingombrante generatore di impulsi elettrici in cui l’utente può impostare e applicare i parametri della forma d’onda dell’impulso per elettropolare la sospensione della cella. Sebbene l’elettroporazione su macroscala o di massa possa elaborare densità cellulari >106 celle/ml, questa funzione può essere dispendiosa quando si ottimizzano le impostazioni della forma d’onda dell’impulso elettrico. Ciò è particolarmente preoccupante quando si elettroporano tipi di cellule primarie in cui il numero di popolazioni cellulari può essere limitato. Inoltre, a causa della grande distanza tra gli elettrodi, il generatore di impulsi deve essere in grado di fornire grandi tensioni per ottenere intensità di campo elettrico >1kV / cm11. Queste alte tensioni causano una dissipazione di potenza resistiva attraverso il tampone elettrolitico con conseguente riscaldamento Joule, che può essere dannoso per la vitalità della cella risultante12. Infine, l’esecuzione dell’elettroporazione su una sospensione densa di cellule sarà costantemente gravata da una variabilità innata nell’efficienza di elettro-trasfezione risultante e nella vitalità cellulare. Ogni cellula in sospensione potrebbe sperimentare una diversa intensità del campo elettrico a causa delle cellule circostanti. A seconda che l’intensità del campo elettrico sperimentato sia aumentata o diminuita, la vitalità cellulare risultante o l’efficienza di elettro-trasfezione possono essere influenzate negativamente11. Questi aspetti negativi dell’elettroporazione su macro-scala hanno portato alla ricerca e allo sviluppo di tecnologie alternative che operano su micro-scala e consentono un migliore controllo a livello di singola cella.
Il campo dei BioMEMS, o sistemi biomedici micro-elettro-meccanici, deriva dai progressi tecnologici compiuti nel settore della microelettronica. In particolare, utilizzando processi di microfabbricazione per sviluppare micro-dispositivi per il progresso della ricerca biomedica. Questi progressi includono lo sviluppo di array di micro-elettrodi per il monitoraggio elettrico in vivo13, micro-elettrodi capacitivi per elettroporazione in situ 14, dispositivi miniaturizzati organ-on-a-chip 15, diagnostica microfluidica point-of-care 16, biosensori 17 e sistemi di somministrazione di farmaci 18, compresi dispositivi di nano e micro-elettroporazione 19,20,21 . Grazie alla capacità di progettare e produrre dispositivi alla stessa scala dimensionale delle celle biologiche, le tecnologie di nano e micro-elettroporazione sono vantaggiose rispetto alla loro controparte su macroscala22,23. Questi dispositivi di elettroporazione eliminano la necessità di applicazioni a impulsi ad alta tensione, poiché i set di elettrodi con spaziature da 10 a 100 secondi di micrometri sono tipicamente integrati. Questa caratteristica riduce drasticamente la corrente attraverso l’elettrolita, che a sua volta riduce l’accumulo di prodotti di elettrolisi tossici e gli effetti del riscaldamento Joule in questi sistemi. I canali su microscala assicurano inoltre che un campo elettrico molto più uniforme venga applicato in modo affidabile alle celle durante l’applicazione dell’impulso, con risultati più coerenti24. Inoltre, è anche normale che i dispositivi di microelettroporazione siano integrati in una piattaforma microfluidica che si presta per la futura integrazione in una tecnologia completamente automatizzata, una capacità altamente auspicabile nella produzione di terapie cellulari25. Infine, l’elettroporazione su microscala consente l’interrogazione elettrica degli eventi di elettroporazione. Ad esempio, il grado di permeabilizzazione della membrana cellulare può essere monitorato in tempo reale a livello di singola cellula26,27. Lo scopo di questo metodo è quello di descrivere la microfabbricazione, il funzionamento del sistema e l’analisi di un dispositivo microfluidico di microelettroporazione monocellulare in grado di misurare il grado di permeabilizzazione della membrana cellulare per ottimizzare i protocolli di elettroporazione, aumentando al contempo la produttività rispetto al precedente stato dell’arte.
L’esecuzione dell’elettroporazione a livello di singola cellula non è più una tecnica nuova, come è stato dimostrato per la prima volta da Rubinsky et al. nel 2001 con lo sviluppo di una tecnologia di elettroporazione a celle statiche28. Il loro micro-dispositivo è stato innovativo in quanto sono stati i primi a dimostrare la capacità di monitorare elettricamente l’evento di elettroporazione. Ciò ha ulteriormente portato allo sviluppo di tecnologie statiche di elettroporazione a cella singola in grado di rilevare elettricamente il grado di permeabilizzazione della membrana cellulare in modo parallelizzato per aumentare la produttività dei dispositivi. Tuttavia, anche con la parallelizzazione e l’elaborazione batch, questi dispositivi mancano gravemente del numero totale di celle che possono elaborare per unità di tempo29,30. Questa limitazione ha portato allo sviluppo di dispositivi flow-through in grado di eseguire microelettroporazione a livello di singola cella a portate molto maggiori31. Questa transizione del dispositivo, dall’ambiente statico a quello flow-through, limita la capacità di monitorare elettricamente il grado di permeabilizzazione della membrana cellulare in seguito all’applicazione dell’impulso di elettroporazione. Il metodo descritto in questo lavoro colma il divario tra queste due tecnologie, una tecnologia di micro-elettroporazione in grado di rilevare, pulsare e monitorare elettricamente il grado di permeabilizzazione della membrana cellulare delle singole cellule, in modo seriale a flusso continuo.
Questa tecnologia è stata recentemente descritta in Zheng et al. In quel lavoro, le capacità di questa tecnologia sono state introdotte con il completamento di uno studio parametrico, in cui sono state variate sia l’ampiezza che la durata dell’impulso di elettroporazione, e il conseguente segnale elettrico, indicativo della permeabilizzazione della membrana cellulare, è stato esplorato32. I risultati hanno mostrato che un aumento dell’intensità dell’impulso di elettroporazione (cioè aumento del campo elettrico applicato o aumento della durata dell’impulso) ha causato un aumento della permeabilizzazione della membrana cellulare misurata. Per convalidare ulteriormente il sistema, un indicatore fluorescente comune di elettroporazione riuscita, lo ioduro di propidio33, è stato aggiunto alla sospensione cellulare e un’immagine di fluorescenza è stata acquisita immediatamente dopo l’applicazione dell’impulso elettrico. Il segnale ottico, cioè l’intensità di fluorescenza dello ioduro di propidio all’interno della cellula, è stato fortemente correlato con la misura elettrica del grado di permeabilizzazione della membrana cellulare, verificando l’affidabilità di questa misura elettrica. Tuttavia, questo lavoro ha considerato solo la consegna della piccola molecola ioduro di propidio, che ha poco o nessun significato traducibile.
In questo lavoro, viene introdotta una nuova applicazione di questa tecnologia per migliorare la produttività del sistema, fornendo al contempo un vettore di DNA plasmidico biologicamente attivo (pDNA) e valutando l’efficienza di elettro-trasfezione delle cellule riplaccate e coltivate dopo l’elettroporazione. Sebbene il lavoro precedente superi le tecnologie di micro-elettroporazione esistenti che sono in grado di misurare elettricamente l’evento di elettroporazione, lo stato attuale del dispositivo richiede ancora lunghi tempi di transito della cella tra il set di elettrodi (~ 250 ms) per eseguire il rilevamento cellulare, l’applicazione dell’impulso e la misurazione della permeabilizzazione della membrana cellulare. Con un singolo canale, questo limita il throughput a 4 celle/s. Per combattere questa limitazione, viene introdotto un nuovo concetto di elettroporazione controllata da feedback basata sulla popolazione cellulare per eseguire l’elettro-trasfezione del pDNA. Utilizzando un tampone di elettroporazione a conducibilità ipofisiologica, questo sistema consente l’interrogazione elettrica di singole celle attraverso una moltitudine di applicazioni di impulsi di elettroporazione. Sulla base della risposta elettrica, viene quindi determinato un impulso di elettroporazione “ottimale”. Viene quindi implementata una modalità “high-throughput” in cui la determinazione della permeabilizzazione della membrana cellulare viene annullata, la portata viene aumentata e il duty cycle dell’impulso di elettroporazione viene abbinato al tempo di transito della cella per garantire un impulso per cella in transito tra gli elettrodi. Questo lavoro fornirà ampi dettagli sulle fasi di microfabbricazione per la produzione del micro-dispositivo, il materiale / attrezzatura e la loro configurazione necessaria per eseguire la sperimentazione, e il funzionamento / analisi del dispositivo e la sua efficienza di elettro-trasfezione (eTE).
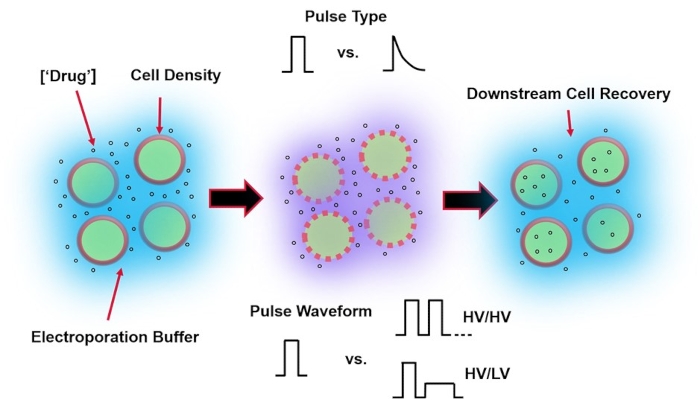
Figura 1: Fattori sperimentali che influenzano i risultati dell’elettroporazione. (Sinistra) Sospensione cellulare: i fattori importanti da considerare prima dell’inizio dell’elettroporazione includono: carico utile (in questo caso, pDNA), concentrazione, densità cellulare e proprietà del tampone di elettroporazione. Le proprietà del tampone di elettroporazione da considerare sono la conduttività, l’osmolarità e l’esatta composizione molecolare che contribuisce a questi valori. (Al centro) Applicazione dell’impulso – Il tipo di impulso esatto (onda quadra vs. decadimento esponenziale) e la forma d’onda dell’impulso (singolo impulso vs. treno di impulsi) devono essere ottimizzati per massimizzare sia la vitalità cellulare risultante che l’efficienza di elettro-trasfezione. I treni di impulsi comuni implementati nei processi di elettroporazione sono tipicamente composti da una serie di impulsi ad alta tensione (HV) o serie di impulsi che ruotano tra le grandezze di impulso HV e bassa tensione (BT). (Destra) Le fasi di elaborazione a valle del recupero cellulare, in particolare i terreni di coltura cellulare di recupero in cui le cellule vengono trasferite, dovrebbero essere ottimizzati. Non in primo piano (estrema sinistra), è possibile implementare ulteriori fasi di elaborazione delle celle a monte per l’ottimizzazione complessiva del processo di elettroporazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
La metodologia presentata all’interno di questo protocollo si concentra principalmente sulla microfabbricazione di un dispositivo microfluidico che viene poi integrato in una configurazione sperimentale di elettroporazione specializzata. Il termine “ricetta”, che viene spesso utilizzato quando si descrivono le specifiche del processo di microfabbricazione, suggerisce l’importanza di seguire / ottimizzare ogni fase per fabbricare con successo un dispositivo funzionante. Tuttavia, alcune fasi critiche all’interno del proce…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori vorrebbero riconoscere il sostegno finanziario della National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) e della formazione universitaria del Dipartimento dell’Istruzione degli Stati Uniti in aree emergenti di precisione e medicina personalizzata (P200A150131) per finanziare lo studente laureato J.J.S. sulla borsa di studio.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

