Tillverkning och drift av ett kontinuerligt flöde, mikroelektroporationssystem med permeabiliseringsdetektering
Summary
Detta protokoll beskriver de mikrofabrikationstekniker som krävs för att bygga en lab-on-a-chip, mikrofluidisk elektroporationsanordning. Den experimentella installationen utför kontrollerade transfektioner på encellsnivå i ett kontinuerligt flöde och kan utökas till högre genomströmningar med populationsbaserad kontroll. En analys tillhandahålls som visar förmågan att elektriskt övervaka graden av cellmembranpermeabilisering i realtid.
Abstract
Nuvarande terapeutiska innovationer, såsom CAR-T-cellterapi, är starkt beroende av virusmedierad genleverans. Även om den är effektiv åtföljs denna teknik av höga tillverkningskostnader, vilket har medfört ett intresse för att använda alternativa metoder för genleverans. Elektroporering är ett elektrofysiskt, icke-viralt tillvägagångssätt för intracellulär leverans av gener och andra exogena material. Vid applicering av ett elektriskt fält tillåter cellmembranet tillfälligt molekylär leverans in i cellen. Typiskt utförs elektroporering på makroskalan för att bearbeta ett stort antal celler. Detta tillvägagångssätt kräver dock omfattande empirisk protokollutveckling, vilket är kostsamt när man arbetar med primära och svårtransfekta celltyper. Lång protokollutveckling, i kombination med kravet på stora spänningar för att uppnå tillräckliga elektriska fältstyrkor för att permeabilisera cellerna, har lett till utvecklingen av elektroporeringsanordningar i mikroskala. Dessa mikroelektroporeringsanordningar tillverkas med vanliga mikrofabrikationstekniker och möjliggör större experimentell kontroll med potential att upprätthålla hög genomströmningskapacitet. Detta arbete bygger på en mikrofluidisk-elektroporeringsteknik som kan detektera nivån av cellmembranpermeabilisering på en encellsnivå under kontinuerligt flöde. Denna teknik var dock begränsad till 4 celler som bearbetades per sekund, och därför föreslås och presenteras ett nytt tillvägagångssätt för att öka systemets genomströmning här. Denna nya teknik, betecknad som cellpopulationsbaserad återkopplingskontroll, tar hänsyn till cellpermeabiliseringssvaret på en mängd olika elektroporationspulserande förhållanden och bestämmer de bäst lämpade elektroporationspulsförhållandena för celltypen som testas. Ett högre genomströmningsläge används sedan, där denna “optimala” puls appliceras på cellsuspensionen under transport. Stegen för att tillverka enheten, ställa in och köra mikrofluidiska experiment och analysera resultaten presenteras i detalj. Slutligen demonstreras denna mikroelektroporeringsteknik genom att leverera en DNA-plasmid som kodar för grönt fluorescerande protein (GFP) till HEK293-celler.
Introduction
Nuvarande terapeutiska innovationer inom biomedicinsk forskning, såsom CAR-T (Chimeric Antigen Receptor Engineered T-cell) cellterapi och genetisk redigering med CRISPR (clustered regular interspaced short palindromic repeat DNA sequences)/Cas9, förlitar sig starkt på förmågan att leverera exogent material både framgångsrikt och effektivt till det intracellulära utrymmet1. I CAR-T-terapi använder guldstandarden för att utföra genleveranssteget i cellterapitillverkning virala vektorer2. Även om virusmedierad genleverans är en effektiv leveransmodalitet, har den också flera nackdelar. Dessa inkluderar tillverkningskostnader, cytotoxicitet, immunogenicitet, mutagenes / tumorigenespotential och storleksbegränsningar för genen (erna) som ska levereras3. Dessa begränsningar har lett till forskning och utveckling av alternativ, icke-viral leveransteknik.
Elektroporering, ett alternativ till virusmedierad genleverans, förlitar sig på tillämpningen av en optimal elektrisk pulsvågform för att utföra DNA-, RNA- och proteintransfektioner av celler. Efter appliceringen av ett externt elektriskt fält äventyras cellmembranet kort, vilket gör cellen mottaglig för intracellulär leverans av annars ogenomträngliga exogena material4. Jämfört med virusmedierad leverans är elektroporering fördelaktigt eftersom det i allmänhet är säkert, enkelt att använda och har låga driftskostnader. Elektroporering kan leverera både liten och stor molekylär last och kan vara effektiv vid transfektering av celler oavsett härstamning5. För att uppnå önskvärda resultat efter elektroporering, dvs. god livskraft och god elektrotransfektionseffektivitet, måste en mängd olika experimentella parametrar samoptimeras. Dessa inkluderar celltyp6, celltäthet, molekylkoncentration7, elektroporationsbuffertegenskaper (t.ex. molekylär sammansättning, konduktivitet och osmolaritet)8, elektrodstorlek / geometri9 och elektrisk pulsvågform (form, polaritet, antal pulser)10 (se figur 1 för en illustration). Även om var och en av dessa parametrar kan ha en signifikant effekt på resultaten av elektroporationsexperiment, har pulsvågform studerats särskilt i detalj, eftersom den elektriska energin hos den applicerade pulsen (erna) är roten till den inneboende avvägningen mellan den resulterande cellviabiliteten och elektrotransfektionseffektiviteten8.
Typiskt utförs elektroporationsexperiment på makroskalan, där celler suspenderas i 100-tals mikroliter buffert mellan en uppsättning stora parallellplattelektroder i en elektroporationskuvett. Elektroderna tillverkas vanligtvis av aluminium med ett elektrodavstånd på 1-4 mm. När cellerna har laddats manuellt via pipett är kyvetten elektriskt ansluten till en skrymmande, elektrisk pulsgenerator där användaren kan ställa in och tillämpa pulsvågformsparametrarna för att elektropolera cellsuspensionen. Även om makroskala eller bulkelektroporering kan bearbeta celldensiteter > 106 celler / ml, kan den här funktionen vara slösaktig när du optimerar inställningarna för elektrisk pulsvågform. Detta är särskilt oroande vid elektroporering av primära celltyper där cellpopulationsnumren kan begränsas. Dessutom, på grund av det stora avståndet mellan elektroderna, måste pulsgeneratorn kunna leverera stora spänningar för att uppnå elektriska fältstyrkor >1kV / cm11. Dessa höga spänningar orsakar resistiv effektavledning genom elektrolytbufferten vilket resulterar i Joule-uppvärmning, vilket kan vara skadligt för den resulterande cellviabiliteten12. Slutligen kommer utförande av elektroporering på en tät suspension av celler konsekvent att belastas med en medfödd variation i den resulterande elektrotransfektionseffektiviteten och cellviabiliteten. Varje cell i suspension kan uppleva en annan elektrisk fältstyrka på grund av de omgivande cellerna. Beroende på om den upplevda elektriska fältstyrkan antingen ökas eller minskas kan den resulterande cellviabiliteten eller elektrotransfektionseffektiviteten var och en påverkas negativt11. Dessa nackdelar med elektroporering i makroskala har lett till strävan efter och utveckling av alternativ teknik som fungerar på mikroskala och möjliggör bättre kontroll på encellsnivå.
Området BioMEMS, eller biomedicinska mikroelektromekaniska system, härrör från de tekniska framsteg som gjorts inom mikroelektronikindustrin. Specifikt att använda mikrofabrikationsprocesser för att utveckla mikroenheter för att främja biomedicinsk forskning. Dessa framsteg inkluderar utvecklingen av mikroelektrodmatriser för in vivo elektrisk övervakning 13, kapacitiva mikroelektroder för in situ-elektroporation14, miniatyriserade organ-on-a-chip-enheter 15, mikrofluidisk patientnära diagnostik 16, biosensorer 17 och läkemedelsleveranssystem 18, inklusive nano- och mikroelektroporationsanordningar 19,20,21 . På grund av förmågan att designa och tillverka enheter i samma storleksskala som biologiska celler är nano- och mikroelektroporationsteknik fördelaktig jämfört med deras makroskala motsvarighet22,23. Dessa elektroporationsanordningar eliminerar kravet på högspänningspulsapplikationer, eftersom elektroduppsättningar med avstånd på 10s till 100-tals mikrometer vanligtvis är integrerade. Denna funktion minskar drastiskt strömmen genom elektrolyten, vilket i sin tur minskar ackumuleringen av giftiga elektrolysprodukter och effekterna av Joule-uppvärmning i dessa system. Kanalerna i mikroskala säkerställer också att ett mycket mer enhetligt elektriskt fält appliceras tillförlitligt på cellerna under pulsapplikation, vilket resulterar i mer konsekventa resultat24. Dessutom är det också vanligt att mikroelektroporeringsanordningar integreras i en mikrofluidisk plattform som lämpar sig för framtida integration i en helautomatisk teknik, en mycket önskvärd kapacitet inom cellterapitillverkning25. Slutligen möjliggör elektroporering i mikroskala elektrisk förhör av elektroporationshändelser. Till exempel kan graden av cellmembranpermeabilisering övervakas i realtid vid en enda cellnivå26,27. Syftet med denna metod är att beskriva mikrofabrikation, systemdrift och analys av en mikrofluidisk, encellig mikroelektroporationsanordning som kan mäta graden av cellmembranpermeabilisering för optimering av elektroporationsprotokoll, men ändå öka genomströmningen jämfört med den tidigare state-of-the-art.
Att utföra elektroporering på encellsnivå är inte längre en ny teknik, som det först demonstrerades av Rubinsky et al. 2001 med utvecklingen av en statisk cellelektroporationsteknik28. Deras mikroenhet var innovativ eftersom de var de första som demonstrerade förmågan att elektriskt övervaka händelsen av elektroporation. Detta har ytterligare lett till utvecklingen av statiska, encelliga elektroporationstekniker som kan elektriskt detektera graden av cellmembranpermeabilisering på ett parallelliserat sätt för att öka enheternas genomströmning. Men även med parallellisering och batchbearbetning saknar dessa enheter allvarligt det totala antalet celler de kan bearbeta per tidsenhet29,30. Denna begränsning har lett till utvecklingen av genomströmningsanordningar som kan utföra mikroelektroporering på encellsnivå vid mycket större genomströmningar31. Denna enhetsövergång, från statisk till genomströmningsmiljö, begränsar förmågan att elektriskt övervaka graden av cellmembranpermeabilisering efter appliceringen av elektroporationspulsen. Metoden som beskrivs i detta arbete överbryggar klyftan mellan dessa två tekniker, en mikroelektroporeringsteknik som kan elektriskt detektera, pulsera och övervaka graden av cellmembranpermeabilisering av enskilda celler, på ett kontinuerligt flöde, seriellt sätt.
Denna teknik beskrevs nyligen i Zheng et al. I det arbetet introducerades funktionerna i denna teknik med slutförandet av en parametrisk studie, där både amplituden och varaktigheten av elektroporationspulsen varierade, och den efterföljande elektriska signalen, som indikerar cellmembranpermeabilisering, undersöktes32. Resultaten visade att en ökning av intensiteten hos elektroporationspulsen (dvs. ökning av applicerat elektriskt fält eller ökning av pulsvaraktigheten) orsakade en ökning av den uppmätta cellmembranpermeabiliseringen. För att ytterligare validera systemet tillsattes en gemensam fluorescerande indikator för framgångsrik elektroporering, propidiumjodid33, till cellsuspensionen och en fluorescensbild fångades omedelbart efter appliceringen av den elektriska pulsen. Den optiska signalen, dvs fluorescensintensiteten hos propidiumjodid inuti cellen, var starkt korrelerad med den elektriska mätningen av graden av cellmembranpermeabilisering, vilket verifierade tillförlitligheten hos denna elektriska mätning. Detta arbete övervägde emellertid endast leveransen av den lilla molekylen propidiumjodid, som har liten eller ingen översättningsbar betydelse.
I detta arbete introduceras en ny tillämpning av denna teknik för att förbättra systemets genomströmning samtidigt som man levererar en biologiskt aktiv plasmid-DNA (pDNA) -vektor och bedömer elektrotransfektionseffektiviteten hos celler som replateras och odlas efter elektroporering. Även om det tidigare arbetet överträffar befintliga mikroelektroporeringstekniker som kan mäta händelsen av elektroporering elektriskt, kräver enhetens nuvarande tillstånd fortfarande långa celltransittider mellan elektroduppsättningen (~ 250 ms) för att utföra celldetektering, pulsapplikation och cellmembranpermeabiliseringsmätning. Med en enda kanal begränsar detta dataflödet till 4 celler/s. För att bekämpa denna begränsning introduceras ett nytt koncept för cellpopulationsbaserad återkopplingsstyrd elektroporering för att utföra pDNA-elektrotransfektion. Genom att använda en hypofysiologisk konduktivitetselektroporationsbuffert möjliggör detta system elektrisk förhör av enskilda celler över en mängd elektroporationspulsapplikationer. Baserat på det elektriska svaret bestäms sedan en “optimal” elektroporationspuls. Ett “högkapacitetsläge” implementeras sedan där cellmembranets permeabiliseringsbestämning upphävs, flödeshastigheten ökas och elektroporationspulsens arbetscykel matchas med celltransittiden för att säkerställa en puls per cell i transit mellan elektroderna. Detta arbete kommer att ge omfattande detaljer om mikrofabrikationsstegen för tillverkning av mikroenheten, materialet / utrustningen och deras inställning som krävs för att utföra experimentet och driften / analysen av enheten och dess elektrotransfektionseffektivitet (eTE).
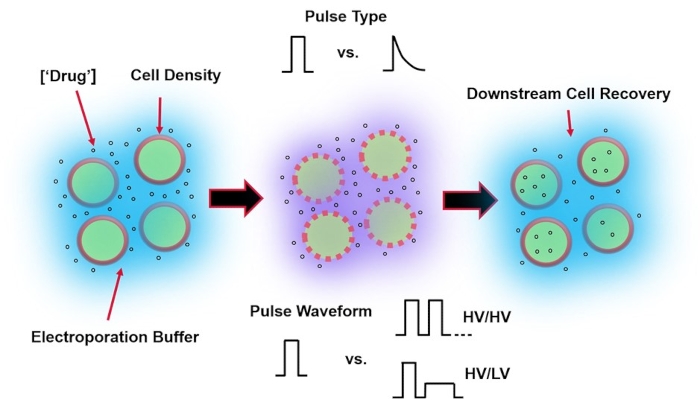
Figur 1: Experimentella faktorer som påverkar elektroporationsresultaten. (Vänster) Cellsuspension-Viktiga faktorer att tänka på innan elektroporationen börjar inkluderar: Nyttolast (i detta fall pDNA), koncentration, celltäthet och elektroporationsbuffertegenskaper. Elektroporationsbuffertegenskaper att tänka på är konduktivitet, osmolaritet och den exakta molekylära sammansättningen som bidrar till dessa värden. (Mitten) Pulsapplikation – Den exakta pulstypen (fyrkantig våg kontra exponentiellt sönderfall) och pulsvågform (enkelpuls kontra pulståg) måste optimeras för att maximera både den resulterande cellviabiliteten och elektrotransfektionseffektiviteten. Vanliga pulståg som implementeras i elektroporationsprocesser består vanligtvis av en serie högspänningspulser (HV) eller serier av pulser som roterar mellan HV och lågspänningspuls (LV). (Höger) Cell recovery-Down-stream bearbetningssteg, i synnerhet återhämtningscellodlingsmediet som celler överförs till, bör optimeras. Ej presenterad (längst till vänster) kan ytterligare uppströms cellbearbetningssteg implementeras för övergripande optimering av elektroporeringsprocessen. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Metoden som presenteras inom detta protokoll fokuserar främst på mikrofabrikation av en mikrofluidisk anordning som sedan integreras i en specialiserad elektroporationsexperimentell installation. Termen “recept”, som ofta används när man beskriver detaljerna i mikrofabrikationsprocessen, antyder vikten av att följa / optimera varje steg för att framgångsrikt tillverka en fungerande enhet. Vissa kritiska steg i processen, när de inte optimeras, såsom UV-exponeringstid / energi, PVD-sputtringshastigheter / varakti…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Författarna vill erkänna ekonomiskt stöd från National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) och US Department of Education’s Graduate Training in Emerging Areas of Precision and Personalized Medicine (P200A150131) för att finansiera doktorand JJS på stipendium.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

