Skalerbar isolering og oprensning af ekstracellulære vesikler fra Escherichia coli og andre bakterier
Summary
Bakterier udskiller ekstracellulære vesikler (EV’er) på størrelse med nanometer, der bærer bioaktive biologiske molekyler. EV-forskning fokuserer på at forstå deres biogenese, rolle i mikrobe-mikrobe og værtsmikrobe interaktioner og sygdom samt deres potentielle terapeutiske anvendelser. En arbejdsgang til skalerbar isolering af elbiler fra forskellige bakterier præsenteres for at lette standardisering af EV-forskning.
Abstract
Forskellige bakteriearter udskiller ~ 20-300 nm ekstracellulære vesikler (EV’er), der består af lipider, proteiner, nukleinsyrer, glycaner og andre molekyler afledt af forældrecellerne. Elbiler fungerer som kommunikationsvektorer inden for og mellem arter, samtidig med at de bidrager til interaktionen mellem bakterier og værtsorganismer i forbindelse med infektion og kolonisering. I betragtning af de mange funktioner, der tilskrives elbiler inden for sundhed og sygdom, er der en stigende interesse for at isolere elbiler til in vitro- og in vivo-undersøgelser. Det blev antaget, at adskillelsen af elbiler baseret på fysiske egenskaber, nemlig størrelse, ville lette isoleringen af vesikler fra forskellige bakteriekulturer.
Isolationsarbejdsgangen består af centrifugering, filtrering, ultrafiltrering og størrelsesekskluderingskromatografi (SEC) til isolering af elbiler fra bakteriekulturer. Et pumpedrevet tangentielt flowfiltreringstrin (TFF) blev inkorporeret for at forbedre skalerbarheden, hvilket muliggør isolering af materiale fra liter startcellekultur. Escherichia coli blev brugt som et modelsystem, der udtrykker EV-associeret nanoluciferase og ikke-EV-associeret mCherry som reporterproteiner. Nanoluciferase blev målrettet mod elbilerne ved at fusionere sin N-endestation med cytolysin A. Tidlige kromatografifraktioner indeholdende 20-100 nm elbiler med tilhørende cytolysin A – nanoLuc adskilte sig fra de senere fraktioner indeholdende de frie proteiner. Tilstedeværelsen af EV-associeret nanoluciferase blev bekræftet ved immunogold mærkning og transmission elektronmikroskopi. Denne EV-isolationsarbejdsgang gælder for andre humane tarmassocierede gramnegative og gram-positive bakteriearter. Afslutningsvis muliggør kombination af centrifugering, filtrering, ultrafiltrering / TFF og SEC skalerbar isolering af elbiler fra forskellige bakteriearter. Anvendelse af en standardiseret isolationsarbejdsgang vil lette sammenlignende undersøgelser af mikrobielle elbiler på tværs af arter.
Introduction
Ekstracellulære vesikler (EV’er) er nanometerstore, liposomlignende strukturer bestående af lipider, proteiner, glycaner og nukleinsyrer, udskilt af både prokaryote og eukaryote celler1. Siden de tidlige undersøgelser, der visualiserer frigivelsen af elbiler fra gramnegative bakterier2, er antallet af biologiske funktioner, der tilskrives bakterielle elbiler (20-300 nm i diameter) konstant vokset i de sidste årtier. Deres funktioner omfatter overførsel af antibiotikaresistens3, biofilmdannelse4, quorum sensing5 og toksinlevering6. Der er også stigende interesse for brugen af bakterielle elbiler som terapi, især i vaccinologi7 og kræftbehandling8.
På trods af den stigende interesse for ev-forskning er der stadig tekniske udfordringer med hensyn til isolationsmetoder. Specifikt er der behov for isoleringsmetoder, der er reproducerbare, skalerbare og kompatible med forskellige EV-producerende organismer. For at skabe et samlet sæt principper for planlægning og rapportering af EV-isolation og forskningsmetoder offentliggør og opdaterer International Society for Extracellular Vesicles MISEV-positionspapiret9. Desuden udgør EV-TRACK-konsortiet en åben platform for rapportering af detaljerede metoder til isolering af elektriske køretøjer, der anvendes i offentliggjorte manuskripter for at øge gennemsigtigheden10.
I denne protokol blev tidligere metoder, der blev anvendt til isolering af elektriske køretøjer fra pattedyrcellekultur, tilpasset11,12 for at muliggøre isolering af elektriske køretøjer fra bakteriecellekultur. Vi forsøgte at anvende metoder, der muliggør EV-isolering fra en række mikrober, som kan være skalerbare, og balancere EV-renhed og udbytte (som diskuteret i MISEV-positionspapiret9). Efter fjernelse af bakterieceller og snavs ved centrifugering og filtrering koncentreres kulturmediet enten ved centrifugalanordningens ultrafiltrering (for et volumen på op til ~ 100 ml) eller pumpedrevet TFF (for større volumener). Elbiler isoleres derefter af SEC ved hjælp af kolonner, der er optimeret til rensning af små elbiler.
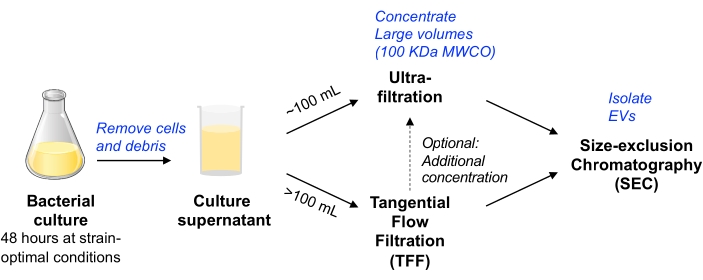
Figur 1: Skematisk oversigt over bakteriel ev-isoleringsarbejdsgang. Forkortelser: EV = ekstracellulær vesikel; TFF = filtrering af tangentiel strøm; SEC = størrelsesekskluderingskromatografi; MWCO = afskæring af molekylvægt. Klik her for at se en større version af denne figur.
En muse-kommensal stamme af Escherichia coli (dvs. E. coli MP113) blev anvendt som en modelorganisme og modificeret til at udtrykke EV-associeret nanoluciferase ved fusion til cytolysin A, som tidligere rapporteret14. De metoder, der anvendes her, kan behandle mindst op til flere liter bakteriekulturer og effektivt adskille EV-associerede fra ikke-EV-associerede proteiner. Endelig kan denne metode også bruges til andre gram-positive og gram-negative bakteriearter. Alle relevante data fra de rapporterede eksperimenter blev indsendt til EV-TRACK-videnbasen (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
I protokollen ovenfor beskrives en metode, der er skalerbar og pålideligt isolerer elbiler fra forskellige gramnegative / positive og aerobe / anaerobe bakterier. Det har flere potentielle stoppunkter under hele proceduren, selvom det er bedre at undgå at tage længere tid end 48 timer at isolere elbiler fra konditionerede bakteriekulturmedier.
For det første består det af dyrkning af bakterier for at generere betinget bakteriekulturmedium. Det blev konstateret, at forøgelse af kulturtide…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Den ovenfor beskrevne forskning blev støttet af NIH TL1 TR002549-03 uddannelsesstøtte. Vi takker Dr. John C. Tilton og Zachary Troyer (Case Western Reserve University) for at lette adgangen til partikelstørrelsesanalysatorinstrumentet; Lew Brown (Spectradyne) for teknisk bistand med analyse af partikelstørrelsesfordelingsdata; Dr. David Putnam ved Cornell University for at levere pClyA-GFP plasmid14; og Dr. Mark Goulian ved University of Pennsylvania for at have forsynet os med E. coli MP113.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

