התאוששות שמן משופרת באמצעות שילוב של חומרים ביולוגיים
Summary
אנו ממחישים את השיטות המעורבות בסינון ובזיהוי של המיקרובים המייצרים את ה-biosurfactant. כמו כן, מוצגות שיטות לאפיון כרומטוגרפי וזיהוי כימי של החומרים הביולוגיים, הקובעים את הישימות התעשייתית של החומר הביולוגי להגברת התאוששות שאריות השמן.
Abstract
חומרים ביולוגיים הם תרכובות פעילות על פני השטח המסוגלות להפחית את מתח הפנים בין שני שלבים של קיטובים שונים. חומרים ביולוגיים התגלו כחלופות מבטיחות לחומרים פעילי שטח כימיים בשל פחות רעילות, התמקרות ביולוגית גבוהה, תאימות סביבתית ועמידות לתנאי סביבה קיצוניים. כאן אנו ממחישים את השיטות המשמשות לסינון של מיקרובים המסוגלים לייצר חומרים ביולוגיים. המיקרובים המייצרים חומרים ביולוגיים זוהו באמצעות קריסת טיפה, התפשטות נפט ובדיקות אינדקס תחליב. ייצור חומרים ביולוגיים אומת על ידי קביעת הירידה במתח הפנים של המדיה עקב צמיחתם של החברים המיקרוביאליים. כמו כן, אנו מתארים את השיטות הכרוכות באפיון וזיהוי של חומרים ביולוגיים. כרומטוגרפיית שכבה דקה של הביו-סראנקט שחולץ ואחריה צביעה דיפרנציאלית של הלוחות בוצעה כדי לקבוע את אופיו של הביו-surfactant. LCMS, 1H NMR ו-FT-IR שימשו לזיהוי כימי של החומר הביולוגי. אנו ממחישים עוד יותר את השיטות להערכת היישום של שילוב של חומרים ביולוגיים המיוצרים לשיפור התאוששות שאריות שמן בעמודת חבילת חול מדומה.
Introduction
חומרים ביולוגיים הם המולקולות האמפיפתיות הפעילות על פני השטח המיוצרות על ידי מיקרואורגניזמים שיש להם את היכולת להפחית את פני השטח ואת המתח הבין-פאזי בין שני שלבים1. חומר ביולוגי טיפוסי מכיל חלק הידרופילי המורכב בדרך כלל ממואטי סוכר או משרשרת פפטידית או חומצת אמינו הידרופילית וחלק הידרופובי המורכב משרשרת חומצות שומן רוויות או בלתי רוויות2. בשל אופיים האמפיפתי, חומרים ביולוגיים מתאספים בממשק שבין שני השלבים ומפחיתים את המתח הבין-פאזי בגבול, מה שמקל על פיזור של שלב אחד לתוך 1,3 השני. סוגים שונים של חומרים ביולוגיים שדווחו עד כה כוללים גליקוליפידים שבהם פחמימות קשורות לחומצות אליפטיות ארוכות שרשרת או הידרוקסי-אליפטיות באמצעות קשרי אסטר (למשל, רמנוליפידים, טרהלולפידים וסופורולפידים), ליפוזיטים שבהם שומנים מחוברים לשרשראות פוליפפטידים (למשל, סרפקטין וליז’ניזין), וחומרים ביולוגיים פולימריים המורכבים בדרך כלל מקומפלקסים של חלבונים פוליסכרידים (למשל, תחליב, ליפוזן, אלאסן וליפומנאן)4. סוגים אחרים של חומרים ביולוגיים המיוצרים על ידי המיקרואורגניזמים כוללים חומצות שומן, פוספוליפידים, שומנים ניטרליים, וחומרים ביולוגיים חלקיקיים5. הקבוצה הנחקרת ביותר של חומרים ביולוגיים היא גליקוליפידים וביניהם רוב המחקרים דווחו על ראמנוליפידים6. ראמנוליפידים מכילים מולקולות אחת או שתיים של ראמנוז (היוצרות את החלק ההידרופילי) הקשורות למולקולה אחת או שתיים של חומצת שומן ארוכת שרשרת (בדרך כלל חומצה הידרוקסי-דקנואית). רמנוליפידים הם גליקוליפידים ראשוניים שדווחו לראשונה מ-Pseudomonas aeruginosa7.
חומרים ביולוגיים צוברים מיקוד הולך וגובר בהשוואה למקבילותיהם הכימיות בשל תכונות ייחודיות וייחודיות שונות שהם מציעים8. אלה כוללים ספציפיות גבוהה יותר, רעילות נמוכה יותר, מגוון גדול יותר, קלות הכנה, התמקרות ביולוגית גבוהה יותר, קצף טוב יותר, תאימות סביבתית ופעילות בתנאים קיצוניים9. המגוון המבני של החומרים הביולוגיים (איור S1) הוא יתרון נוסף שנותן להם יתרון על פני המקבילים הכימיים10. הם בדרך כלל יעילים ויעילים יותר בריכוזים נמוכים יותר מכיוון שריכוז המיסל הקריטי שלהם (CMC) בדרך כלל נמוך פי כמה מאשר חומרים פעילי שטח כימיים11. הם דווחו כעמידים מאוד לתרמוסקולר (עד 100 מעלות צלזיוס) ויכולים לסבול pH גבוה יותר (עד 9) וריכוזי מלח גבוהים (עד 50 גרם לליטר)12 ובכך מציעים מספר יתרונות בתהליכים תעשייתיים, הדורשים חשיפה לתנאים קיצוניים13. התמקרות ביולוגית ורעילות נמוכה יותר הופכות אותם למתאימים ליישומים סביבתיים כגון bioremediation. בגלל היתרונות שהם מציעים, הם מקבלים תשומת לב מוגברת בענפים שונים כמו מזון, חקלאות, חומרי ניקוי, קוסמטיקה ותעשיית הנפט11. גם חומרים ביולוגיים זכו לתשומת לב רבה בתיקון נפט להסרת מזהמי נפט ומזהמים רעילים14.
כאן אנו מדווחים על הייצור, האפיון והיישום של חומרים ביולוגיים המיוצרים על ידי Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104, ו – Paenibacillus sp. IITD108. השלבים המעורבים בסינון, אפיון ויישום של שילוב של חומרים ביולוגיים להתאוששות משופרת של שמן מתוארים באיור 1.
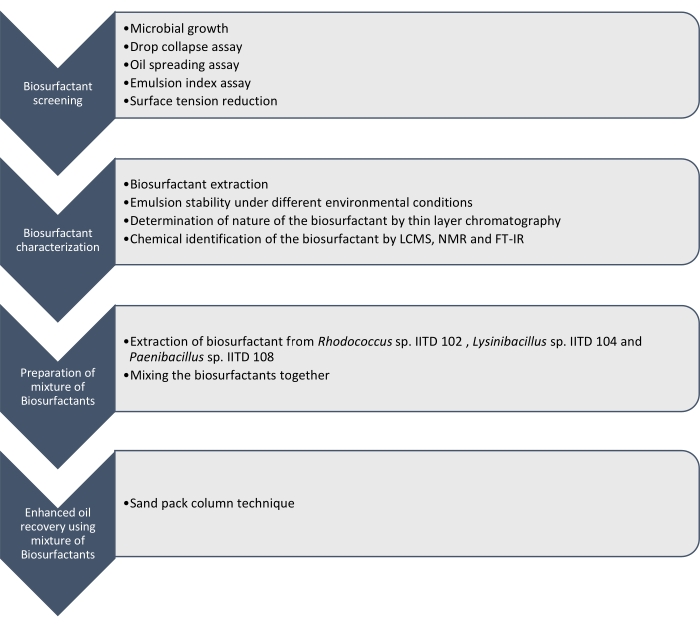
איור 1: שיטה להתאוששות שמן משופרת באמצעות שילוב של חומרים ביולוגיים. זרימת העבודה המדורגת מוצגת. העבודה בוצעה בארבעה שלבים. ראשית, הזנים המיקרוביאליים עברו תרבית וסוננו לייצור חומרים ביולוגיים על ידי בדיקות שונות, שכללו בדיקת קריסת טיפה, בדיקת התפשטות שמן, בדיקת מדד תחליב ומדידת מתח פני השטח. לאחר מכן, החומרים הביולוגיים הוצאו מהמרק נטול התאים ואופיים זוהה באמצעות כרומטוגרפיית שכבה דקה והם זוהו עוד יותר באמצעות LCMS, NMR ו-FT-IR. בשלב הבא, החומרים הביולוגיים המופקים היו מעורבבים יחד והפוטנציאל של התערובת שנוצרה להתאוששות שמן משופרת נקבע באמצעות טכניקת עמודי חבילת החול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הקרנה של זנים מיקרוביאליים אלה לייצור חומרים ביולוגיים נעשתה על ידי קריסת טיפה, התפשטות שמן, בדיקת מדד תחליב וקביעת הפחתה במתח הפנים של המדיום נטול התאים עקב צמיחת המיקרובים. החומרים הביולוגיים הופקו, אופיינו וזוהו כימית על ידי LCMS, 1H NMR ו-FT-IR. לבסוף, הוכנה תערובת של חומרים ביולוגיים המיוצרים על ידי מיקרובים אלה, והיא שימשה לשחזור שאריות השמן בעמודה מדומה של חבילת חול.
המחקר הנוכחי רק ממחיש את השיטות המעורבות בסינון, זיהוי, אפיון מבני ויישום של שילוב הביו-surfactant לשיפור התאוששות השמן השיורי. הוא אינו מספק אפיון פונקציונלי מפורט של החומרים הביולוגיים המיוצרים על ידי הזנים המיקרוביאליים15,16. ניסויים שונים כגון קביעת מיקל קריטי, אנליזה תרמוגרווימטרית, רטיבות פני השטח והתכלות ביולוגית מבוצעים לאפיון פונקציונלי מפורט של כל חומר ביולוגי. אך מכיוון שמאמר זה הוא נייר שיטות, ההתמקדות היא בסינון, זיהוי, אפיון מבני ויישום של שילוב הביו-surfactant בשיפור התאוששות הנפט השיורי; ניסויים אלה לא נכללו במחקר זה.
Protocol
Representative Results
Discussion
חומרים ביולוגיים הם אחת הקבוצות המגוונות ביותר של רכיבים פעילים ביולוגית שהופכים לחלופות אטרקטיביות לחומרים פעילי שטח כימיים. יש להם מגוון רחב של יישומים בתעשיות רבות כגון חומרי ניקוי, צבעים, קוסמטיקה, מזון, תרופות, חקלאות, נפט וטיפול במים בשל יציבותם הטובה יותר, CMC נמוך יותר, מבנה מגוון וי…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להודות למחלקה לביוטכנולוגיה, ממשלת הודו, על התמיכה הכספית.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
References
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

