Повышение нефтеотдачи с использованием комбинации биоповерхностных веществ
Summary
Мы иллюстрируем методы, связанные с скринингом и идентификацией микробов, продуцирующих биоповерхностные вещества. Также представлены методы хроматографической характеризации и химической идентификации биоповерхностных веществ, определяющие промышленную применимость биоповерхностного вещества в повышении остаточного нефтеотдачи.
Abstract
Биосурфактанты представляют собой поверхностно-активные соединения, способные снижать поверхностное натяжение между двумя фазами разной полярности. Биозащитные вещества становятся многообещающими альтернативами химическим поверхностно-активным веществам из-за меньшей токсичности, высокой биоразлагаемости, экологической совместимости и устойчивости к экстремальным условиям окружающей среды. Здесь мы иллюстрируем методы, используемые для скрининга микробов, способных производить биоповерхностные вещества. Микробы, производящие биоповерхност, были идентифицированы с использованием анализа капельного коллапса, разбрасывания нефти и индекса эмульсии. Производство биоповерхностного вещества было подтверждено путем определения снижения поверхностного натяжения среды из-за роста микробных членов. Мы также описываем методы, связанные с характеристикой и идентификацией биоповерхностных веществ. Тонкослойную хроматографию экстрагированного биоповерхностного вещества с последующим дифференциальным окрашиванием пластин проводили для определения природы биоповерхностного вещества. LCMS, 1H ЯМР и FT-IR использовались для химической идентификации биоповерхностного вещества. Далее мы иллюстрируем методы оценки применения комбинации полученных биотвердых веществ для повышения остаточного нефтеотдачи в моделируемой колонне пескоструйной пачки.
Introduction
Биоповерхностные вещества представляют собой амфипатические поверхностно-активные молекулы, продуцируемые микроорганизмами, которые обладают способностью уменьшать поверхность и межфазное натяжение между двумя фазами1. Типичный биотвердовой фактор содержит гидрофильную часть, которая обычно состоит из фрагмента сахара или пептидной цепи или гидрофильной аминокислоты и гидрофобной части, которая состоит из насыщенной или ненасыщенной цепи жирных кислот2. Из-за своей амфипатической природы биоповерхностные вещества собираются на границе раздела между двумя фазами и уменьшают межфазное напряжение на границе, что облегчает диспергирование одной фазы в другую 1,3. Различные типы биозащищенных веществ, о которых сообщалось до настоящего времени, включают гликолипиды, в которых углеводы связаны с длинноцепочечными алифатическими или гидроксиалифатическими кислотами через эфирные связи (например, рамнолипиды, трегалолипиды и софоролипиды), липопептиды, в которых липиды прикреплены к полипептидным цепям (например, сурфактин и лихенизин), и полимерные биозащитные вещества, которые обычно состоят из полисахарид-белковых комплексов (например, эмульсан, липосан, аласан и липоманнан)4. Другие типы биозащищенных веществ, продуцируемых микроорганизмами, включают жирные кислоты, фосфолипиды, нейтральные липиды и биоповерхностные частицы5. Наиболее изученным классом биоповерхностных веществ являются гликолипиды, и среди них большинство исследований было зарегистрировано на рамнолипидах6. Рамнолипиды содержат одну или две молекулы рамнозы (которые образуют гидрофильную часть), связанные с одной или двумя молекулами длинноцепочечной жирной кислоты (обычно гидрокси-декановой кислоты). Рамнолипиды являются первичными гликолипидами, о которых впервые сообщалось из Pseudomonas aeruginosa7.
Биоповерхностные вещества приобретают все большее внимание по сравнению со своими химическими аналогами из-за различных уникальных и отличительных свойств, которые они предлагают8. К ним относятся более высокая специфичность, более низкая токсичность, большее разнообразие, простота приготовления, более высокая биоразлагаемость, лучшее пенообразование, экологическая совместимость и активность в экстремальных условиях9. Структурное разнообразие биоповерхностных веществ (рисунок S1) является еще одним преимуществом, которое дает им преимущество перед химическими аналогами10. Они, как правило, более эффективны и действенны при более низких концентрациях, поскольку их критическая концентрация мицелл (CMC) обычно в несколько раз ниже, чем у химических поверхностно-активных веществ11. Сообщалось, что они обладают высокой термостабильностью (до 100 °C) и могут переносить более высокий рН (до 9) и высокие концентрации соли (до 50 г/л)12 , тем самым обеспечивая ряд преимуществ в промышленных процессах, которые требуют воздействия экстремальных условий13. Биоразлагаемость и более низкая токсичность делают их пригодными для экологических применений, таких как биоремедиация. Из-за преимуществ, которые они предлагают, они получают повышенное внимание в различных отраслях промышленности, таких как пищевая, сельскохозяйственная, моющая, косметическая и нефтяная промышленность11. Биозащищенные вещества также привлекли большое внимание в рекультивации нефти для удаления нефтяных загрязнителей и токсичных загрязнителей14.
Здесь мы сообщаем о производстве, характеристике и применении биоповерхностных веществ, полученных Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 и Paenibacillus sp. IITD108. Этапы, связанные с скринингом, определением характеристик и применением комбинации биоповерхностных веществ для повышения нефтеотдачи, описаны на рисунке 1.
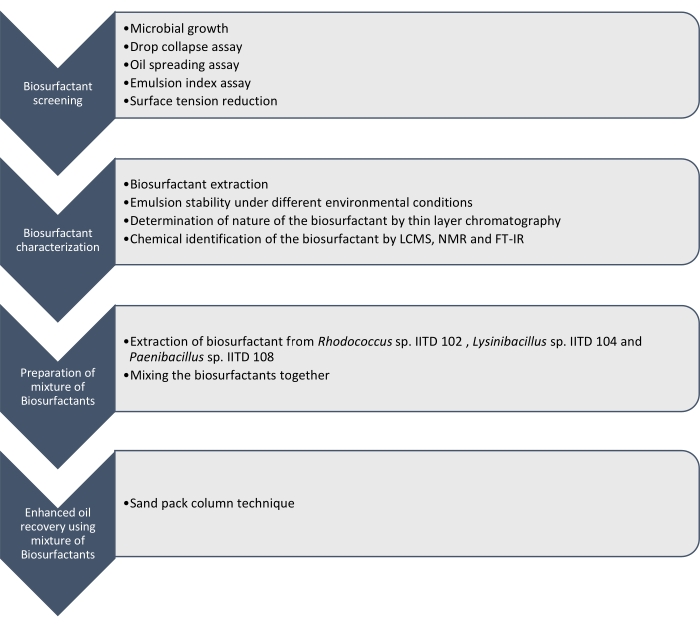
Рисунок 1: Метод повышения нефтеотдачи пластов с использованием комбинации биоповерхностно-активных веществ. Показан пошаговый рабочий процесс. Работа велась в четыре этапа. Сначала микробные штаммы культивировали и просеивали для производства биоповерхностного вещества различными анализами, которые включали анализ на падение коллапса, анализ разбрасывания масла, анализ индекса эмульсии и измерение поверхностного натяжения. Затем биоповерхностные вещества были извлечены из бесклеточного бульона, и их природа была идентифицирована с помощью тонкослойной хроматографии, и они были дополнительно идентифицированы с использованием LCMS, ЯМР и FT-IR. На следующем этапе извлеченные биоповерхностные вещества смешивали вместе, и потенциал полученной смеси для повышения нефтеотдачи был определен с использованием метода колонной пескоструйной упаковки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Скрининг этих микробных штаммов для получения биоповерхностных веществ проводился путем коллапса капель, разбрасывания масла, анализа индекса эмульсии и определения снижения поверхностного натяжения бесклеточной среды за счет роста микробов. Биоповерхностные вещества были извлечены, охарактеризованы и химически идентифицированы С помощью LCMS, 1H ЯМР и FT-IR. Наконец, смесь биоповерхностных веществ, полученных этими микробами, была приготовлена и использована для извлечения остаточной нефти в смоделированной колонне песчаной пачки.
Настоящее исследование лишь иллюстрирует методы, связанные с скринингом, идентификацией, структурной характеристикой и применением комбинации биоповерхностных веществ для повышения остаточного нефтеотдачи. Он не дает подробной функциональной характеристики биоповерхностных веществ, продуцируемых микробными штаммами15,16. Различные эксперименты, такие как определение критических мицелл, термогравиметрический анализ, смачиваемость поверхности и биоразлагаемость, выполняются для детальной функциональной характеристики любого биоповерхностного вещества. Но поскольку этот документ является методологическим документом, основное внимание уделяется скринингу, идентификации, структурной характеристике и применению комбинации биоповерхностных веществ для повышения остаточного нефтеотдачи; эти эксперименты не были включены в данное исследование.
Protocol
Representative Results
Discussion
Биоповерхностные вещества являются одной из наиболее универсальных групп биологически активных компонентов, которые становятся привлекательными альтернативами химическим поверхностно-активным веществам. Они имеют широкий спектр применения во многих отраслях промышленности, таки?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить Департамент биотехнологии правительства Индии за финансовую поддержку.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
References
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

