सेलुलर चयापचय का मूल्यांकन करने के लिए Autofluorescence इमेजिंग
Summary
यह प्रोटोकॉल प्रतिदीप्ति इमेजिंग और अंतर्जात चयापचय coenzymes के विश्लेषण का वर्णन करता है, निकोटीनामाइड adenine (फॉस्फेट) डाइन्यूक्लियोटाइड (NAD (P)H) को कम करता है, और ऑक्सीकृत फ्लेविन एडेनिन डाइन्यूक्लियोटाइड (FAD)। एनएडी (पी) एच और एफएडी की ऑटोफ्लोरेसेंस इमेजिंग सेलुलर चयापचय का आकलन करने के लिए एक लेबल-मुक्त, गैर-विनाशकारी विधि प्रदान करती है।
Abstract
सेलुलर चयापचय वह प्रक्रिया है जिसके द्वारा कोशिकाएं ऊर्जा उत्पन्न करती हैं, और कैंसर सहित कई बीमारियों को असामान्य चयापचय की विशेषता है। कम निकोटिनामाइड एडेनिन (फॉस्फेट) डाइन्यूक्लियोटाइड (एनएडी (पी) एच) और ऑक्सीकृत फ्लेविन एडेनिन डाइन्यूक्लियोटाइड (एफएडी) चयापचय प्रतिक्रियाओं के कोएंजाइम हैं। एनएडी (पी) एच और एफएडी ऑटोफ्लोरेसेंस प्रदर्शित करते हैं और उत्तेजना और उत्सर्जन तरंग दैर्ध्य द्वारा वर्णक्रमीय रूप से अलग किया जा सकता है। दोनों coenzymes, NAD (P)H और FAD, या तो एक मुक्त या प्रोटीन-बाउंड कॉन्फ़िगरेशन में मौजूद हो सकते हैं, जिनमें से प्रत्येक में एक अलग प्रतिदीप्ति जीवनकाल होता है- वह समय जिसके लिए फ्लोरोफोर उत्साहित अवस्था में रहता है। प्रतिदीप्ति जीवनकाल इमेजिंग (एफएलआईएम) सेलुलर चयापचय के लेबल-मुक्त विश्लेषण के लिए एनएडी (पी) एच और एफएडी के प्रतिदीप्ति तीव्रता और जीवनकाल के परिमाणीकरण की अनुमति देता है। प्रतिदीप्ति तीव्रता और जीवनभर माइक्रोस्कोप उचित उत्तेजना और उत्सर्जन तरंग दैर्ध्य का चयन करके इमेजिंग एनएडी (पी) एच और एफएडी के लिए अनुकूलित किया जा सकता है। साइनाइड द्वारा चयापचय संबंधी गड़बड़ी कोशिकाओं के भीतर चयापचय परिवर्तनों का पता लगाने के लिए ऑटोफ्लोरेसेंस इमेजिंग प्रोटोकॉल को सत्यापित करती है। यह लेख सेलुलर चयापचय को मापने के लिए एनएडी (पी) एच और एफएडी के ऑटोफ्लोरेसेंस इमेजिंग की तकनीक का प्रदर्शन करेगा।
Introduction
चयापचय ऊर्जा के उत्पादन की सेलुलर प्रक्रिया है। सेलुलर चयापचय में ग्लाइकोलाइसिस, ऑक्सीडेटिव फॉस्फोराइलेशन और ग्लूटामिनोलिसिस सहित कई मार्ग शामिल हैं। स्वस्थ कोशिकाएं प्रसार और कार्य के लिए ऊर्जा उत्पन्न करने के लिए इन चयापचय मार्गों का उपयोग करती हैं, जैसे कि प्रतिरक्षा कोशिकाओं द्वारा साइटोकिन्स का उत्पादन। चयापचय विकारों, कैंसर और न्यूरोडीजेनेरेशन सहित कई बीमारियों को परिवर्तित सेलुलर चयापचय 1 की विशेषता है। उदाहरण के लिए, कुछ कैंसर सेल प्रकारों में ग्लाइकोलाइसिस की उच्च दर होती है, यहां तक कि ऑक्सीजन की उपस्थिति में भी, न्यूक्लिक एसिड, प्रोटीन और लिपिड के संश्लेषण के लिए अणु उत्पन्न करने के लिए 2,3। यह घटना, जिसे वारबर्ग प्रभाव के रूप में जाना जाता है, स्तन कैंसर, फेफड़ों के कैंसर और ग्लियोब्लास्टोमास 4 सहित कई कैंसर प्रकारों की एक पहचान है। कैंसर की प्रगति से जुड़े सेलुलर चयापचय के परिवर्तन के कारण, सेलुलर चयापचय दवा प्रतिक्रिया 5,6 के लिए एक सरोगेट बायोमार्कर हो सकता है। इसके अलावा, एक सेलुलर स्तर पर दवा प्रभावकारिता को समझना महत्वपूर्ण है क्योंकि सेल विषमता व्यक्तियों में अलग-अलग दवा प्रतिक्रियाओं का कारण बन सकती है7,8।
सेलुलर चयापचय में परिवर्तन की पहचान और मात्रा निर्धारित करने वाली प्रौद्योगिकियां कैंसर और दवा प्रतिक्रिया के अध्ययन के लिए आवश्यक हैं। रासायनिक और प्रोटीन विश्लेषण का उपयोग कोशिकाओं या ऊतकों के चयापचय का मूल्यांकन करने के लिए किया जाता है लेकिन एकल-कोशिका रिज़ॉल्यूशन और स्थानिक जानकारी की कमी होती है। मेटाबोलिक प्लेट रीडर-आधारित assays समय के साथ नमूने में पीएच और ऑक्सीजन की खपत और रसायनों द्वारा बाद के चयापचय गड़बड़ी को माप सकते हैं। पीएच का उपयोग बाह्य कोशिकीय अम्लीकरण दर (ईसीएआर) की गणना करने के लिए किया जा सकता है, जो कोशिकाओं की ग्लाइकोलाइटिक गतिविधि में एक अंतर्दृष्टि प्रदान करता है। पूरे शरीर इमेजिंग विधियां, जिनमें 2-[फ्लोरीन -18] फ्लोरो-डी-ग्लूकोज पॉज़िट्रॉन उत्सर्जन टोमोग्राफी (FDG PET) और चुंबकीय अनुनाद स्पेक्ट्रोस्कोपी (MRS) शामिल हैं, गैर-आक्रामक इमेजिंग तरीके हैं जिनका उपयोग चयापचय माप 10,11,12,13,14 के माध्यम से ट्यूमर पुनरावृत्ति और दवा प्रभावकारिता की पहचान करने के लिए नैदानिक रूप से किया जाता है।
FDG-PET छवियों FDG, एक radiolabled ग्लूकोज एनालॉग के ऊतक अपटेक. आसपास के ऊतकों के सापेक्ष ट्यूमर द्वारा FDG-PET की वृद्धि वारबर्ग प्रभाव 12,13 के कारण है। एमआरएस चयापचय के लिए उपयोग किए जाने वाले अणुओं के सामान्य नाभिक को दर्शाता है, जैसे कि 13 सी और 31 पी, और इस बारे में गतिशील जानकारी प्राप्त कर सकता है कि चयापचय उत्तेजनाओं के जवाब में कैसे बदलता है, जैसे व्यायाम या खाने 14। हालांकि FDG-PET और MRS का उपयोग नैदानिक रूप से किया जा सकता है, इन प्रौद्योगिकियों में intratumoral विषमता को हल करने के लिए स्थानिक संकल्प की कमी है। इसी तरह, ऑक्सीजन की खपत माप कोशिकाओं की थोक आबादी पर की जाती है। Autofluorescence इमेजिंग इन प्रौद्योगिकियों की स्थानिक संकल्प बाधा को दूर करता है और सेलुलर चयापचय को मापने की एक noninvasive विधि प्रदान करता है।
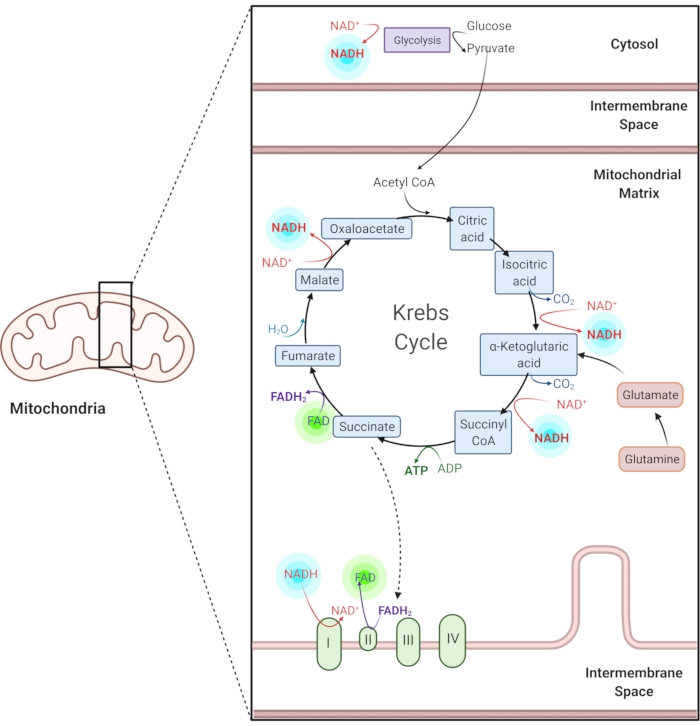
चित्रा 1: सामान्य चयापचय मार्गों में एनएडीएच और एफएडी। NADH और FAD ग्लाइकोलाइसिस, क्रेब्स चक्र और इलेक्ट्रॉन परिवहन श्रृंखला में उपयोग किए जाने वाले कोएंजाइम हैं। इन अणुओं की ऑटोफ्लोरेसेंस इमेजिंग सेलुलर चयापचय के बारे में जानकारी प्रदान करती है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
कम निकोटिनामाइड एडेनिन (फॉस्फेट) डाइन्यूक्लियोटाइड (एनएडी (पी) एच) और ऑक्सीकृत फ्लेविन एडेनिन डाइन्यूक्लियोटाइड (एफएडी) चयापचय प्रतिक्रियाओं के कोएंजाइम हैं, जिनमें ग्लाइकोलाइसिस, ऑक्सीडेटिव फॉस्फोराइलेशन और ग्लूटामिनोलिसिस (चित्रा 1) शामिल हैं। एनएडी (पी) एच और एफएडी दोनों ऑटोफ्लोरोसेंट हैं और प्रतिदीप्ति इमेजिंग 1,15 के लिए अंतर्जात विपरीत प्रदान करते हैं। NADPH में NADH के समान फ्लोरोसेंट गुण होते हैं। इस वजह से, एनएडी (पी) एच का उपयोग अक्सर एनएडीएच और एनएडीपीएच 2, 16 के संयुक्त संकेत का प्रतिनिधित्व करने के लिए किया जाता है।
प्रतिदीप्ति जीवनकाल इमेजिंग (एफएलआईएम) प्रतिदीप्ति जीवनकाल या उस समय को निर्धारित करता है जिसके लिए एक फ्लोरोफोर उत्साहित अवस्था में होता है। प्रतिदीप्ति जीवनकाल फ्लोरोफोर के माइक्रोएन्वायरमेंट के लिए उत्तरदायी होते हैं और सेलुलर चयापचय 17 के बारे में जानकारी प्रदान करते हैं। एनएडी (पी) एच और एफएडी या तो प्रोटीन-बाउंड या मुक्त संरचनाओं में कोशिकाओं के भीतर मौजूद हो सकते हैं, जिनमें से प्रत्येक का एक अलग जीवनकाल होता है। नि: शुल्क एनएडी (पी) एच प्रोटीन-बाउंड एनएडी (पी) एच की तुलना में कम जीवनकाल है; इसके विपरीत, मुक्त FAD बाध्य FAD18,19 की तुलना में एक लंबा जीवनकाल है। जीवनकाल और जीवनकाल घटक वजन Eq. (1) 20 के माध्यम से प्रतिदीप्ति जीवनकाल क्षय डेटा से परिमाणित किया जा सकता है:
I(t) = α 1e-t/π1 + α 2e-t/π2 + C (1)
Eq (1) समय के एक समारोह के रूप में सामान्यीकृत प्रतिदीप्ति तीव्रता का प्रतिनिधित्व करता है। इस समीकरण में α 1 और α 2 छोटे और लंबे जीवनकाल (α 1 + α 2 = 1) के आनुपातिक घटकों का प्रतिनिधित्व करते हैं, क्रमशः, π1 और π2 क्रमशः छोटे और लंबे जीवनकाल का प्रतिनिधित्व करते हैं, और सी पृष्ठभूमि light7,20 के लिए खाते हैं। आयाम-भारित जीवनकाल, जिसे यहां πm के रूप में दर्शाया गया है, की गणना Eq. (2) का उपयोग करके की जाती है।
πm= α 1π1+ α 2π2 (2)
फ्लोरोफोर की तीव्रता क्षय पर “टी” के औसत से एक औसत जीवनकाल की गणना की जा सकती है, जो दो-घातीय क्षय के लिए Eq. (3) 17,21 द्वारा दिखाया गया है।
π*m= (α 1π12+ α 2π22)/ (α 1π1+ α 2π2) (3)
प्रतिदीप्ति जीवनकाल क्षय को एकीकृत करके एक प्रतिदीप्ति तीव्रता छवि को जीवनकाल छवि से परिकलित किया जा सकता है। Autofluorescence इमेजिंग एक nondestructive और लेबल मुक्त विधि है कि एक उपकोशिकीय संकल्प पर जीवित कोशिकाओं के चयापचय को चिह्नित करने के लिए इस्तेमाल किया जा सकता है। ऑप्टिकल रेडॉक्स अनुपात सेल के रासायनिक रेडॉक्स राज्य का एक ऑप्टिकल एनालॉग मीट्रिक प्रदान करता है और इसकी गणना एनएडी (पी) एच और एफएडी तीव्रता के अनुपात के रूप में की जाती है। यद्यपि ऑप्टिकल रेडॉक्स अनुपात की गणना करने का सूत्र मानकीकृत नहीं है22,23,24,25, इसे यहां एनएडी (पी) एच और एफएडी की संयुक्त तीव्रता पर एफएडी की तीव्रता के रूप में परिभाषित किया गया है। इस परिभाषा का उपयोग इसलिए किया जाता है क्योंकि हर में अभिव्यक्त तीव्रता 0 और 1 के बीच मीट्रिक को सामान्य करती है, और साइनाइड निषेध का अपेक्षित परिणाम रेडॉक्स अनुपात में कमी है। मुक्त एनएडी (पी) एच और एफएडी के प्रतिदीप्ति जीवनकाल चयापचय विलायक माइक्रोएन्वायरमेंट में परिवर्तन में अंतर्दृष्टि प्रदान करते हैं, जिसमें पीएच, तापमान, ऑक्सीजन की निकटता और ऑस्मोलेरिटी 17 शामिल हैं।
एनएडी (पी) एच और एफएडी के बाध्य अंशों के प्रतिदीप्ति जीवनकाल में परिवर्तन चयापचय मार्ग उपयोग और सब्सट्रेट-विशिष्ट चयापचय 26 का संकेत दे सकते हैं। घटक भार coenzymes18,19 के बाध्य अंश के लिए मुक्त में परिवर्तन के लिए व्याख्या की जा सकती है। कुल मिलाकर, ये मात्रात्मक autofluorescence जीवनकाल मैट्रिक्स सेलुलर चयापचय के विश्लेषण की अनुमति देते हैं, और autofluorescence इमेजिंग का उपयोग सामान्य ऊतकों से नियोप्लाज्म की पहचान करने के लिए किया गया है27,28, स्टेम कोशिकाओं की विशेषता 29,30, प्रतिरक्षा सेल फ़ंक्शन का मूल्यांकन 31,32,33,34,35, न्यूरोलॉजिकल गतिविधि का आकलन करना36, 37,38, और स्तन कैंसर और सिर और गर्दन के कैंसर जैसे कैंसर के प्रकारों में दवा की प्रभावकारिता को समझना21,39,40,41,42। उच्च-रिज़ॉल्यूशन ऑटोफ्लोरेसेंस इमेजिंग को एकल-सेल विश्लेषण के लिए छवि विभाजन और इंट्रापॉपुलेशन विषमता 43,44,45,46,47 के परिमाणीकरण के साथ जोड़ा जा सकता है।
एनएडी (पी) एच और एफएडी को एकल-फोटॉन या मल्टीफोटॉन प्रतिदीप्ति माइक्रोस्कोप पर चित्रित किया जा सकता है जो तीव्रता या आजीवन इमेजिंग के लिए कॉन्फ़िगर किया गया है। एकल-फोटॉन माइक्रोस्कोप के लिए, एनएडी (पी) एच और एफएडी आमतौर पर क्रमशः 375-405 एनएम और 488 एनएम के तरंग दैर्ध्य पर उत्साहित होते हैं, क्रमशः, इन तरंग दैर्ध्य 48 पर सामान्य लेजर स्रोतों के कारण। दो-फोटॉन प्रतिदीप्ति उत्तेजना में, एनएडी (पी) एच और एफएडी क्रमशः लगभग 700 से 750 एनएम और 700 से 900 एनएम की तरंग दैर्ध्य पर उत्तेजित होंगे। एक बार जब फ्लोरोफोर उत्साहित हो जाते हैं, तो एनएडी (पी) एच और एफएडी क्रमशः ~ 410 एनएम से ~ 490 एनएम और ~ 510 एनएम से ~ 640 एनएम के बीच तरंग दैर्ध्य पर फोटॉनों का उत्सर्जन करते हैं। एनएडी (पी) एच और एफएडी मैक्सिमा उत्सर्जन तरंग दैर्ध्य क्रमशः लगभग 450 एनएम और 535 एनएम हैं।
उनके विभिन्न उत्तेजना और उत्सर्जन तरंग दैर्ध्य के कारण, दो चयापचय कोएंजाइम के प्रतिदीप्ति को वर्णक्रमीय रूप से अलग किया जा सकता है। एनएडी (पी) एच और एफएडी की वर्णक्रमीय विशेषताओं की समझ ऑटोफ्लोरेसेंस इमेजिंग प्रोटोकॉल के डिजाइन और अनुकूलन के लिए आवश्यक है। साइनाइड एक इलेक्ट्रॉन परिवहन श्रृंखला (ईटीसी) जटिल IV अवरोधक है। सेलुलर चयापचय पर साइनाइड के प्रभाव और कोशिकाओं के भीतर एनएडी (पी) एच और एफएडी के ऑटोफ्लोरेसेंस तीव्रता और जीवनकाल अच्छी तरह से विशेषता है27,40। इसलिए, एक साइनाइड गड़बड़ी प्रयोग एनएडी (पी) एच और एफएडी इमेजिंग प्रोटोकॉल को मान्य करने का एक प्रभावी साधन है। एक सफल साइनाइड प्रयोग विश्वास प्रदान करता है कि एनएडी (पी) एच और एफएडी इमेजिंग प्रोटोकॉल का उपयोग अज्ञात समूहों या गड़बड़ी के चयापचय का आकलन करने के लिए किया जा सकता है।
Protocol
Representative Results
Discussion
Autofluorescence तीव्रता और जीवनभर इमेजिंग व्यापक रूप से कोशिकाओं में चयापचय का आकलन करने के लिए इस्तेमाल किया गया है21,55. एफएलआईएम उच्च रिज़ॉल्यूशन है और इसलिए एकल कोशिकाओं को हल करता है, जो …
Disclosures
The authors have nothing to disclose.
Acknowledgements
वित्त पोषण स्रोतों में टेक्सास के कैंसर रोकथाम और अनुसंधान संस्थान (CPRIT RP200668) और टेक्सास ए एंड एम विश्वविद्यालय शामिल हैं। चित्रा 1 BioRender.com के साथ बनाया गया था।
Materials
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25×36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25×36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
References
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532 (2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500 (2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271 (2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. 암 연구학. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456 (2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014 (2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068 (2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. 암 연구학. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer’s disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008 (2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104 (2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. 암 연구학. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. 암 연구학. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. 암 연구학. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. . Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792 (2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007)
- . CellProfiler Available from: https://cellprofiler.org/releases (2007)
- Autofluorescence Imaging. GitHub Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021)
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. 암 연구학. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. 암 연구학. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850 (2018).
- . The bh TCSPC Handbook Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021)
- Gadella, T. W. J., Mason, W. T. . Fluorescent and Luminescent Probes for Biological Activity. 34, 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).

