인간 α-시누클레인을 코딩하는 아데노 관련 바이러스 벡터에 의해 유도된 파킨슨병 마우스 모델 분석
Summary
이 연구는 파킨슨 병의 전임상 모델에서 신경 염증, 신경 변성 및 운동 장애를 유도하는 데 필요한 벡터 용량과 노출 시간을 분석합니다. 인간 α시누클레인을 코딩하는 이들 벡터는 파킨슨병과 관련된 시누클레인 병리를 재분석하기 위해 흑질로 전달된다.
Abstract
파킨슨 병은 nigrostriatal 경로의 도파민 성 뉴런의 죽음과 결과적으로 자발적인 운동의 통제의 점진적 손실을 포함하는 신경 퇴행성 장애입니다. 이 신경 퇴행성 과정은 주로 α-synuclein으로 구성되는 뇌에 단백질 응집체의 침착에 의해 유발됩니다. 여러 연구에 따르면 파킨슨 병과 관련된 신경 변성을 일으키기 위해서는 신경 염증이 필요하다는 사실이 밝혀졌습니다. 특히, 신경염증 과정은 미세아교세포 활성화뿐만 아니라 말초 T 세포의 흑질(SN) 내로의 침윤을 수반한다. 이 연구는 미세아교세포 활성화, SN으로의 T-세포 침윤, 니그랄 도파민성 뉴런의 신경변성 및 운동 장애를 되풀이하는 파킨슨병의 마우스 모델을 분석한다. 파킨슨병의 이러한 마우스 모델은 인간 야생형 α시누클레인(AAV-hαSyn)을 코딩하는 아데노-관련 바이러스 벡터의 입체택시 전달에 의해 SN 내로 유도된다. SN 내로의 바이러스 벡터의 정확한 전달은 녹색 형광 단백질 (GFP)을 코딩하는 대조군 벡터를 사용하여 확인하였다. 그 후, SN에 투여된 AAV-hαSyn의 투여량이 hαSyn 발현의 정도, 니그랄 도파민성 뉴런의 손실, 및 운동 장애에 어떻게 영향을 미치는지 평가하였다. 더욱이, hαSyn 발현, 미세아교세포 활성화 및 T-세포 침윤의 역학은 질병 발달의 시간 과정에 걸쳐 결정되었다. 따라서, 본 연구는 파킨슨병의 전임상 모델에서 시누클레인 병리학 및 신경염증을 표적화하는데 유용할 수 있는 중요한 시점을 제공한다.
Introduction
알츠하이머 병 후, 파킨슨 병은 전 세계적으로 두 번째로 널리 퍼진 신경 퇴행성 질환입니다. 파킨슨 병에 영향을받는 주요 뉴런은 도파민을 생성하고 자발적인 움직임을 조절하는 nigrostriatal 경로의 뉴런입니다. 결과적으로,이 장애와 관련된 가장 특징적인 증상은 운동 장애입니다. 이 병리학은 또한 시냅스 전 말단과 관련된 세포질 단백질 인 α-synuclein (αSyn)1로 주로 구성된 뇌에 단백질 응집체의 침착을 포함합니다. 증거는 αSyn의 병원성 내포물의 생성이 미스폴딩 또는 이 단백질2의 일부 번역 후 변형에 의해 촉발된다는 것을 보여주었다.
특히, αSyn 병리학과 인간 파킨슨 병 및 동물 모델 3,4에서 nigrostriatal 경로의 도파민성 뉴런의 손실 사이에 밀접한 관계가 확립되었습니다. αSyn 응집체가 어떻게 생성되는지, 그리고 이들이 어떻게 뉴런 사멸을 유도하는지 이해하는 것은 이 분야에서 중요한 도전과제입니다. 점점 더 많은 연구 그룹이 산화 스트레스를 증가시킴으로써 미토콘드리아 기능 장애가 αSyn 응집체2의 생성에 대한 주요 원인 중 하나임을 보여주었습니다. 실제로, 파킨슨병 위험과 관련된 몇몇 유전자는 미토콘드리아 기능, 형태학 및 역학에 관여하는 단백질을 코딩한다 5,6. 또한, 리소좀 기능장애는 기능장애성 미토콘드리아의 축적을 초래하고 αSyn을 미스폴딩하여 αSyn 응집체7의 생성을 촉진하는 또 다른 주요 사건을 구성한다.
새로운 증거에 따르면, 일단 αSyn 응집체가 뇌에 침착되면, 이러한 병원성 단백질은 미세아교세포의 톨-유사 수용체(TLR)를 자극하여 미세아교세포 활성화 및 흑질(SN)8,9의 초기 염증 환경을 촉발시킨다. 더욱이, 증거는 αSyn 응집체가 포획되어 항원 제시 세포에 의해 T 세포에 제시되어 αSyn10,11에 특이적인 적응 면역 반응을 유도한다는 것을 나타낸다. 이러한 αSyn 특이적 T 세포는 후속적으로 뇌에 침투하여 활성화된 미세아교세포에 의해 재자극되어 신경세포 사멸을 유발하는 신경독성 인자의 분비를 촉진한다(9,10). 흥미롭게도, αSyn 응집체가 장내 신경계에서 먼저 생성된 다음, 미주 신경을 통해 뇌 줄기(12)로 운반된다는 몇 가지 증거들이 제시되었다.
파킨슨병의 몇몇 동물 모델은 신경독성 물질(즉, 6-하이드록시도파민, 파라콰트, 로테논, 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)의 투여에 의해 유도된 것들과 유전적 상태(즉, 돌연변이 α-시누클레인, 돌연변이 류신-풍부 반복 키나아제 2)13의 투여에 의해 유도된 것들을 포함하여 수년 동안 사용되어 왔다. . 파킨슨 병의 일부 측면을 복제하는 신경 독소 유도 신경 퇴행과 관련된 모델에도 불구하고, 그들 중 누구도 질병의 모든 필수 측면을 재검토하거나 진행적이지 않습니다13. 한편, 류신이 풍부한 반복 키나아제 2의 돌연변이 버전의 발현, α-시누클레인의 돌연변이 버전, 또는 인간 야생형 α-시누클레인의 과발현을 포함하는 유전자 마우스 모델이 운동 장애를 초래하고, 어떤 경우에는 시누클레노병증의 발달을 초래하지만, 이들은 파킨슨병의 필수적인 측면인 니그랄 도파민성 뉴런의 두드러진 신경변성을 재현하지 못한다(13), 14. 신경 퇴행의 세 번째 종류의 동물 모델은 파킨슨 병의 필수적인 측면의 대부분을 충족 시켰으며, 인간 α 시누클레인 (AAV-hαSyn)을 코딩하는 아데노 관련 바이러스 벡터 (AAVs)의 입체 택시 전달 14,15. 중요하게도, AAVs는 포유류의 성인 뇌에서 높은 효능과 장기적으로 뉴런의 형질도입을 허용한다. 더욱이, SN에서 AAV-hαSyn의 입체택시 전달은 αSyn 병리학, 미세아교세포 활성화, 신경변성 및 운동 장애 16,17,18,19,20을 포함하는 질병의 많은 필수적인 측면을 재현하는 것으로 나타났다. 이 연구는 바이러스 벡터의 용량과 바이러스 벡터 전달 후 시간이 nigrostriatal 경로에서 hαSyn 발현, 신경 변성 및 신경 염증의 정도뿐만 아니라 SN에서 hαSyn의 일방적 인 입체 택시 전달의 마우스 모델에서의 운동 장애 정도에 어떻게 영향을 미치는지에 대한 분석을 제시합니다.
Protocol
Representative Results
Discussion
여기에서 분석 된 신경 변성의 마우스 모델은 αSyn 병리학 및 미세 아교 활성화에 관련된 메커니즘, 신경 염증의 조절에 말초 면역 체계의 관여 및 신경 변성의 메커니즘을 포함하여 파킨슨 병의 병리 생리학과 관련된 많은 중요한 측면을 연구하는 데 도움이 될 수 있습니다. αSyn 병리학에 관여하는 메카니즘 중에는SN2의 도파민성 뉴런에서 αSyn의 과도한 부하가 존재하는 미토콘드리아, 리소말, 또는 프로테아좀 기능장애와 관련된 세포내 기전이 있다. AAV 매개된 형질도입에 의해 유도된 hαSyn 발현 이외에도, 내인성 마우스 αSyn이 또한 총 αSyn 발현의 부하에 기여한다는 것을 고려하는 것이 중요하다. αSyn을 과발현하는 트랜스제닉 마우스는 hαSyn32의 과발현에 기초한 이들 마우스 모델에 유사한 시누클레인 병리학, 신경병리학 및 운동 장애를 개발한다. 미세아교세포 활성화와 관련하여, 본 마우스 모델은 사이토카인, 신경전달물질, 성상세포, 뉴런, 혈액-뇌 장벽 및 T 세포와 같은 상이한 분자 및 세포 플레이어가 전염증성 또는 항염증 기능적 표현형의 획득을 어떻게 조절할 수 있는지를 연구하는데 사용될 수 있다 8,10,11 . 이 모델은 또한 T 세포뿐만 아니라 대식세포, 단핵구 및 호중구를 포함한 말초 면역계의 역할을 니그랄 뉴런의 신경 염증 및 신경 변성 과정에 연구하는 데 중요한 도구입니다 11,33,34. 마지막으로, 이러한 마우스 모델은 또한 산화 스트레스, 에너지 결핍, 및 손상된 소기관(2)과 같은 내부 세포 과정에 의해 유도되는 것들, 또는 외부 플레이어에 의해 발휘되는 것들, 예컨대 미세아교세포, 성상세포, 및 세포독성 T 세포에 의해 생성된 신경독성 인자(8)를 포함하는 생체내에서 신경변성의 세포 및 분자 메카니즘을 연구하는데 유용한 시스템을 나타내고, 28,29,35.
이 마우스 모델의 한계는 뇌외 위치에서 αSyn의 병리학 적 응집이 파킨슨 병 발병의 초기 단계를 구성 할 수있는 방법에 대한 연구입니다36. 이와 관련하여, nigral 뉴런의 신경 변성 및 운동 장애 전에, αSyn 병리학은 장 점막 및 후각 상피(36 )에서 시작되고, 아마도 αSyn 특이적 T 세포 반응 뿐만 아니라12 일 것이라는 증거가 증가하고 있습니다. 그 후, αSyn 응집체는 미주 신경을 통해 뇌간으로 이동하여 도파민성 뉴런(12)의 신경염증 및 신경변성을 촉발시킨다. AAV-hαSyn 모델이 파킨슨 병의 대부분의 측면을 되풀이하지만,이 모델에서 대뇌 외 위치에서 αSyn의 병리학 적 응집에 대한 명백한 개입은 없습니다. 파킨슨 병의 이러한 측면을 연구하기에 적합한 hαSyn 병리학을 포함하는 대안 모델은 Thy1 프로모터, Thy1-SNCA 모델37의 제어하에 hαSyn을 과발현하는 트랜스제닉 마우스일 수 있으며, 여기서 질병 발달은 장내 미생물에 의존하고 명백한 위장 장애38을 수반한다.
파킨슨 병의 병리 생리학과 관련된 다양한 과정의 연구에 도움이되지만, 본 마우스 모델은 상응하는 공간 좌표에서 바이러스 벡터의 올바른 전달, 뉴런에서의 hαSyn의 선택적 발현 (AAV 혈청형 및 벡터 구성물에 의존함)을 포함하여 미세하게 검사되어야하는 중요한 단계를 포함합니다. 파킨슨병 표현형을 분석하기 전에 적절한 AAV 투여량 및 타이밍을 포함한다. SN에서 바이러스 벡터의 적절한 전달에 대한 분석은 바늘이 완전히 직선이 아닐 때 충분하지 않을 수 있기 때문에 SN에서 바이러스 벡터의 적절한 전달에 대한 분석이 필요하며, 때로는 인간의 눈에 인식 할 수 없습니다. 더욱이, AAV 벡터의 확산은 AAV 혈청형39에 의존한다. 이러한 이유로, SN의 영역을 포함하는 뇌 절편에서 GFP의 관찰에 이어 주입된 AAV-GFP 벡터의 정확한 전달 및 확산을 점검하는 주기적인 품질 관리를 수행할 필요가 있다.
뉴런에서의 hαSyn의 선택적 발현과 관련하여, 원칙적으로, hαSyn의 발현은 뉴런에 대해 선택적인 프로모터에 의해 조절되도록 조작될 수 있거나, 훨씬 더 정확하게는 도파민성 뉴런에 대해 선택적이며, 예를 들어 도파민성 뉴런(40)에서 유전자의 선택적 발현을 유도하기 위해 AAV 벡터에서 TH 프로모터를 사용하는 것과 같은 도파민성 뉴런에 대해 선택적일 수 있다. . 그러나이 전략은 추구되는 것이 관심있는 유전자의 과발현 일 때 작동하지 않습니다. 이러한 이유로, 본 모델에서는, 강력한 프로모터(하류 유전자의 높은 발현을 유도하는 프로모터) 및 AAV 혈청형을 뉴런 트로피즘과 함께 사용하는 것이 필수적이다. 이 연구에서, CBA 프로모터는 hαSyn의 과발현을 유도하기 위한 강력한 프로모터로서 사용되었고, AAV5 혈청형은 바이러스 벡터에 사용되었다. 이 혈청형은 마우스 및 래트 뉴런(41,42)을 형질도입하기 위해 이전에 사용되어 왔다. 여기서, 결과는, 마우스의 SN에서 AAV5-GFP의 전달 12주 후, 녹색 형광이 SN 및 선조체 둘 다의 동측성 측에 선택적으로 존재한다는 것을 입증하였고(도 1), 이는 nigrostriatal 경로의 뉴런의 효율적인 형질도입을 나타낸다.
파킨슨 병의이 마우스 모델의 또 다른 중요한 측면은 수술 후 특정 과정을 분석하는 데 필요한 시점입니다. 이와 관련하여이 연구는 병리학과 관련된 다양한 과정에 대한 운동 학적 연구를 보여줍니다. 주요 시점이 마우스당 주어진 바이러스 게놈의 용량, 사용된 AAV의 혈청형, 또는 사용된 AAV의 배치에 따라 변화하기 때문에, TH+ 뉴런 및 운동 장애의 유의한 손실을 유도하는데 필요한 AAV-αSyn의 양에 대한 용량-반응 분석이 먼저 수행되었다. 이전의 연구들은 마우스당 6 x 108-3 x 10 바이러스 게놈 16,17,30,31 범위의 용량으로 마우스에서 AAV-αSyn 주사를 12주 동안 투여한 후 심각한 운동 장애와 니그로스트리아 경로의 TH+ 뉴런의 손실을 보여주었다. 따라서 nigrostriatal 경로에서 hαSyn 발현을 유도하는 데 사용되는 AAV-hαSyn의 용량, TH + 뉴런의 손실 및 마우스의 운동 손상은 마우스 당 1 x 108-1 x 10바이러스 게놈 범위였습니다. 또한, TH+ 뉴런의 소실 및 운동 장애가 SN의 뉴런의 AAV 감염이 아닌 SN에서의 hαSyn의 과발현에 의해 유도되는 것을 조절하기 위해, 마우스의 SN에서 일방적으로 전달된 리포터 유전자(AAV-eGFP)를 암호화하는 AAV가 포함된 대조군이 포함되었고 신경변성 및 운동 장애가 결정되었다. 그 결과, 입체택시 수술 후 12주 후, 마우스당 1 x 10 바이러스 게놈이 AAV5-hαSyn의 적절한 투여량이었으며,이 바이러스 부하를 받은 마우스는 nigrostriatal pathway에서 유의한 hαSyn을 나타냈으며(도 2 및 도 3), TH+ 뉴런의 손실(도 4), 및 운동 장애(도 5). 대조적으로, AAV5-hαSyn (마우스 당 1 x 108 바이러스 게놈 및 마우스 당 1 x 109 바이러스 게놈)의 낮은 용량은 이러한 모든 매개 변수에서 중요한 변화에 도달 할만큼 충분히 강하지 않았습니다 (그림 2-4). 참고로, 마우스 당 1 x 10 바이러스 게놈에서 AAV-GFP의 투여는 니그랄 도파민성 뉴런의 TH+ 뉴런의 낮은 (~20%), 그러나 상당한 정도의 손실을 유도하였다 (도 4A, B). 이 결과는 이 모델41을 사용한 이전의 관찰과 일치하며, 아마도 SN에 AAV 벡터의 투여에 의해 유도된 낮은 수준의 신경염증의 결과일 것이다. 그럼에도 불구하고, TH+ 뉴런의 손실 정도는 AAV-GFP의 동일한 투여량을 투여받은 마우스와 비교하여 AAV5-hαSyn을 투여받은 마우스에서 유의하게 더 높았다(도 4C). 참고로, hαSyn 발현의 동역학은 형질도입의 효율뿐만 아니라 AAV 확산(39)의 정도에 의존한다. AAV 확산은 AAV 혈청형에 의존하기 때문에, 이 동물 모델의 정확한 핵심 시점은 AAV5와 상이한 다른 AAV 혈청형을 사용할 때 달라질 수 있다.
그 후, 이 마우스 모델에서 주요 시점을 결정하기 위해 마우스당 1 x10 바이러스 게놈을 사용하여 동역학 분석을 수행하였다. 현재의 증거는 파킨슨 병 43,44의 조기 진단을 허용하는 운동 장애 이전에 나타나는 몇 가지 초기 증상을 보여 주었기 때문에이 실험은 hαSyn 발현이 이미 분명하지만 운동 장애가없는 시점을 찾고자했습니다. 결과는 SN에서 hαSyn 발현의 개시가 AAV-hαSyn의 입체택시 전달 후 5주째에 있었다는 것을 보여준다(도 6). 이 시점은 신경염증 및 신경퇴행성 과정을 중단시키기 위해 맞춤화된 치료법을 투여하기 시작하는 흥미로운 시간적 시점을 구성한다. 여기서 결정된 다른 주요 시점은 신경염증 과정과 관련된 두 가지 중요한 사건에 대한 피크 시간, 즉 미세아교세포가 최대 활성화 정도에 도달하는 시간과 SN으로의 최대 T 세포 침윤 시간이었다. 결과는 최대 미세아교세포 활성화의 두 파동에 도달하는 추세를 가진 곡선을 보였으며, 첫 번째는 수술 후 10주에, 두 번째는 수술 후 15주에 도달했습니다(그림 7). T 세포 침윤의 동역학적 분석은 입체택시 수술 후 11주째에 SN 내로의 Treg 침윤의 피크 시간을 나타내었다(도 8). 놀랍게도, 분석된 기간 동안 SN에 침윤하는 이펙터 T 세포(CD4+ Foxp3-)는 검출되지 않았다(수술 후 8-13주). 전체적으로, 이러한 결과는 이 전임상 모델을 사용하여 신경염증 과정을 중단하고 SN으로의 T-세포 침윤을 감쇠시키는 데 초점을 맞춘 치료법을 투여하기 시작하는 적절한 기간을 시사하며, 이는 수술 후 5주째(hαSyn 과발현의 발병)와 수술 후 10주째(신경염증 및 T-세포 침윤의 첫 번째 파동)(그림 9) 사이입니다.
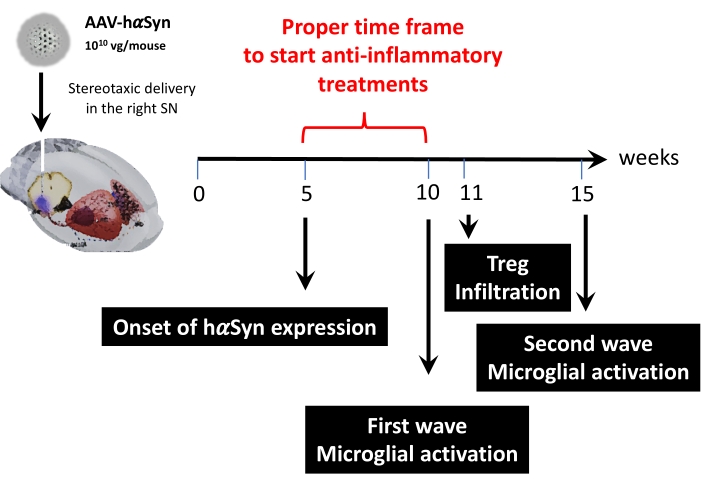
그림 9: 이 동물 모델에 대해 발견된 주요 시점 요약. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Disclosures
The authors have nothing to disclose.
Acknowledgements
우리는 Sebastián Valenzuela 박사와 Micaela Ricca 박사가 동물 시설에서 귀중한 수의학 지원을 해준 것에 감사드립니다. 이 연구는 “Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID” Centro Ciencia & Vida, FB210008 (to Fundación Ciencia & Vida), Geroscience Center for Brain Health and Metabolism, FONDAP-15150012의 지원을 받았다. 이 작품은 또한 “Agencia Nacional de Investigación y Desarrollo de Chile (ANID)”및 MJFF-10332.01 (R.P.) 및 MJFF-17303 (F.C.)의 FONDECYT-1210013 (R.P.) 및 MJFF-17303 (F.C.)을 파킨슨 연구 재단의 보조금으로 지원했습니다.
Materials
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
References
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson’s disease – An interwoven tapestry. Frontiers in Neurology. 4, 33 (2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson’s disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson’s disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson’s disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson’s disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson’s disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201 (2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson’s disease. Frontiers in Immunology. 10, 239 (2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson’s disease. Journal of Biomedicine and Biotechnology. 2012, 845618 (2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson’s disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson’s disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356 (2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281 (2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson’s disease. PLoS One. 5 (1), 8784 (2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44 (2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359 (2019).
- Flecknell, P. . Laboratory Animal Anaesthesia. 3rd Ed. , (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson’s disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson’s disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258 (2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson’s disease. Journal of Neuroinflammation. 15 (1), 244 (2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36 (2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834 (2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85 (2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson’s disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson’s disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338 (2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson’s disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63 (2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson’s disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson’s disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).

