Analisando o modelo de rato da doença de Parkinson induzida por vetores virais associados à Adeno codificando α-sinucleína humana
Summary
Este trabalho analisa a dose vetorial e o tempo de exposição necessários para induzir neuroinflamação, neurodegeneração e comprometimento motor neste modelo pré-clínico da doença de Parkinson. Esses vetores que codificam a α-sinucleína humana são entregues na substantia nigra para recapitular a patologia da sinucleína associada à doença de Parkinson.
Abstract
A doença de Parkinson é uma doença neurodegenerativa que envolve a morte dos neurônios dopaminérgicos da via nigrostriatal e, consequentemente, a progressiva perda de controle dos movimentos voluntários. Este processo neurodegenera é desencadeado pela deposição de agregados proteicos no cérebro, que são constituídos principalmente de α-sinucleína. Vários estudos indicaram que a neuroinflamação é necessária para desenvolver a neurodegeneração associada à doença de Parkinson. Notavelmente, o processo neuroinflamatório envolve ativação microglial, bem como a infiltração de células T periféricas na substantia nigra (SN). Este trabalho analisa um modelo de camundongo da doença de Parkinson que recapitula a ativação microglial, infiltração de células T no SN, a neurodegeneração de neurônios dopaminérgicos nigral e prejuízo motor. Este modelo de camundongo da doença de Parkinson é induzido pela entrega estereoxica de vetores virais associados ao adeno que codificam o tipo selvagem humano α-sinucleína (AAV-hαSyn) no SN. A entrega correta de vetores virais no SN foi confirmada utilizando vetores de controle codificando proteína fluorescente verde (GFP). Posteriormente, como a dose de AAV-hαSyn administrada no SN afetou a extensão da expressão hαSyn, a perda de neurônios dopaminérgicos nigral e o comprometimento motor foram avaliados. Além disso, a dinâmica da expressão hαSyn, ativação microglial e infiltração de células T foram determinadas ao longo do tempo de desenvolvimento da doença. Assim, este estudo fornece pontos de tempo críticos que podem ser úteis para direcionar a patologia da sinucleína e a neuroinflamação neste modelo pré-clínico da doença de Parkinson.
Introduction
Após a doença de Alzheimer, a doença de Parkinson é a segunda doença neurodegenerativa mais prevalente em todo o mundo. Os neurônios primários afetados na doença de Parkinson são os da via nigrostriatal, que produzem dopamina e controlam o movimento voluntário. Como consequência, o sintoma mais característico associado a esse transtorno é o comprometimento motor. Essa patologia também envolve a deposição de agregados proteicos no cérebro, que são compostos principalmente de α-sinucleína (αSyn)1, uma proteína citosolica associada a terminais pré-sinápticos. Evidências mostraram que a geração de inclusões patogênicas de αSyn é desencadeada por erros ou por algumas modificações pós-translacionais desta proteína2.
Notavelmente, estabeleceu-se uma relação próxima entre a patologia αSyn e a perda de neurônios dopaminérgicos da via nigrostriatal na doença de Parkinson humano e modelos animais 3,4. Entender como os agregados αSyn são gerados e como eles induzem a morte neuronal representa um desafio significativo no campo. Um grupo crescente de estudos tem demonstrado que, ao aumentar o estresse oxidativo, a disfunção mitocondrial é uma das principais causas para a geração de αSyn agrega2. De fato, vários genes associados à doença de Parkinson codificam proteínas envolvidas na função mitocondrial, morfologia e dinâmica 5,6. Além disso, a disfunção lysosômica, que resulta no acúmulo de mitocôndrias disfuncionais e αSyn desomída constitui outro grande evento promovendo a geração de αSyn agregados7.
Evidências emergentes indicaram que, uma vez que os agregados αSyn são depositados no cérebro, essas proteínas patogênicas estimulam receptores semelhantes a pedágio (TLRs) na microglia, desencadeando assim a ativação microglial e um ambiente inflamatório inicial na substantia nigra (SN)8,9. Além disso, as evidências indicam que os agregados αSyn são capturados e apresentados por células que apresentam antígenos às células T, induzindo uma resposta imune adaptativa específica para αSyn10,11. Essas células T específicas da αSyn se infiltram posteriormente no cérebro e são repimuladas por microglia ativada, promovendo assim a secreção de fatores neurotóxicos que evocam a morte neuronal 9,10. Curiosamente, várias linhas de evidência sugerem que os agregados αSyn são gerados primeiro no sistema nervoso entérico e depois transportados através do nervo vago para o tronco cerebral12.
Vários modelos animais da doença de Parkinson têm sido usados por muitos anos, incluindo aquelas induzidas pela administração de substâncias neurotóxixicas (ou seja, 6-hidroxydopamina, paraquat, rotenona, 1-metil-4-fenil-1,2,3,6-tetrahidropyridina) e aquelas que envolvem condições genéticas (ou seja, mutante α-sinucleína, mutante leucina-rica em kinase 2)13 . Apesar de modelos envolvendo neurodegeneração induzida por neurotoxina replicando alguns aspectos da doença de Parkinson, nenhum deles recapitula todos os aspectos essenciais da doença ou não são progressivos13. Por outro lado, embora modelos genéticos de camundongos envolvendo a expressão de versões mutantes de leucina-rich repeat kinase 2, versões mutantes de α-sinucleína, ou a superexpressão do tipo selvagem humano α-sinucleína resultam em prejuízo motor e, em alguns casos, também o desenvolvimento da sinucleinopatia, eles não reproduzem a neurodegeneração proeminente dos neurônios dopaminérgicos nigral, que é um aspecto essencial da doença de Parkinson13, 14 anos. Um terceiro tipo de modelo animal de neurodegeneração conseguiu atender a maioria dos aspectos essenciais da doença de Parkinson, a entrega estereotaxa de vetores virais associados ao Adeno (AAVs) codificando a α-sinucleína humana (AAV-hαSyn)14,15. É importante ressaltar que os AAVs permitem a transdução de neurônios com alta eficácia e a longo prazo no cérebro adulto dos mamíferos. Além disso, a entrega estereoxica de AAV-hαSyn no SN tem se mostrado para reproduzir muitos dos aspectos essenciais da doença, incluindo patologia αSyn, ativação microglial, neurodegeneração e comprometimento motor 16,17,18,19,20. Este estudo apresenta uma análise de como a dose de vetor viral e o tempo após o parto do vetor viral afetam a extensão da expressão hαSyn, neurodegeneração e neuroinflamação na via nigrostriatal, bem como o grau de comprometimento motor no modelo de rato de entrega estereotaxa unilateral de hαSyn no SN.
Protocol
Representative Results
Discussion
O modelo de neurodegeneração do camundongo aqui analisado pode ajudar a estudar muitos aspectos críticos envolvidos na fisiopatologia da doença de Parkinson, incluindo os mecanismos envolvidos na patologia αSyn e ativação microglial, o envolvimento do sistema imunológico periférico na regulação da neuroinflamação e os mecanismos de neurodegeneração. Entre os mecanismos envolvidos na patologia αSyn estão os mecanismos subcelulares associados à disfunção mitocondrial, lisosômica ou proteassômica na presença de uma carga excessiva de αSyn nos neurônios dopaminérgicos da SN2. É importante considerar que, além da expressão hαSyn induzida pela transdução mediada por AAV, o rato endógeno αSyn também contribui para a carga da expressão total αSyn. Camundongos transgênicos que expressam excessivamente o camundongo αSyn desenvolvem patologia synucleina semelhante, neuropatologia e comprometimento motor para esses modelos de camundongos com base na superexpressão de hαSyn32. Em relação à ativação microglial, o modelo atual do mouse pode ser usado para estudar como diferentes atores moleculares e celulares, como citocinas, neurotransmissores, astrócitos, neurônios, a barreira hematoencefálica e células T podem regular a aquisição de fenótipos funcionais pró-inflamatórios ou anti-inflamatórios 8,10,11 . Este modelo também constitui uma importante ferramenta para estudar o papel do sistema imunológico periférico, incluindo não apenas células T, mas também macrófagos, monócitos e neutrófilos, sobre os processos de neuroinflamação e neurodegeneração dos neurôniosnigrais 11,33,34. Por fim, este modelo de camundongos também representa um sistema valioso para estudar os mecanismos celulares e moleculares da neurodegeneração in vivo, incluindo aqueles induzidos por processos celulares internos, como estresse oxidativo, déficits energéticos e organelas danificadas 2, ou aqueles exercidos por atores externos, como fatores neurotóxicos produzidos por células microgliais, astrócitos e células T citotóxixas8, 28,29,35.
Uma limitação deste modelo de camundongo é o estudo de como a agregação patológica de αSyn em locais extra-cerebrais pode constituir os estágios iniciais no desenvolvimento da doença de Parkinson36. A este respeito, há evidências crescentes indicando que, antes da neurodegeneração de neurônios negros e comprometimento motor, a patologia αSyn começa na mucosa intestinal e no epitélio olfativo36 e, provavelmente, na resposta αSyn-específica t-cell, bem como12. Depois, os agregados αSyn migrariam através do nervo vago para o tronco cerebral, desencadeando a neuroinflamação e neurodegeneração dos neurônios dopaminérgicos12. Embora o modelo AAV-hαSyn recapitula a maioria dos aspectos da doença de Parkinson, não há evidente envolvimento da agregação patológica de αSyn em locais extra-cerebrais neste modelo. Um modelo alternativo envolvendo a patologia hαSyn apropriada para estudar esses aspectos da doença de Parkinson pode ser camundongos transgênicos superexpressando hαSyn sob o controle do promotor Thy1, o thy1-SNCA modelo37, no qual o desenvolvimento da doença é dependente da microbiota intestinal e envolve um evidente comprometimento gastrointestinal38.
Embora seja útil para o estudo dos diversos processos associados à fisiopatologia da doença de Parkinson, o modelo atual do camundongo envolve etapas críticas que devem ser minuciosamente verificadas, incluindo a correta entrega dos vetores virais nas coordenadas espaciais correspondentes, a expressão seletiva de hαSyn em neurônios (que depende do sorotipo AAV e da construção vetorial), e a dose e o tempo adequados de AAV antes de analisar o fenótipo parkinsoniano. A análise da entrega adequada dos vetores virais no SN é necessária, pois o uso das coordenadas espaciais corretas do SN pode não ser suficiente quando a agulha não é totalmente reta, o que às vezes é imperceptível ao olho humano. Além disso, a difusão dos vetores AAV depende do sorotipo AAV39. Por essas razões, é necessário realizar controles periódicos de qualidade verificando a entrega e difusão correta dos vetores AAV-GFP injetados após a observação de GFP em fatias cerebrais contendo a área do SN.
Quanto à expressão seletiva de hαSyn nos neurônios, em princípio, a expressão de hαSyn poderia ser projetada para ser controlada por um promotor seletivo para neurônios ou, ainda mais preciso, seletivo para neurônios dopaminérgicos, como o uso do promotor de TH em vetores AAV para induzir a expressão seletiva de genes em neurônios dopaminérgicos40 . No entanto, essa estratégia não funciona quando o que se busca é a superexpressão do gene de interesse. Por essa razão, no modelo atual, é essencial utilizar um promotor forte (um promotor induzindo alta expressão do gene a jusante) e sorotipos AAV com tropismo neuronal. Neste estudo, o promotor da CBA foi utilizado como um forte promotor para induzir a superexpressão de hαSyn, e o sorotipo AAV5 foi utilizado para o vetor viral. Este sorotipo já foi usado antes para transduzir neurônios de camundongos e ratos41,42. Aqui, os resultados demonstraram que, 12 semanas após a entrega de AAV5-GFP no SN de camundongos, a fluorescência verde estava seletivamente presente no lado ipsilateral tanto do SN quanto do estriado (Figura 1), indicando a transdução eficiente dos neurônios da via nigrostriatal.
Outro aspecto crítico deste modelo de camundongos da doença de Parkinson é o ponto de tempo necessário para analisar um determinado processo após a cirurgia. Nesse sentido, este trabalho mostra um estudo cinético de diferentes processos envolvidos na patologia. Uma vez que os pontos-chave mudam com a dose de genomas virais dada por camundongo, o sorotipo de AAV utilizado, ou mesmo com o lote de AAV utilizado, uma análise dose-resposta da quantidade de AAV-αSyn necessária para induzir uma perda significativa de neurônios TH+ e prejuízo motor foi realizada pela primeira vez. Estudos anteriores mostraram prejuízo motor significativo e perda de neurônios TH+ da via nigrostriatal após 12 semanas de injeções AAV-αSyn em camundongos em doses que variam de 6 x 108-3 x 1010 genomas virais por rato 16,17,30,31. Assim, a dose de AAV-hαSyn usada para induzir a expressão hαSyn na via nigrostriatal, a perda de neurônios TH+ e o comprometimento motor em camundongos variaram de 1 x 108-1 x 1010 genomas virais por rato. Além disso, para controlar que a perda de neurônios TH+ e o comprometimento motor foram induzidos pela superexpressão de hαSyn no SN e não pela infecção por AAV de neurônios do SN, foram incluídos grupos de controle nos quais a codificação de AAV para um gene repórter (AAV-eGFP) foi entregue unilateralmente no SN de camundongos e foram determinados prejuízos neurodegeneração e motor. Os resultados mostraram que, 12 semanas após a cirurgia estereoxica, 1 x 1010 genomas virais por camundongo foi uma dose adequada de AAV5-hαSyn, pois os camundongos que receberam essa carga viral apresentaram hαSyn significativo na via nigrostriatal (Figura 2 e Figura 3), perda de neurônios TH+ (Figura 4) e comprometimento motor (Figura 5). Em contraste, doses mais baixas de AAV5-hαSyn (1 x 108 genomas virais por rato e 1 x 109 genomas virais por rato) não foram fortes o suficiente para alcançar mudanças significativas em todos esses parâmetros (Figuras 2-4). Note-se que a administração do AAV-GFP em 1 x 1010 genomas virais por camundongo induziu um baixo (~20%), mas grau significativo de perda de neurônios TH+ de neurônios dopaminérgicos nigral (Figura 4A,B). Este resultado concorda com observações anteriores usando este modelo41 e é provavelmente a consequência de um baixo nível de neuroinflamação induzido pela administração de vetores AAV no SN. No entanto, a extensão da perda de neurônios TH+ foi significativamente maior em camundongos que receberam AAV5-hαSyn em comparação com aqueles que receberam a mesma dose de AAV-GFP (Figura 4C). Note-se que a cinética da expressão hαSyn não depende apenas da eficiência da transdução, mas também da extensão da difusão AAV39. Uma vez que a difusão do AAV depende do sorotipo AAV, os pontos de tempo precisos neste modelo animal podem variar ao usar outro sorotipo AAV diferente do AAV5.
Posteriormente, foi realizada uma análise cinética usando 1 x 1010 genomas virais por mouse para determinar os principais pontos de tempo neste modelo de mouse. Uma vez que as evidências atuais mostraram alguns sintomas precoces que aparecem antes do comprometimento motor, o que permitiria o diagnóstico precoce da doença de Parkinson43,44, esses experimentos procuraram encontrar o ponto de tempo em que a expressão hαSyn já era evidente, mas na ausência de comprometimento motor. Os resultados mostram que o início da expressão hαSyn no SN foi de 5 semanas após a entrega estereotipada de AAV-hαSyn (Figura 6). Este ponto de tempo constitui um ponto temporal interessante para começar a administrar terapias adaptadas para parar os processos neuroinflamatórios e neurodegenerativos. Outros pontos-chave determinados aqui foram os horários de pico de dois eventos críticos associados ao processo de neuroinflamação: o tempo em que a microglia atinge o grau máximo de ativação e o tempo de infiltração máxima de células T no SN. Os resultados mostraram uma curva com tendência atingindo duas ondas de ativação microglial máxima, a primeira às 10 semanas após a cirurgia e a segunda às 15 semanas após a cirurgia (Figura 7). A análise cinética da infiltração de células T mostrou o tempo de pico da infiltração de Treg no SN às 11 semanas após a cirurgia estereotipada (Figura 8). Surpreendentemente, nenhuma célula T efeitoor (CD4+ Foxp3-) foi detectada infiltrando-se no SN durante o período analisado (semanas 8-13 após a cirurgia). Ao todo, esses resultados sugerem um período adequado de tempo para começar a administrar terapias voltadas para parar o processo de neuroinflamação e atenuar a infiltração de células T no SN usando este modelo pré-clínico, que varia entre a semana 5 após a cirurgia (o início da superexpressão hαSyn) e a semana 10 após a cirurgia (a primeira onda de neuroinflamação e infiltração de células T) (Figura 9).
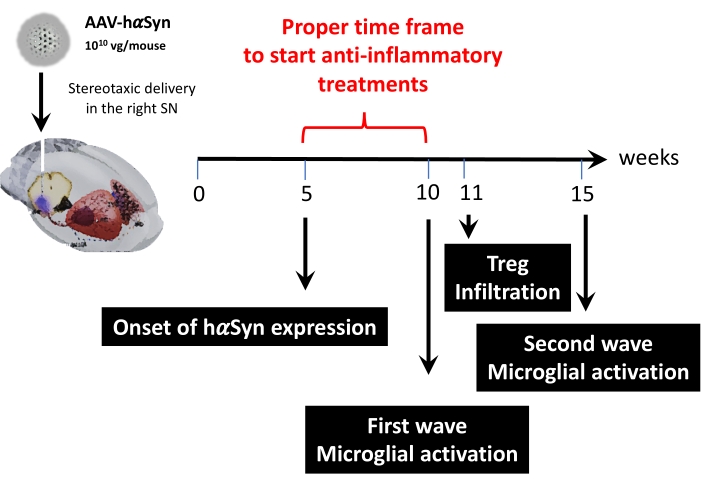
Figura 9: Resumo dos principais pontos de tempo encontrados para este modelo animal. Por favor, clique aqui para ver uma versão maior desta figura.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos ao Dr. Sebastián Valenzuela e à Dra. Este trabalho contou com o apoio do “Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID” Centro Ciencia & Vida, FB210008 (para Fundação Ciencia & Vida) e pelo Centro de Gerociência para Saúde Cerebral e Metabolismo, FONDAP-15150012. Este trabalho também foi financiado pelas bolsas FONDECYT-1210013 (para R.P.) e FONDECYT-1150766 (para F.C.) da “Agencia Nacional de Investigación y DesarRollo de Chile (ANID)” e MJFF-10332.01 (para R.P.) e MJFF-17303 (para F.C.) da Fundação Michael J Fox para Pesquisa de Parkinson.
Materials
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
References
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson’s disease – An interwoven tapestry. Frontiers in Neurology. 4, 33 (2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson’s disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson’s disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson’s disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson’s disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson’s disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201 (2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson’s disease. Frontiers in Immunology. 10, 239 (2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson’s disease. Journal of Biomedicine and Biotechnology. 2012, 845618 (2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson’s disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson’s disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356 (2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281 (2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson’s disease. PLoS One. 5 (1), 8784 (2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44 (2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359 (2019).
- Flecknell, P. . Laboratory Animal Anaesthesia. 3rd Ed. , (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson’s disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson’s disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258 (2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson’s disease. Journal of Neuroinflammation. 15 (1), 244 (2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36 (2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834 (2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85 (2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson’s disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson’s disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338 (2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson’s disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63 (2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson’s disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson’s disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).

