المجهر الطولي داخل الحيوية باستخدام نافذة تصوير الثدييات مع غطاء قابل للاستبدال
Summary
يصف هذا البروتوكول نافذة تصوير ثديي جديدة ذات غطاء قابل للاستبدال (R.MIW). يسمح الفحص المجهري داخل الحيوية بعد زرع R.MIW بالتصوير الطولي والمتعدد الأيام للغدة الثديية السليمة والمريضة بدقة خلوية خلال مراحل النمو المختلفة.
Abstract
البنية المتفرعة للغدة الثديية ديناميكية للغاية وتخضع لعدة مراحل من النمو وإعادة التشكيل بعد الولادة. تم استخدام الفحص المجهري داخل الحيوية بالاشتراك مع جراحة رفرف الجلد أو زرع نوافذ التصوير لدراسة ديناميكيات الغدة الثديية السليمة في مراحل النمو المختلفة. تقتصر معظم تقنيات التصوير الثديي على إطار زمني من ساعات إلى أيام ، في حين أن غالبية عمليات إعادة تشكيل الغدة الثديية تحدث في أطر زمنية من أيام إلى أسابيع. لدراسة إعادة تشكيل الغدة الثديية ، هناك حاجة إلى طرق تسمح بالوصول البصري إلى الأنسجة ذات الأهمية لأطر زمنية ممتدة. هنا ، يتم وصف نسخة محسنة من نافذة التصوير الثديي التيتانيوم مع غطاء قابل للاستبدال (R.MIW) يسمح بتصوير عالي الدقة للغدة الثديية بدقة خلوية لمدة تصل إلى عدة أسابيع. الأهم من ذلك ، يوفر R.MIW الوصول إلى الأنسجة طوال مدة تجربة التصوير داخل الحيوية ، وبالتالي يمكن استخدامه لمعالجة الأنسجة المحلية ، ووضع العلامات ، وإدارة الأدوية ، أو التشريح المجهري الموجه بالصور. يتيح R.MIW مجتمعة توصيفا عالي الدقة للديناميكيات الخلوية أثناء تطور الغدة الثديية والتوازن والمرض.
Introduction
الظهارة الثديية هي عضو إفرازي فريد موجود في الثدييات ، والذي ينتج ويفرز الحليب لتغذية النسل. طوال الحياة ، تخضع الغدة الثديية لجولات متعددة من التطور والنمو ، مصحوبة بتغييرات هيكلية ووظيفية في الأنسجة1. اعتمادا على مرحلة النمو ، تختلف أنواع الخلايا التي تساهم في إعادة تشكيل الأنسجة ، وكذلك الموقع داخل شجرة القنوات.
يسمح الفحص المجهري متعدد الفوتونات داخل الحيوية (IVM) بدراسة ديناميكيات الخلايا الثديية في الجسم الحي في الإعداد الأصلي والحد الأدنى من الاضطراب2،3،4. للحصول على الوصول البصري إلى الغدة الثديية ، تم نشر العديد من تقنيات التصوير المؤقت خارج الجسم الحي أو الجلد خلال مراحل مختلفة من تطور الغدة الثديية ، بما في ذلك البلوغ4،5،6،7 ، والبلوغ2،8 ، والرضاعة9،10،11،12 ، وديناميات الورم13،14 ، 15. على الرغم من أن هذه التقنيات تؤدي إلى تصوير عالي مكانيا وزمنيا لديناميكيات الخلايا الثديية ، إلا أن الإطار الزمني يقتصر على ساعات في حين أن معظم عمليات إعادة تشكيل الغدة الثديية تستغرق أياما إلى أسابيع. لذلك ، هناك حاجة إلى طرق تسمح بالوصول البصري إلى الأنسجة ذات الأهمية للأطر الزمنية الممتدة. على مر السنين ، تم تطوير العديد من نوافذ التصوير الدائمة لتصوير أورام الثدي 15،16،17،18 ، بما في ذلك نافذة تصوير الثدي التيتانيوم (MIW) 2،3،19. على الرغم من أنه مفيد جدا لدراسة نمو الورم الثديي ، إلا أن تصور بنية الغدة الثديية الصحية ظل محدودا لبضعة أيام. في الآونة الأخيرة ، تم تطوير نافذة تصوير سيليكون مرنة ، والتي تسمح بتصور الغدة الثديية البلوغ على مدى عدة أسابيع20. ومع ذلك ، يتم تضمين الغدة الثديية في وسادة دهنية غنية بالخلايا الشحمية ، مما يؤدي إلى تشتت الضوء على نطاق واسع ونتيجة لذلك رؤية محدودة لهياكل القنوات الثديية. لذلك ، هناك حاجة إلى ظروف تصوير متفوقة في جميع الأوقات لتصور ديناميكيات الأنسجة على مدى فترات طويلة من الزمن في الغدة الثديية. لا يسمح MIW الكلاسيكي ، ولا نافذة السيليكون المرنة بمعالجة الأنسجة أو تحسين موقع الأنسجة المادية قبل التصوير ، حيث تشكل النافذة نظاما مغلقا بعد الجراحة والزرع. ونتيجة لذلك، من المرجح أن يصبح الوصول البصري الأمثل إلى الأنسجة الثديية الأساسية مستبعدا على مدى فترات زمنية أطول. في المقابل ، تسمح تقنية رفرف الجلد بتحسين الأنسجة وإعادة وضعها أثناء جلسة التصوير ويمكن تكرار رفرف الجلد عدة مرات2. ومع ذلك ، فإن جلسات التصوير المتكررة من خلال رفرف الجلد ممكنة فقط عندما يتم تخصيص وقت كاف (7 أيام على الأقل) بين العمليات الجراحية للسماح باستعادة الجلد ، وبالتالي فهي مناسبة في الغالب لدراسة العمليات على نطاقات زمنية أطول. علاوة على ذلك ، ينصح بعدم تنفيذ هذا الإجراء عدة مرات بسبب طبيعته الغازية وخطر كبير من العدوى والندوب عند إغلاق الجرح.
للتغلب على هذه القيود ، أي لضمان ظروف التصوير المثلى لفترة طويلة من الزمن بتردد عال وفي الوقت نفسه السماح بمعالجة الأنسجة ، تم تصميم نسخة محسنة من التيتانيوم من MIW مع غطاء قابل للاستبدال (R.MIW) لتصور الغدة الثديية الصحية والمريضة على مدى عدة أيام إلى أسابيع2 (الشكل 1A ، ب) تم تصميم R.MIW خصيصا لتوفير الوصول الأمثل للأنسجة ، مما يتيح التلاعب المباشر بالأنسجة طوال مدة تجربة IVM ، وبالتالي يسمح بتصور الغدة الثديية في الوقت والمكان المناسبين على مدى فترات طويلة من الزمن. عند إغلاقه ، يشكل R.MIW نظاما محكم الإغلاق يمكن مقارنته ب MIW الكلاسيكي (الشكل 1C). عند فتحه في ظل ظروف معقمة، يسمح R.MIW بمعالجة الأنسجة المحلية لتحسين الوصول البصري ويتيح أيضا الإدارة المحلية للمواد، مثل مثبطات المسار أو المنبهات، أو حقن أنواع مختلفة من الخلايا ذات الاهتمام، مثل الخلايا السرطانية أو مجموعات الخلايا المناعية، أو إضافة أصباغ وسم الأنسجة. يمكن فتح الغطاء في أي لحظة بين جلسات التصوير دون التسبب في تلف الأنسجة الكامنة.
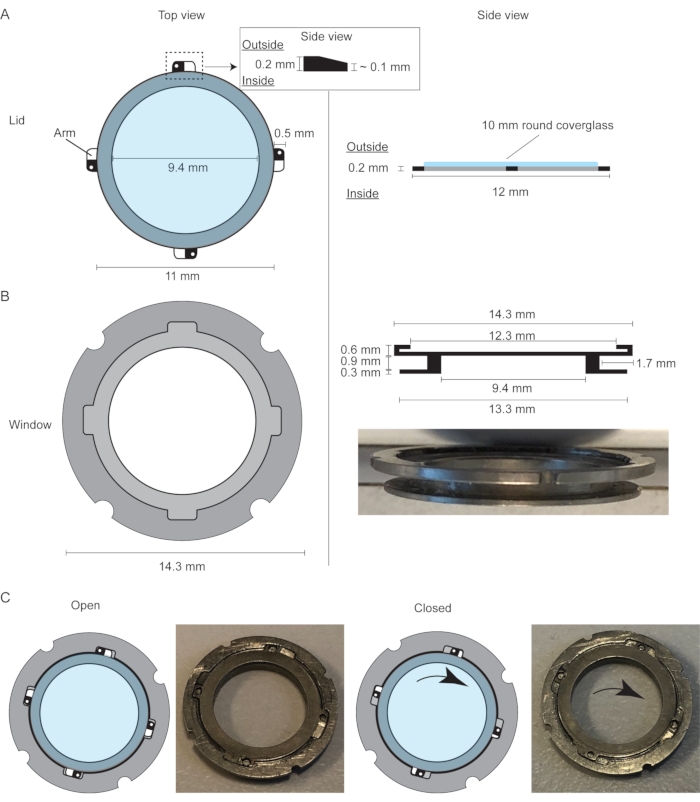
الشكل 1: تصميم نافذة التصوير الثديي بغطاء قابل للاستبدال. (أ) منظر علوي ومنظر جانبي للغطاء القابل للاستبدال لنافذة التصوير الثديي مع غطاء زجاجي مقاس 10 مم ملتصق بالحلبة. (ب) المنظر العلوي والمنظر الجانبي لنافذة التصوير الثديي ، والتي تتكون من حلقة خارجية وحلقة داخلية مع أخدود بينهما لتأمين النافذة داخل جلد الماوس باستخدام خياطة سلسلة محفظة. تحتوي الحلقة الخارجية على أخدود صغير يناسب الإسقاطات الأربعة (الأذرع) للغطاء. (ج) الرسوم المتحركة والصور التي تبين آليات فتح وإغلاق الغطاء. تضمن الإسقاطات المائلة تثبيت الغطاء داخل إطار النافذة. تم تعديل هذا الرقم من Messal et al. 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يصف هذا البروتوكول إجراء تصميم وزرع R.MIW ، بالإضافة إلى استراتيجية IVM طولية لإعادة النظر في نفس القنوات الثديية وتصورها بدقة خلوية. يسمح R.MIW بمتابعة انقسامات الخلايا والتغيرات المورفولوجية خلال مراحل النمو المختلفة للغدة الثديية في نماذج الفأر الفلورسنت المتنوعة. يسهل R.MIW معا توصيف عالي الدقة للديناميكيات الخلوية أثناء تطور الغدة الثديية والتوازن والمرض.
Protocol
Representative Results
Discussion
يسمح R.MIW بالتصوير الطولي للغدة الثديية السليمة والمريضة في بيئتها الأصلية والأقل تعطيلا ويسمح بالتصور المتكرر للغدة الثديية في مراحل النمو المتنوعة. يسمح تصميم R.MIW بفتح النافذة في أي وقت أثناء التجربة. قد يعوق الوصول البصري على المدى الطويل إلى الأنسجة ذات الأهمية ، على سبيل المثال ، من خلال تراكم حطام الخلايا على الغطاء الزجاجي. في مثل هذه الحالات ، يمكن فتح R.MIW قبل أو مباشرة بعد جلسة التصوير للسماح بتنظيف منطقة الأنسجة المرئية والغطاء بالكامل. يسمح الغطاء القابل للإزالة أيضا بالتلاعب بالأنسجة بالإضافة إلى التطبيق المحلي للمواد ، مثل مثبطات وعلاجات محددة ، أو وضع علامات على الأصباغ ، أو أنواع معينة من الخلايا ذات الاهتمام.
تتغلب هذه الطريقة على قيود إجراءات سديلة الجلد الثديي الموصوفة سابقا4،7،8،13 ، والتي تقتصر على جلسة تصوير واحدة ، ويمكنها تصور عمليات مثل التشكل المتفرع (الشكل 5) ، أو دوران الأنسجة الاستتبابية (الشكل 6) ، أو نمو الورم على المستوى الخلوي (الشكل 3 ب) ). ومع ذلك ، في الوقت نفسه ، يسمح R.MIW بالتلاعب المحلي بالأنسجة بين جلسات التصوير ، والتي تضم رصيدا كبيرا من R.MIW مقارنة ب MIW 3,18 المنشورة سابقا وجميع نوافذ التصوير الأخرى20,22. عند فتح R.MIW ، من المهم الحفاظ على ظروف معقمة في جميع الأوقات لمنع أي مصدر للعدوى. تسمح القدرة على فتح R.MIW في بيئة معقمة بتحسين ظروف التصوير قبل كل جلسة تصوير ، مما يحسن بشكل كبير الوصول البصري طويل الأجل إلى الأنسجة محل الاهتمام. على وجه التحديد ، في الغدة الثديية ، التي يتم تضمينها في سدى غنية بالخلايا الشحمية ، هذا ذو قيمة كبيرة. علاوة على ذلك ، يمكن للغطاء القابل للاستبدال أن يمكن بشكل فريد الإدارة المحلية للعلاجات ، أو أنواع الخلايا المختلفة ، أو أصباغ وضع العلامات ، أو التشريح المجهري الموجه بالصور ، أو أي معالجة محلية أخرى للأنسجة دون الحاجة إلى إنهاء تجربة IVM. على سبيل المثال ، لدراسة بدء الورم ، يمكن حقن مجموعات محددة من الخلايا السرطانية مباشرة في شجرة الأقنية أو السدى في نقطة زمنية محددة IVM وموقع دقيق للغدة الثديية ، طالما يمكن الوصول إلى عائد الاستثمار هذا من خلال حلقة R.MIW. لدراسة تطور الورم ، يمكن وضع علامة ضوئية على مجموعات محددة من الخلايا السرطانية (في موقع محدد ، أو في بيئة دقيقة محددة ، أو بسلوك معين) أثناء جلسة IVM وبعد ذلك تشريحها باستخدام مجهر تشريح الفلورسنت بعد فتح R.MIW. ويمكن مواصلة معالجة الخلايا المعزولة لإجراء التحليلات النهائية، مثل تسلسل الحمض النووي الريبوزي المرسال (أحادي الخلية). باستخدام هذا النهج ، يمكن للمرء أن يقرن سلوك الخلايا الحية بملامح التعبير الجزيئي. تسمح ميزة إدارة الأدوية المحلية التي يتيحها R.MIW بتصوير الأنسجة قبل العلاج وبعده مباشرة. يمكن إجراء الفاصل الزمني اللازم لإزالة الماوس من صندوق التصوير وإجراء إدارة الدواء المحلية بعد فتح غطاء R.MIW في دقائق ، مما يسمح بالتقاط المرحلة الفورية للأدوية سريعة المفعول.
نظهر أن IVM للغدة الثديية من خلال R.MIW متوافق مع العديد من نماذج الماوس مراسل الفلورسنت المختلفة. البيئة الغنية بالدهون تمثل تحديا للتصوير ، وبالتالي يوصى باستخدام الفلوروفورات الساطعة. ومع ذلك ، كما هو موضح هنا ، يمكن تصور الفلوروفورات الأقل سطوعا مثل mCFP من خلال R.MIW في ظروف التصوير المثلى. حتما ، سوف تمنع وسادة الدهون تصوير الهياكل القنية العميقة ، وتقصر التصوير على القنوات الأكثر سطحية. ستساعد صورة نظرة عامة منخفضة الدقة في بداية كل تجربة IVM على تحديد الهياكل القنية ذات الأهمية السطحية بما فيه الكفاية للتصوير عالي الدقة. يمكن للتلاعب بالأنسجة المحلية أو إزالة النسيج الضام أو إعادة وضع الأنسجة الدهنية بعد فتح R.MIW تحسين IVM لعائد الاستثمار المحدد الذي يتم تراكبه بواسطة الأنسجة الدهنية. هذه ميزة مهمة على جميع تصميمات النوافذ السابقة ، والتي لا تسمح بإجراء هذه التلاعب وتتطلب إزالة كاملة للنافذة نفسها. على وجه التحديد ، لتصور العقدة الليمفاوية الإربية ، يوصى بإزالة الأنسجة الدهنية العلوية بلطف ، مما يقلل من تشتت الضوء ويتيح التصوير عالي الدقة. عند التلاعب بالأنسجة ، احتفظ دائما بالظروف المعقمة ومنع النزيف أو الأضرار الجسيمة للأنسجة ، لأنها قد تؤثر على العمليات التي تتم دراستها أثناء تجربة IVM.
يتكون R.MIW من التيتانيوم ، وهي مادة شائعة الاستخدام في الممارسة السريرية لتحل محل الأنسجة الصلبة مثل المفاصل أو ألواح العظام. يتمتع التيتانيوم بالعديد من المزايا مقارنة بالنوافذ الفولاذية ، بما في ذلك طابعه الخفيف الوزن والخامل21. في الآونة الأخيرة ، تم استخدام العديد من المواد الأخرى لإنشاء أنواع جديدة من نوافذ التصوير ، بما في ذلك نافذة السيليكون المرنة20. على النقيض من R.MIW ، لا تتطلب النافذة المرنة أي خيوط للزرع وهي مناسبة لأي موضع تشريحي تقريبا ، وتحديدا في حالة الأنسجة الرخوة والهشة. نوافذ السيليكون لها تأثير ضئيل على حركة الحيوانات بسبب طبيعتها خفيفة الوزن والقابلة للتشوه وربما أكثر ملاءمة في التجارب التي تدرس التوسع السريع للأنسجة ونموها20. ميزة أخرى على إصدار التيتانيوم هي أن نوافذ السيليكون متوافقة مع طرق التصوير الأخرى ، بما في ذلك التصوير بالرنين المغناطيسي20,27. ومع ذلك ، سيكون من المهم أن تضع في اعتبارك أن الأهداف محسنة للأغطية الزجاجية مقاس 0.17 مم. علاوة على ذلك ، فإن الأنسجة الثديية عرضة لحركات التنفس ، والتي يصعب تقييدها باستخدام النافذة المرنة ، خاصة عند استخدام المجهر المقلوب. يتم تقليل القطع الأثرية للتنفس من خلال تصميم R.MIW وتثبيت R.MIW في تطعيم صندوق التصوير. ونتيجة لذلك ، لا يتم تشويه الصور التي تم الحصول عليها باستخدام إعداد R.MIW المقترح بسبب تنفس القطع الأثرية. ومع ذلك ، يمكن أن تحدث انجرافات طفيفة في توطين الأنسجة ، والتي عادة ما تكون تدريجية ويمكن تصحيحها باستخدام برنامج تصحيح الحركة بعد الاستحواذ28. مع زيادة مجموعة أدوات تقنيات IVM 2,20 ، فإن المتطلبات المحددة لكل تجربة ستحدد في النهاية أفضل طريقة لتصور الأنسجة محل الاهتمام في الجسم الحي. تتميز تصميمات النوافذ المختلفة بمزايا وعيوب مختلفة ، واعتمادا على سؤال البحث ، وإعداد الفحص المجهري المتاح ، والدقة المكانية والزمنية المطلوبة ، والفترة الزمنية الإجمالية للعملية المدروسة ، يجب تحديد النهج الأمثل.
باختصار ، يسهل R.MIW توصيف عالي الدقة للديناميكيات الخلوية أثناء تطور الغدة الثديية والتوازن والمرض على مدى عدة أيام إلى أسابيع.
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة الأبحاث فلاندرز (منحة الدكتوراه للبحوث الأساسية 11L7222N إلى M.C.) ، ومؤسسة Boehringer Ingelheim (زمالة الدكتوراه إلى C.L.G.J.S) ، وزمالة EMBO لما بعد الدكتوراه (منحة ALTF 1035-2020 إلى C.L.G.J.S.) ، وجائزة الدكتور جوزيف شتاينر (إلى J.v.R).
Materials
| 0.9% NaCl | BD | 306573 | Other brands available |
| 10 mm round coverglass | Fisher scientific | 10696365 | Other brands available |
| 5-0 braided silk suturs | Ethicon | W580 | |
| 80% Ethanol | homemade | NA | |
| Anesthesia induction box | Kentscientific | VetFlo-MSEKIT | |
| Buprenorphine (Vetergesic®) | Ecuphar | NA | |
| Cotton tips (sterile) | Fisher scientific | 13113743 | Other brands available |
| Cyanoacrylate adhesive | Loctite | NA | Other brands available |
| Eye ointment | Duratears | NA | |
| Flexible butterfly needle | Greiner Bio-One | 450120 | Other brands available |
| Graefe forceps (blunt) | Fine Science Tools | 11051-10 | |
| Heating pad | Kentscientific | RightTemp Jr. | Other brands available |
| Imaging box | Custom made | NA | |
| Infuse nutrient mixture | Braun | Nutriflex special 70/240 | |
| Insulin syringes | BD | 324911 | Other brands available |
| Inverted multi-photon microscope with automated stage | Leica Microsystems | NA | |
| Isoflurane vaporizer | Kentscientific | VetFlo-1231K | |
| Needle holder | Fine Science Tools | 12510-14 | |
| Parafilm | Sigma-Aldrich | P7793 | semi-transparent tape |
| Paper tape tesa | Tesa | NA | |
| Petroleum Jelly | Vaseline | NA | |
| Razor blades | Fisher scientific | 11904325 | Other brands available |
| Silicon tubing | Solutions Elastomeres | NA | Any houseware |
| Spring scissors (small) | Fine Science Tools | 15018-10 | |
| Sterile PBS | ThermoFisher Scientific | 10010023 | |
| Syringe (10 ml) | BD | 305482 | Other brands available |
| Thin forceps | Fine Science Tools | 11413-11 | |
| Titanium lid for mammary imaging window | Custom made | NA | |
| Titanium mammary imaging window | Custom made | NA | |
| Wooden sticks toothpicks | Fisher scientific | NC1678836 | Other brands available |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: new insights into the journey of morphogenesis and commitment. Development. 147 (22), (2020).
- Messal, H. A., van Rheenen, J., Scheele, C. L. G. J. An Intravital Microscopy Toolbox to Study Mammary Gland Dynamics from Cellular Level to Organ Scale. Journal of Mammary Gland Biology and Neoplasia. 26 (1), 9-27 (2021).
- Kedrin, D., et al. Intravital imaging of metastatic behavior through a mammary imaging window. Nature Methods. 5 (12), 1019-1021 (2008).
- Dawson, C. A., Mueller, S. N., Lindeman, G. J., Rios, A. C., Visvader, J. E. Intravital microscopy of dynamic single-cell behavior in mouse mammary tissue. Nature Protocols. 16 (4), 1907-1935 (2021).
- Scheele, C. L., et al. Identity and dynamics of mammary stem cells during branching morphogenesis. Nature. 542 (7641), 313-317 (2017).
- Kotsuma, M., et al. Nondestructive, serial in vivo imaging of a tissue-flap using a tissue adhesion barrier. IntraVital. 1 (1), 69-76 (2012).
- Ingman, W. V., Wyckoff, J., Gouon-Evans, V., Condeelis, J., Pollard, J. W. Macrophages promote collagen fibrillogenesis around terminal end buds of the developing mammary gland. Developmental Dynamics: an official publication of the American Association of Anatomists. 235 (12), 3222-3229 (2006).
- Entenberg, D., et al. large-volume, high-resolution intravital imaging for tissue-wide analysis of single cell dynamics. Methods (San Diego, Calif). 128, 65-77 (2017).
- Masedunskas, A., Weigert, R., Mather, I. H. Intravital Imaging of the Lactating Mammary Gland in Transgenic Mice Expressing Fluorescent Proteins. Advances in Intravital Microscopy. , 187-204 (2014).
- Masedunskas, A., Chen, Y., Stussman, R., Weigert, R., Mather, I. H. Kinetics of milk lipid droplet transport, growth, and secretion revealed by intravital imaging: lipid droplet release is intermittently stimulated by oxytocin. Molecular Biology of the Cell. 28 (7), 935-946 (2017).
- Mather, I. H., Masedunskas, A., Chen, Y., Weigert, R. Symposium review: Intravital imaging of the lactating mammary gland in live mice reveals novel aspects of milk-lipid secretion. Journal of Dairy Science. 102 (3), 2760-2782 (2019).
- Stevenson, A. J., et al. Multiscale imaging of basal cell dynamics in the functionally mature mammary gland. Proceedings of the National Academy of Sciences. 117 (43), 26822-26832 (2020).
- Ewald, A. J., Werb, Z., Egeblad, M. Preparation of Mice for Long-Term Intravital Imaging of the Mammary Gland. Cold Spring Harbor Protocols. 2011 (2), 5562 (2011).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of Vital Signs for Long-Term Survival of Mice under Anesthesia. Cold Spring Harbor Protocols. 2011 (2), 5563 (2011).
- Harney, A. S., Wang, Y., Condeelis, J. S., Entenberg, D. Extended Time-lapse Intravital Imaging of Real-time Multicellular Dynamics in the Tumor Microenvironment. Journal of Visualized Experiments: JoVE. (112), e54042 (2016).
- Harper, K. L., et al. Mechanism of early dissemination and metastasis in Her2+ mammary cancer. Nature. 540 (7634), 588-592 (2016).
- Sobolik, T., et al. Development of novel murine mammary imaging windows to examine wound healing effects on leukocyte trafficking in mammary tumors with intravital imaging. IntraVital. 5 (1), 1125562 (2016).
- Shan, S., Sorg, B., Dewhirst, M. W. A novel rodent mammary window of orthotopic breast cancer for intravital microscopy. Microvascular Research. 65 (2), 109-117 (2003).
- Zomer, A., et al. Intravital imaging of cancer stem cell plasticity in mammary tumors. Stem Cells. 31 (3), 602-606 (2013).
- Jacquemin, G., et al. Longitudinal high-resolution imaging through a flexible intravital imaging window. Science Advances. 7 (25), (2021).
- Niinomi, M. Recent research and development in titanium alloys for biomedical applications and healthcare goods. Science and Technology of Advanced Materials. 4 (5), 445-454 (2003).
- Ritsma, L., et al. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, N., Luo, L. A global double-fluorescent cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Nowotschin, S., Hadjantonakis, A. K. Use of KikGR a photoconvertible green-to-red fluorescent protein for cell labeling and lineage analysis in ES cells and mouse embryos. BMC Developmental Biology. 9, 49 (2009).
- Kurotaki, Y., Hatta, K., Nakao, K., Nabeshima, Y. I., Fujimori, T. Blastocyst Axis Is Specified Independently of Early Cell Lineage But Aligns with the ZP Shape. Science. 316 (5825), 719-723 (2007).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Warren, S. C., et al. Removing physiological motion from Intravital and clinical functional imaging data. eLife. 7, 35800 (2018).

