シリコン平面皮質内微小電極の表面処理用ツール
Summary
本プロトコルは、ガス堆積および水溶液反応 による 表面改質のための処理中にシリコン平面皮質内微小電極を処理するためのツールを記述する。手順全体を通してデバイスを処理するために使用されるコンポーネントのアセンブリが詳細に説明されています。
Abstract
皮質内微小電極は大きな治療可能性を秘めています。しかし、彼らは控えめな移植期間の後に大幅な性能低下に挑戦しています。観察された減少の実質的な寄与は、インプラントに近位の神経組織への損傷およびその後の神経炎症反応である。デバイスの寿命を改善するための努力には、組織応答を改善するためのデバイス表面への化学修飾またはコーティング用途が含まれる。このような表面処理の開発は、典型的には、意図された用途に必要な電気部品を欠いている非機能的な「ダミー」プローブを使用して完了する。機能デバイスへの変換は、皮質内微小電極アレイの脆弱性を考えると、さらなる考慮を必要とする。ハンドリングツールは、特に長い手続き時間を必要とする修正のために、組み立てられたデバイスへの表面処理を大幅に促進します。ここで説明するハンドリングツールは、気相堆積および水溶液曝露 を介して 適用される表面処理に使用される。コーティングの特性評価は、エリプソメトリーおよびX線光電子分光法を用いて行われる。機能デバイス上のコーティング手順の前後の電気インピーダンス分光法記録の比較により、変更後のデバイスの完全性が確認されました。記載されたツールは、化学的適合性を維持する代替電極装置および処理方法に容易に適合させることができる。
Introduction
神経補綴装置は、脊髄損傷、筋萎縮性側索硬化症(ALS)、脳性麻痺、および切断を含む幅広い患者集団において、感覚および運動能力の障害または欠如を回復することを目的としている1,2,3。皮質内微小電極(IME)は、皮質ニューロンと神経補綴物を制御するために使用されるデバイスとの間の通信経路を確立することができる。皮質内微小電極の明確な利点は、高い空間的および時間的分解能で神経信号を記録する能力であり、これはその後の信号処理およびブレインコンピュータインターフェースの制御に好ましい4,5。残念なことに、皮質内微小電極の性能は、移植後数ヶ月から1年以内に劇的に低下する2,6,7,8。信号品質と安定性の損失は、技術の適用に悪影響を及ぼします。
観察されたパフォーマンス低下の有意な寄与は、移植関連組織損傷および慢性神経炎症に対する生物学的応答である9、10、11。IMEの移植は脳組織に損傷を与え、反応的な細胞防御プロセスのカスケードを開始するシグナル伝達分子の放出をもたらす。慢性インターフェースは異物応答を悪化させ、装置に近位の組織を損傷する持続的な神経炎症をもたらす。しばしば、神経炎症、瘢痕化、およびシグナル品質の記録の低下に寄与する局所神経変性の症状として認識される12、13、14、15。同伴された活性化ミクログリアおよびマクロファージを有するアストロサイトの緻密なコングロマリットを含み、電極を封入する瘢痕は、材料輸送および炎症因子の局所蓄積の減少を伴う好ましくない局所環境を作り出す16、15、16、17、18。
多くの研究は、皮質内微小電極に対する脳の応答、または応答を緩和するためのアプローチを記載している7。組織応答を改善するための研究開発には、全体的な構造、表面トポロジー、材料、およびコーティング用途への修正を含む、さまざまな戦略が含まれていました。これらの努力は、移植事象から受ける損傷を最小限に抑え、デバイスと近位細胞との間により好ましい界面を導入し、またはデバイスが移植された後の組織歪みを低減することを意図している7。慢性生物学的応答を特異的に標的とする方法は、移植部位を安定化させ、細胞の健康を化学的に促進することを目的としたいくつかの生理活性コーティングをもたらしている。例としては、ポリ(エチレンジオキシチオフェン)(PEDOT)19、20などの導電性ポリマー、カーボンナノチューブ21、ヒドロゲル22、および特定の細胞プロセスを標的とする生理活性分子および薬物の添加23、24、25が挙げられる。特に、私たちの研究グループは、デバイス移植26に関連する外傷の最小化、デバイス/組織の剛性ミスマッチの最小化27、28、29、30、31、32、33、滅菌の最適化など、移植された微小電極に対する炎症反応の減少を促進する多くのメカニズムを探求してきましたが、これらに限定されません手順34、35、酸化ストレス/損傷の低減28、36、37、38、39、40、41、42、代替電極材料43の探索、および天然細胞外マトリックスのナノアーキテクチャを模倣する44、45、46.最近の関心事は、微小電極組織界面における神経炎症反応を直接緩和するための生体模倣体表面コーティングの開発である39。
インターフェースの改変は、信号記録に必要な創傷および近位組織を直接標的とする独自の利点を提供する。免疫応答を悪化させることなく治癒を促進する表面処理は、品質記録の寿命に利益をもたらし、皮質内微小電極の治療および研究の可能性を実現する際の限界を取り除くことができる。提示された研究は、デバイスの脆弱性に対応しながら、長い反応時間を必要とする微小電極アレイに表面処理を適用するための方法を詳述している。提示された技術は、表面改質方法を、装置が治療用途全体にわたって取り扱うことができない機能的な装置に共有することを意図している。これらのツールは、非機能的なダミープローブおよび機能的なシリコン平面微小電極アレイを処理するために提示されています。
電極表面を改質するための提示されたアプローチは、気相堆積および水溶液との反応のための非機能性ダミープローブまたは機能性シリコン平面電極アレイの安全な懸濁液を可能にする。これらの壊れやすいデバイスを処理するために、いくつかの3Dプリント作品が使用されます(図1および図2)。Mn(III)テトラキス(4-安息香酸)ポルフィリン(MnTBAP)の固定化を含む抗酸化コーティングによる表面改質のために気相および溶液相ステップの両方を利用する手順の一例が提供される。MnTBAPは、炎症の媒介性を実証した抗酸化特性を有する合成メタロポルフィリンである47,48。機能性シリコン平面電極アレイに関する提供された例は、非機能性デバイス40について以前に報告されたプロトコルへの更新を検証する。Muniefらからの気相堆積技術の適応は、機能電極49とのプロトコルの適合性を支持する。気相堆積は、活性MnTBAPを固定化するためのカルボジイミド架橋剤化学を含む水性反応の準備において表面をアミン官能化するために利用される。ここで開発されたハンドリング方法論は、他のコーティングや同様のデバイスに対応するように変更できるプラットフォームとして提供されています。
このプロトコルは、機能性シリコン平面電極アレイと同様の寸法を有するシリコンシャンクおよび3D印刷タブを含む非機能性ダミープローブを使用するアプローチを示す。デバイスのコネクタパッケージは、提供された命令の非機能ダミープローブの3D印刷タブに類似していると考えられています。
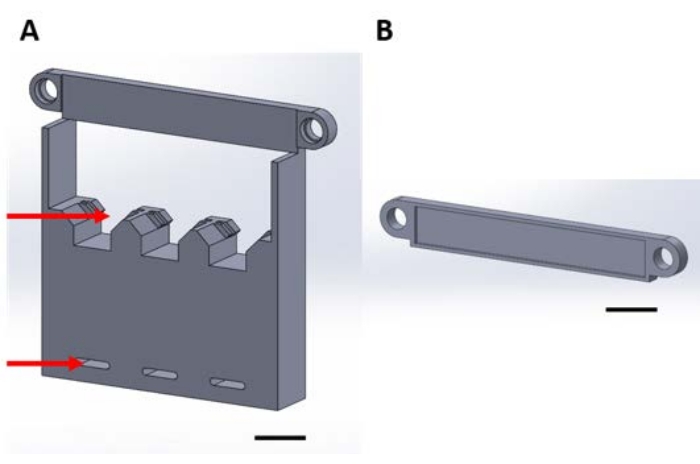
図1:真空デシケータでの気相堆積中に機能デバイスを取り扱うための3Dプリントピース(A)構造のベースには、1 cm x 1 cmのサンプルシリコン正方形のホルダー(上矢印)とデシケータプレートに固定するための穴(下矢印)が含まれています。(B)プレートは、デバイスのサスペンションを固定するために使用されます。ここからは、この図の各ピースをピース1Aまたは1Bと呼ぶことにします。スケール バー = 1 cm。この図の拡大版を表示するには、ここをクリックしてください。
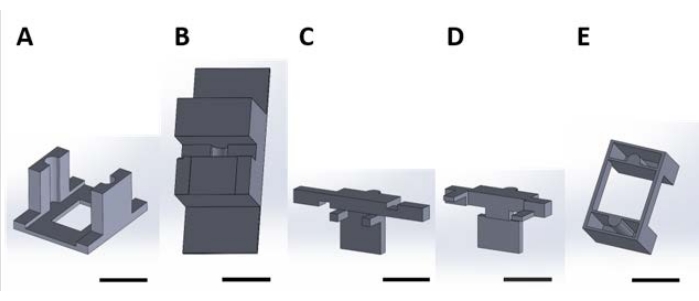
図2:水溶液中で起こる表面反応のための機能性デバイスを取り扱うための3D印刷片。 (A)培養プレートの蓋に接着されるガイド片。(B)組み立て中に(C)と(D)を安定させるベンチトップピース。(C)及び(D)は、ウェルプレート内に載置するための装置の懸濁液を一緒に固定し、そして(E)さらに、(C)及び(D)片をウェルプレート蓋に固定する。ここからは、この図の各パネルの個々のピースを、この図のパネル番号に対応するピース番号と呼ぶことにする。スケール バー = 1 cm。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
記載されたプロトコルは、シリコン平面微小電極アレイの表面処理のために設計されました。3Dプリントされたツールは、ロープロファイルコネクタ50を備えたミシガンスタイルの微小電極アレイにカスタマイズされています。非機能性プローブは、生体適合性接着剤を用いてシリコンプローブを3D印刷されたタブに接着することによって組み立てられた。3Dプリントされた?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、米国(米国)退役軍人省リハビリテーション研究開発サービスのメリットレビュー賞IRX002611(カパドーナ)およびリサーチキャリアサイエンティスト賞IK6RX003077(カパドーナ)によって部分的に支援されました。さらに、この研究は、国立衛生研究所、国立神経障害・脳卒中研究所R01NS110823(カパドーナ/パンクラツィオ)、および国立科学財団大学院研究フェローシッププログラム(クレブス)によって部分的に支援されました。
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

