Verktyg för ytbehandling av kiselplanära intrakortikala mikroelektroder
Summary
Detta protokoll beskriver verktyg för hantering av kiselplanära intrakortikala mikroelektroder under behandlingar för ytmodifiering via gasavsättning och vattenlösningsreaktioner. Monteringen av komponenterna som används för att hantera enheterna under hela proceduren förklaras i detalj.
Abstract
Intrakortikala mikroelektroder har stor terapeutisk potential. Men de utmanas med betydande prestandaminskning efter blygsamma implantationsvaraktigheter. En betydande bidragsgivare till den observerade nedgången är skadan på nervvävnaden proximal mot implantatet och efterföljande neuroinflammatoriskt svar. Ansträngningar för att förbättra enhetens livslängd inkluderar kemiska modifieringar eller beläggningsapplikationer på enhetens yta för att förbättra vävnadssvaret. Utvecklingen av sådana ytbehandlingar slutförs vanligtvis med icke-funktionella “dummy” -sonder som saknar de elektriska komponenter som krävs för den avsedda applikationen. Översättning till funktionella enheter kräver ytterligare överväganden med tanke på bräckligheten hos intrakortiska mikroelektrodmatriser. Hanteringsverktyg underlättar i hög grad ytbehandlingar för monterade enheter, särskilt för modifieringar som kräver långa procedurtider. De hanteringsverktyg som beskrivs här används för ytbehandlingar som appliceras via gasfasdeposition och exponering för vattenhaltiga lösningar. Karakterisering av beläggningen utförs med användning av ellipsometri och röntgenfotoelektronspektroskopi. En jämförelse av elektriska impedansspektroskopiinspelningar före och efter beläggningsproceduren på funktionella anordningar bekräftade enhetens integritet efter modifiering. De beskrivna verktygen kan lätt anpassas för alternativa elektrodanordningar och behandlingsmetoder som upprätthåller kemisk kompatibilitet.
Introduction
Neuroprostetiska enheter syftar till att återställa nedsatt eller frånvarande sensorisk och motorisk förmåga i ett brett spektrum av patientpopulationer, inklusive de med ryggmärgsskada, amyotrofisk lateralskleros (ALS), cerebral pares och amputationer 1,2,3. Intracortical microelectrodes (IME) kan etablera en kommunikationsväg mellan kortikala neuroner och de enheter som används för att kontrollera neuroprostetik. En tydlig fördel med intrakortikala mikroelektroder är deras förmåga att registrera neurala signaler med hög rumslig och tidsmässig upplösning, vilket föredras för efterföljande signalbehandling och kontroll av hjärn-datorgränssnitt 4,5. Tyvärr minskar prestandan hos intrakortikala mikroelektroder dramatiskt inom några månader till ett år efter implantation 2,6,7,8. Förlusten av signalkvalitet och stabilitet påverkar tillämpningen av tekniken negativt.
En betydande bidragande orsak till den observerade prestationsminskningen är det biotiska svaret på implantationsassocierad vävnadsskada och kronisk neuroinflammation 9,10,11. Implantation av IME orsakar skador på hjärnvävnad, vilket resulterar i frisättning av signalmolekyler som initierar kaskader av reaktionära cellulära försvarsprocesser. Kroniskt gränssnitt förvärrar svaret på främmande kropp, vilket leder till ihållande neuroinflammation som skadar vävnaden proximal mot enheten; ofta erkänd som symtom på neuroinflammation, ärrbildning och lokal neurodegeneration som bidrar till nedgången i inspelningen av signalkvaliteten 12,13,14,15. Bestående av ett tätt konglomerat av astrocyter med entrained aktiverade mikroglia och makrofager, skapar ärret som inkapslar elektroden en ogynnsam lokal miljö med minskad materialtransport och lokal ackumulering av inflammatoriska faktorer 16,15,16,17,18.
Många studier har beskrivit hjärnans svar på intrakortikala mikroelektroder eller metoder för att mildra svaret7. Forskning och utveckling för att förbättra vävnadssvaret har involverat en rad strategier, inklusive modifieringar av den övergripande strukturen, yttopologin, materialen och beläggningsapplikationen. Dessa ansträngningar avser att minimera skador som uppstått från implantationshändelsen, införa ett mer gynnsamt gränssnitt mellan enheten och proximala celler eller minska vävnadsstammen efter att enheter implanterats7. Metoder som specifikt riktar sig mot det kroniska biologiska svaret har lett till flera bioaktiva beläggningar som syftar till att stabilisera implantationsstället och kemiskt främja cellhälsa. Exempel inkluderar ledande polymerer såsom poly (etylendioxytiofen) (PEDOT)19,20, kolnanorör21, hydrogeler22 och tillsats av bioaktiva molekyler och läkemedel för att rikta in sig på specifika cellulära processer 23,24,25. Vår forskargrupp har i synnerhet utforskat många mekanismer för att främja en minskning av det inflammatoriska svaret på implanterade mikroelektroder inklusive, men inte begränsat till, minimering av traumat i samband med enhetsimplantation26, minimering av enhetens / vävnadens styvhetsfel 27,28,29,30,31,32,33, optimering av sterilisering procedurer34,35, minska oxidativ stress /skada 28,36,37,38,39,40,41,42, utforska alternativa elektrodmaterial 43 och efterlikna nanoarkitekturen hos den naturliga extracellulära matrisen 44,45,46 . Nytt intresse är utvecklingen av biomimetiska ytbeläggningar för att mildra det neuroinflammatoriska svaret vid mikroelektrodvävnadsgränssnittet direkt39.
Modifiering av gränssnittet erbjuder den unika fördelen att direkt rikta in sig på såret och den proximala vävnaden som är nödvändig för signalinspelning. En ytbehandling som främjar läkning utan att förvärra immunsvaret kan gynna livslängden för kvalitetsinspelning och ta bort begränsningar för att förverkliga den terapeutiska och forskningspotentialen för intrakortiska mikroelektroder. Det presenterade arbetet beskriver metoder för att applicera ytbehandlingar på mikroelektrodmatriser som kräver förlängda reaktionstider samtidigt som enheternas bräcklighet tillgodoses. Den presenterade tekniken är avsedd att dela ytmodifieringsmetoder till funktionella enheter där produkten inte kan hanteras under hela behandlingsapplikationen. Verktygen presenteras för hantering av icke-funktionella dummyprober och funktionella kiselplanära mikroelektrodmatriser.
Det presenterade tillvägagångssättet för att modifiera elektrodytan möjliggör säker suspension av icke-funktionella dummyprober eller funktionella kiselplanära elektrodmatriser för gasfasavsättning och reaktion med vattenhaltiga lösningar. Flera 3D-tryckta delar används för att hantera dessa ömtåliga enheter (figur 1 och figur 2). Ett exempel ges på ett förfarande som använder både gas- och lösningsfassteg för ytmodifieringen med en antioxidativ beläggning som involverar immobilisering av Mn (III) tetrakis (4-bensoesyra) porfyrin (MnTBAP). MnTBAP är ett syntetiskt metalloporfyrin som har antioxidativa egenskaper med demonstrerad förmedling av inflammation47,48. Det tillhandahållna exemplet på funktionella kiselplanära elektrodmatriser validerar en uppdatering av ett tidigare rapporterat protokoll för icke-funktionella enheter40. Anpassningen av en gasfasavsättningsteknik från Munief m.fl. stöder protokollets kompatibilitet med funktionella elektroder49. Gasfasavsättningen används för att aminfunktionalisera ytan som förberedelse för den vattenhaltiga reaktionen som involverar karbodiimid tvärbindande kemi för att immobilisera den aktiva MnTBAP. Hanteringsmetoden som utvecklats här tillhandahålls som en plattform som kan modifieras för att rymma andra beläggningar och liknande enheter.
Protokollet illustrerar tillvägagångssättet med icke-funktionella dummyprober bestående av ett kiselskaft och en 3D-tryckt flik med liknande dimensioner som de funktionella kiselplanära elektrodmatriserna. Enhetens anslutningsförpackning anses vara analog med den 3D-tryckta fliken för den icke-funktionella dummysonden i den medföljande instruktionen.
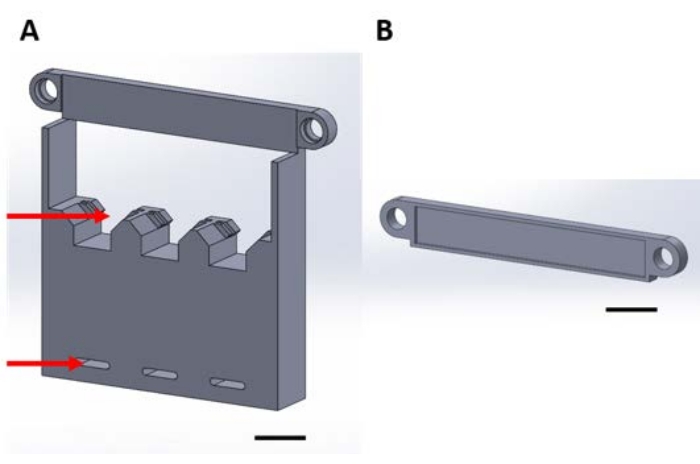
Figur 1: 3D-tryckta bitar för hantering av funktionella anordningar under gasfasavsättningen i en vakuumdessiccator. (B) Plattan används för att säkra upphängningen av anordningar. Härifrån och framåt kommer varje bit i denna figur att kallas antingen bit 1A eller 1B. Skalstreck = 1 cm. Klicka här för att se en större version av denna figur.
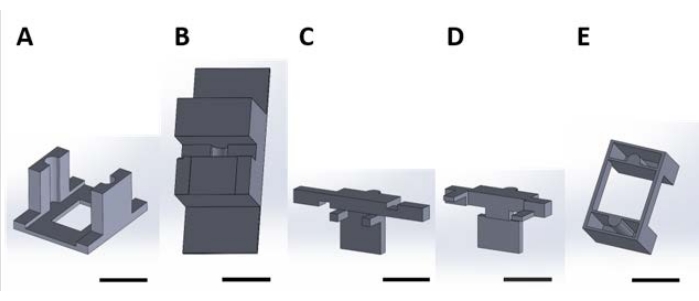
Figur 2: 3D-printade delar för hantering av funktionella anordningar för ytreaktion som sker i vattenlösningen. (B) Bänkstycken som används för att stabilisera bitar (C) och (D) vid montering. (C) och (D) tillsammans säkrar upphängningen av anordningar för placering i brunnsplattan, och (E) säkrar ytterligare bitar (C) och (D) till brunnsplattans lock. Härifrån och framåt kommer enskilda bitar i varje panel i denna figur att kallas styckenummer som motsvarar panelnumret för denna figur. Skalstreck = 1 cm. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Det beskrivna protokollet var utformat för ytbehandling av kiselplanära mikroelektrodmatriser. De 3D-tryckta verktygen är anpassade till mikroelektrodmatriser i Michigan-stil med lågprofilkontakter50. Icke-funktionella sonder monterades genom att fästa en kiselsond på 3D-tryckta flikar med hjälp av ett biokompatibelt lim. De 3D-tryckta flikarna designades med liknande dimensioner som kontakterna som ingår i de kommersiellt tillgängliga enheterna som används. Filer för de 3D-utskrivna fl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna studie stöddes delvis av Merit Review Award IRX002611 (Capadona) och Research Career Scientist Award IK6RX003077 (Capadona) från USA :s (USA) Department of Veterans Affairs Rehabilitation Research and Development Service. Dessutom stöddes detta arbete delvis av National Institute of Health, National Institute of Neurological Disorders and Stroke R01NS110823 (Capadona / Pancrazio) och National Science Foundation Graduate Research Fellowship Program (Krebs).
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

