تعطيل مسببات الأمراض عن طريق التحلل الضوئي للضوء المرئي للريبوفلافين -5′-فوسفات
Summary
هنا ، نقدم بروتوكولا لتعطيل البكتيريا المسببة للأمراض مع أنواع الأكسجين التفاعلية المنتجة أثناء التحلل الضوئي لأحادي النوكليوتيد فلافين (FMN) تحت تشعيع الضوء الأزرق والبنفسجي منخفض الكثافة. ثبت أن التحلل الضوئي FMN طريقة بسيطة وآمنة للعمليات الصحية.
Abstract
ريبوفلافين-5′-فوسفات (أو فلافين أحادي النوكليوتيد; FMN) حساس للضوء المرئي. يمكن توليد مركبات مختلفة ، بما في ذلك أنواع الأكسجين التفاعلية (ROS) ، من التحلل الضوئي FMN عند التشعيع بالضوء المرئي. تعتبر أنواع الأكسجين التفاعلية الناتجة عن التحلل الضوئي FMN ضارة بالكائنات الحية الدقيقة ، بما في ذلك البكتيريا المسببة للأمراض مثل المكورات العنقودية الذهبية (S. aureus). تقدم هذه المقالة بروتوكولا لإلغاء تنشيط S. aureus ، على سبيل المثال ، عبر التفاعلات الكيميائية الضوئية التي تنطوي على FMN تحت تشعيع الضوء المرئي. يتم تقييم أنيون الجذر الفائق () المتولد أثناء التحلل الضوئي FMN عن طريق تقليل النيترو الأزرق رباعي (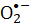 NBT). تم استخدام الصلاحية الميكروبية للمكورات العنقودية الذهبية التي تعزى إلى الأنواع التفاعلية
NBT). تم استخدام الصلاحية الميكروبية للمكورات العنقودية الذهبية التي تعزى إلى الأنواع التفاعلية 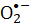 لتحديد فعالية العملية. يتناسب معدل التعطيل البكتيري مع تركيز FMN. الضوء البنفسجي أكثر كفاءة في تعطيل S. aureus من تشعيع الضوء الأزرق ، في حين أن الضوء الأحمر أو الأخضر لا يقود التحلل الضوئي FMN. توضح هذه المقالة التحلل الضوئي FMN كطريقة بسيطة وآمنة للعمليات الصحية.
لتحديد فعالية العملية. يتناسب معدل التعطيل البكتيري مع تركيز FMN. الضوء البنفسجي أكثر كفاءة في تعطيل S. aureus من تشعيع الضوء الأزرق ، في حين أن الضوء الأحمر أو الأخضر لا يقود التحلل الضوئي FMN. توضح هذه المقالة التحلل الضوئي FMN كطريقة بسيطة وآمنة للعمليات الصحية.
Introduction
يتكون ريبوفلافين -5′-فوسفات (FMN) عن طريق الفسفرة في موضع الريبوفلافين 5′ من السلسلة الجانبية للريبيتيل وهو مطلوب من قبل جميع بروتينات الفلافوبروتينات للعديد من العمليات الخلوية لتوليد الطاقة. كما أنه يلعب دور فيتامين لبعض الوظائف في جسم الإنسان1. FMN أكثر قابلية للذوبان في الماء بحوالي 200 مرة من الريبوفلافين2.
يعد التعطيل الضوئي الديناميكي المضاد للبكتيريا (aPDI) للبكتيريا طريقة فعالة للتحكم في مقاومة البكتيريا 3,4 لأنه لا يعتمد على طريقة المقاومة البكتيرية. سريريا ، يستخدم aPDI لعلاج التهابات الأنسجة الرخوة من أجل تقليل إصابة جلد المستشفيات بسبب البكتيريا متعددة المقاومة5،6،7،8،9. ينتج aPDI أيضا موت الخلايا عن طريق توليد أنواع الأكسجين التفاعلية (ROS). ROS ، مثل جذور الأكسيد الفائق () ، والأكسجين المفرد ، وجذور الهيدروكسيل ( • OH) ، وجذور البيروكسيل ، هي جذور حرة أو جزيئات تحتوي على أكسجين تفاعلي10،11،12 وعادة ما تكون تفاعلية 13. على غرار تلف الحمض النووي الناجم عن أنواع الأكسجين التفاعلية ، فإن بيروكسيد الغشاء وتدمير الخلايا البطانية هي أيضا تفاعلات كيميائية حيوية ضارة تنسب إلى أنواع الأكسجين التفاعلية في الخلايا12.
• OH) ، وجذور البيروكسيل ، هي جذور حرة أو جزيئات تحتوي على أكسجين تفاعلي10،11،12 وعادة ما تكون تفاعلية 13. على غرار تلف الحمض النووي الناجم عن أنواع الأكسجين التفاعلية ، فإن بيروكسيد الغشاء وتدمير الخلايا البطانية هي أيضا تفاعلات كيميائية حيوية ضارة تنسب إلى أنواع الأكسجين التفاعلية في الخلايا12.
يتضمن استخدام aPDI للبكتيريا المسببة للأمراض مصدر ضوء مرئي أو UV لتعطيل الكائنات الحية الدقيقة في وجود مركبات كيميائية ، مثل كلوريد ميثيل ثيونينيوم 14 ، PEI-c e6 المتقارن 15 ، البورفيرين16 ، ثاني أكسيد التيتانيوم17 ، التولويدين الأزرق O 18 ، وجسيمات أكسيد الزنكالنانوية 19. التولويدين الأزرق O والأزرق الميثيلين هي أصباغ الفينوثيازينيوم والأزرق الميثيلين له خصائص سامة. ترتبط جسيمات أكسيد الزنك النانوية والأشعة فوق البنفسجية بالآثار الصحية والبيئية الضارة. على هذا النحو ، فإن استغلال محسس ضوئي موثوق وآمن وبسيط عن طريق التحلل الضوئي تحت الإشعاع المرئي يستحق مزيدا من الدراسة.
المغذيات الدقيقة ، الريبوفلافين أو FMN ، ليست سامة وتستخدم بالفعل لتصنيع الأغذية أو التغذية20. كل من FMN والريبوفلافين حساسان للغاية للإشعاع الخفيف2. تحت الأشعة فوق البنفسجية1،2،21،22،23 وتشعيع الضوء الأزرق10،24 ، يحقق هذان المركبان حالة مثارة. يتم ترقية الريبوفلافين المنشط أو FMN الذي يتم إنتاجه عن طريق التحلل الضوئي إلى حالته الثلاثية ويتم إنشاء ROS في وقت واحد 2,25. كومار وآخرون ذكرت أن الريبوفلافين الذي يتم تنشيطه بواسطة ضوء الأشعة فوق البنفسجية يسبب بشكل انتقائي زيادة إصابة مجموعة الجوانين من الحمض النووي في الكائنات الحية الدقيقة المسببة للأمراض26. تحت التشعيع بواسطة ضوء الأشعة فوق البنفسجية ، يظهر الريبوفلافين المنشط ضوئيا لتعزيز توليد 8-OH-dG ، وهو علامة حيوية للإجهاد التأكسدي ، في الحمض النوويالمزدوج 27. يذكر أن S. aureus و E. coli يتم إلغاء تنشيطهما بواسطة ROS أثناء التحلل الضوئي للريبوفلافين أو FMN10،24،28. أظهرت دراسة سابقة أجراها المؤلفون أن تفاعلات التحلل الضوئي التي تنطوي على الريبوفلافين و FMN تقلل من الكريستال البنفسجي وصبغة ثلاثي الميثان وعامل مضاد للبكتيريا يولد  ، ويزيل معظم القدرة المضادة للميكروبات للكريستال البنفسجي28. عندما يتم تشعيع فلافين الأدينين ثنائي النوكليوتيد أو FMN بالضوء الأزرق ، فإن أنواع الأكسجين التفاعلية الناتجة تنتج موت الخلايا المبرمج في خلايا هيلا لتسممها في المختبر29. باستخدام العلاج الكيميائي الضوئي في وجود الريبوفلافين ، Cui et al. الخلايا الليمفاوية المعطلة عن طريق تثبيط انتشارها وإنتاج السيتوكين30.
، ويزيل معظم القدرة المضادة للميكروبات للكريستال البنفسجي28. عندما يتم تشعيع فلافين الأدينين ثنائي النوكليوتيد أو FMN بالضوء الأزرق ، فإن أنواع الأكسجين التفاعلية الناتجة تنتج موت الخلايا المبرمج في خلايا هيلا لتسممها في المختبر29. باستخدام العلاج الكيميائي الضوئي في وجود الريبوفلافين ، Cui et al. الخلايا الليمفاوية المعطلة عن طريق تثبيط انتشارها وإنتاج السيتوكين30.
يستخدم التحلل الضوئي للريبوفلافين لتعطيل مسببات الأمراض في الدم بواسطة الأشعة فوق البنفسجية10،24 ، ولكن يمكن أن تضعف مكونات الدم تحت تشعيع الأشعة فوق البنفسجية30. ويذكر أيضا أن الصفائح الدموية المعرضة للأشعة فوق البنفسجية تعزز تدريجيا أداء علامات التنشيط P-selectin و LIMP-CD63 على أغشيتها. يجب التحقيق في السمية الخلوية للأشعة فوق البنفسجية والإشعاع عالي الكثافة ، وسيكون المحسس الضوئي غير المعقد والآمن أثناء التفاعل الضوئي FMN الذي يتضمن الضوء المرئي ذا فائدة كبيرة.
الضوء ذو الأطوال الموجية الأقصر لديه طاقة أكبر ومن المرجح أن يتسبب في أضرار جسيمة للخلايا. ومع ذلك ، في وجود محسس ضوئي مناسب ، يمكن أن يؤدي التشعيع بالضوء البنفسجي منخفض الكثافة إلى تثبيط الكائنات الحية الدقيقة المسببة للأمراض. وبالتالي ، فإن التحسس الضوئي وتوليد  FMN عند تشعيعه بالضوء البنفسجي مهم للدراسة ، من أجل تحديد المسار الذي يزيد به ROS من التحلل الضوئي FMN من تعطيل البكتيريا.
FMN عند تشعيعه بالضوء البنفسجي مهم للدراسة ، من أجل تحديد المسار الذي يزيد به ROS من التحلل الضوئي FMN من تعطيل البكتيريا.
تعد مكافحة مضادات الميكروبات مشكلة شائعة وكثيرا ما يستغرق تطوير مضادات حيوية جديدة عقودا. بعد التشعيع بالضوء البنفسجي ، يمكن للتنشيط الضوئي الذي يتوسطه FMN أن يقضي على البكتيريا المسببة للأمراض البيئية. تقدم هذه الدراسة بروتوكولا فعالا مضادا للميكروبات في المختبر باستخدام الضوء البنفسجي لقيادة التحلل الضوئي FMN وبالتالي توليد  aPDI. تستخدم الصلاحية الميكروبية للمكورات العنقودية الذهبية لتحديد جدوى aPDI الناجم عن FMN.
aPDI. تستخدم الصلاحية الميكروبية للمكورات العنقودية الذهبية لتحديد جدوى aPDI الناجم عن FMN.
Protocol
Representative Results
Discussion
يزيد المحسس الضوئي من التفاعل الكيميائي الضوئي للمركبات الكيميائية لتوليد أنواع الأكسجين التفاعلية (ROS). يمكن تعطيل الكائنات الحية الدقيقة المسببة للأمراض عن طريق التشعيع الخفيف في وجود محسسات ضوئية. تحدد هذه الدراسة aPDI للمكورات العنقودية الذهبية بسبب أنواع الأكسجين التفاعلية النا…
Disclosures
The authors have nothing to disclose.
Acknowledgements
يعرب المؤلفون عن امتنانهم للدكتور تاك واه وونغ والسيد تسونغ جي هسيه لدعمهما في التجارب.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

