Inaktivering av patogener via fotolyse i synlig lys av riboflavin-5′-fosfat
Summary
Her presenterer vi en protokoll for å inaktivere patogene bakterier med reaktive oksygenarter produsert under fotolyse av flavin mononukleotid (FMN) under bestråling av blått og fiolett lys med lav intensitet. FMN-fotolyse er vist å være en enkel og sikker metode for sanitære prosesser.
Abstract
Riboflavin-5′-fosfat (eller flavin mononukleotid; FMN) er følsom for synlig lys. Ulike forbindelser, inkludert reaktive oksygenarter (ROS), kan genereres fra FMN-fotolyse ved bestråling med synlig lys. ROS generert fra FMN-fotolyse er skadelig for mikroorganismer, inkludert patogene bakterier som Staphylococcus aureus (S. aureus). Denne artikkelen presenterer en protokoll for deaktivering av S. aureus, som et eksempel, via fotokjemiske reaksjoner som involverer FMN under bestråling av synlig lys. Superoksidradikalanionen () generert under FMN-fotolysen evalueres via reduksjon av nitroblått tetrazolium (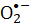 NBT). Den mikrobielle levedyktigheten til S. aureus som tilskrives reaktive
NBT). Den mikrobielle levedyktigheten til S. aureus som tilskrives reaktive 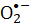 arter, ble brukt til å bestemme effektiviteten av prosessen. Den bakterielle inaktiveringshastigheten er proporsjonal med FMN-konsentrasjonen. Fiolett lys er mer effektivt ved å inaktivere S. aureus enn bestråling av blått lys, mens det røde eller grønne lyset ikke driver FMN-fotolyse. Denne artikkelen demonstrerer FMN-fotolyse som en enkel og sikker metode for sanitære prosesser.
arter, ble brukt til å bestemme effektiviteten av prosessen. Den bakterielle inaktiveringshastigheten er proporsjonal med FMN-konsentrasjonen. Fiolett lys er mer effektivt ved å inaktivere S. aureus enn bestråling av blått lys, mens det røde eller grønne lyset ikke driver FMN-fotolyse. Denne artikkelen demonstrerer FMN-fotolyse som en enkel og sikker metode for sanitære prosesser.
Introduction
Riboflavin-5′-fosfat (FMN) dannes ved fosforylering ved riboflavin 5′-posisjonen til ribityl-sidekjeden og kreves av alle flavoproteiner for mange cellulære prosesser for å generere energi. Det spiller også rollen som vitamin for noen funksjoneri menneskekroppen. FMN er omtrent 200 ganger mer løselig i vann enn riboflavin2.
Den antibakterielle fotodynamiske inaktiveringen (aPDI) av bakterier er en effektiv måte å kontrollere resistens mot bakterier 3,4 fordi den ikke er avhengig av modusen for bakteriell resistens. Klinisk brukes aPDI til å behandle bløtvevsinfeksjoner for å redusere infeksjon av nosokomial hud på grunn av multiresistente bakterier 5,6,7,8,9. aPDI produserer også celledød ved å generere reaktive oksygenarter (ROS). ROS, som superoksidradikaler (), singlet oksygen, hydroksylradikaler ( •OH) og peroksylradikaler, er frie radikaler eller molekyler som inneholder reaktivt oksygen 10,11,12 og er normalt reaktive 13. I likhet med DNA-skade som er forårsaket av ROS, er membranperoksydasjon og ødeleggelse av endotelceller også uønskede biokjemiske reaksjoner som tilskrives ROS i celler12.
•OH) og peroksylradikaler, er frie radikaler eller molekyler som inneholder reaktivt oksygen 10,11,12 og er normalt reaktive 13. I likhet med DNA-skade som er forårsaket av ROS, er membranperoksydasjon og ødeleggelse av endotelceller også uønskede biokjemiske reaksjoner som tilskrives ROS i celler12.
Bruken av aPDI for patogene bakterier innebærer en synlig eller UV-lyskilde for å inaktivere mikroorganismer i nærvær av kjemiske forbindelser, slik som metyltioniniumklorid 14, PEI-ce6 konjugat 15, porfyrin 16, titandioksid 17, toluidinblåttO18 og sinkoksid nanopartikler 19. Toluidinblå O og metylenblå er fenotiaziniumfarger og metylenblå har giftige egenskaper. Sinkoksid nanopartikler og UV-bestråling er knyttet til negative helse- og miljøeffekter. Som sådan fortjener utnyttelsen av en pålitelig, sikker og enkel fotosensibilisator via fotolyse under synlig bestråling videre studier.
Mikronæringsstoffet, riboflavin eller FMN, er ikke giftig og brukes faktisk til matproduksjon eller fôring20. Både FMN og riboflavin er svært følsomme for lysbestråling2. Under UV 1,2,21,22,23 og blålysbestråling 10,24 oppnår disse to forbindelsene en eksitert tilstand. Den aktiverte riboflavin eller FMN som produseres ved fotolyse fremmes til sin tripletttilstand og ROS genereres samtidig 2,25. Kumar og medarbeidere rapporterte at riboflavin aktivert av UV-lys selektivt forårsaker økt skade på guanindelen av DNA i patogene mikroorganismer26. Under bestråling av UV-lys er fotodynamisk aktivert riboflavin demonstrert for å fremme genereringen av 8-OH-dG, som er en biomarkør for oksidativt stress, i dobbeltstrenget DNA27. Det er rapportert at S. aureus og E. coli deaktiveres av ROS under riboflavin eller FMN fotolyse 10,24,28. En tidligere studie av forfatterne viste at de fotolytiske reaksjonene som involverer riboflavin og FMN reduserer krystallfiolett, et triarylmetanfargestoff og et antibakterielt middel som genererer  , og eliminerer det meste av den antimikrobielle evnen til krystallfiolett28. Når flavin adenin dinukleotid eller FMN bestråles av blått lys, produserer den resulterende ROS apoptose i HeLa-celler for forgiftning in vitro29. Ved bruk av fotokjemisk behandling i nærvær av riboflavin inaktiverte Cui og medarbeidere lymfocytter ved å hemme deres proliferasjon og cytokinproduksjon30.
, og eliminerer det meste av den antimikrobielle evnen til krystallfiolett28. Når flavin adenin dinukleotid eller FMN bestråles av blått lys, produserer den resulterende ROS apoptose i HeLa-celler for forgiftning in vitro29. Ved bruk av fotokjemisk behandling i nærvær av riboflavin inaktiverte Cui og medarbeidere lymfocytter ved å hemme deres proliferasjon og cytokinproduksjon30.
Fotolysen av riboflavin brukes til inaktivering av blodpatogen ved UV 10,24, men blodkomponenter kan svekkes under UV-lysbestråling30. Det er også rapportert at blodplater utsatt for UV gradvis forbedrer ytelsen til aktiveringsmarkørene P-selectin og LIMP-CD63 på membranene. Cytotoksisiteten til UV og høyintensitetsbestråling må undersøkes, og en fotosensibilisator som er ukomplisert og sikker under en FMN-fotoreaksjon som involverer synlig lys, vil være til stor nytte.
Lys med kortere bølgelengder har mer energi og er mye mer sannsynlig å forårsake alvorlig skade på celler. Men i nærvær av en egnet fotosensibilisator kan bestråling med fiolett lys med lav intensitet hemme patogene mikroorganismer. Fotosensibiliseringen og genereringen av av FMN når den bestråles med fiolett lys er derfor viktig å studere, for å bestemme banen som ROS fra FMN-fotolyse øker inaktiveringen av  bakterier.
bakterier.
Antimikrobiell kontroll er et vanlig problem, og utviklingen av nye antibiotika tar ofte flere tiår. Etter bestråling med fiolett lys kan fotoinaktivering som formidles av FMN tilintetgjøre miljøpatogene bakterier. Denne studien presenterer en effektiv antimikrobiell protokoll in vitro ved bruk av fiolett lys for å drive FMN-fotolyse og dermed generere  for aPDI. Den mikrobielle levedyktigheten til S. aureus brukes til å bestemme muligheten for FMN-indusert aPDI.
for aPDI. Den mikrobielle levedyktigheten til S. aureus brukes til å bestemme muligheten for FMN-indusert aPDI.
Protocol
Representative Results
Discussion
En fotosensibilisator øker den fotokjemiske reaksjonen av kjemiske forbindelser for å generere ROS. Patogene mikroorganismer kan inaktiveres ved lysbestråling i nærvær av fotosensibilisatorer. Denne studien bestemmer aPDI av S. aureus på grunn av ROS generert av fiolett lysbestråling av en eksogen fotosensibilisator, FMN.
Som vist i figur 3, for FMN, reduseres absorbansen ved 444 nm signifikant etter 5 minutters bestråling ved bruk av fiolett elle…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne er takknemlige for Dr. Tak-Wah Wong og Mr. Zong-Jhe Hsieh for deres støtte med eksperimenter.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

