Атомно-силовая микроскопия для изучения физических свойств эпидермальных клеток живых корней арабидопсиса
Summary
Протокол отступа атомно-силовой микроскопии дает возможность препарировать роль физических свойств клеточной стенки конкретной клетки ткани или органа во время нормального или ограниченного роста (т.е. при дефиците воды).
Abstract
Здесь описан способ охарактеризовать физические свойства клеточной стенки эпидермальных клеток живых корней арабидопсиса посредством наноиндентов с помощью атомно-силового микроскопа (АСМ) в сочетании с оптическим инвертированным флуоресцентным микроскопом. Метод заключается в приложении контролируемых сил к образцу при измерении его деформации, что позволяет количественно оценить такие параметры, как кажущийся модуль Юнга клеточных стенок при субклеточных разрешениях. Это требует тщательной механической иммобилизации образца и правильного подбора инденторов и глубин углублений. Хотя он может быть использован только во внешних тканях, этот метод позволяет охарактеризовать механические изменения клеточных стенок растений во время развития и позволяет соотнести эти микроскопические изменения с ростом целого органа.
Introduction
Растительные клетки окружены клеточной стенкой, которая представляет собой сложную структуру, состоящую из взаимодействующих сетей полисахаридов, белков, метаболитов и воды, толщина которой варьируется от 0,1 до нескольких мкм в зависимости от типа клетки и фазы роста 1,2. Механические свойства клеточной стенки играют существенную роль в росте растений. Низкие значения жесткости клеточной стенки были предложены в качестве предварительного условия для роста клеток и расширения клеточной стенки, и появляется все больше доказательств того, что все клетки ощущают механические силы для выполнения своих функций. Тем не менее, до сих пор обсуждается, определяет ли изменение физических свойств клеточной стенки судьбу клетки 2,3,4. Поскольку растительные клетки не движутся во время развития, окончательная форма органа зависит от того, как далеко и в каком направлении расширяется клетка. Таким образом, корень Arabidopsis является хорошей моделью для изучения влияния физических свойств клеточной стенки на расширение клеток, поскольку различные типы расширения происходят в разных областях корня. Например, анизотропное расширение проявляется в зоне удлинения и особенно заметно в клетках эпидермиса5.
Описанный здесь способ был использован для характеристики физических свойств клеточной стенки эпидермальных клеток на наноуровне живых корней арабидопсиса с использованием атомно-силового микроскопа (АСМ) в сочетании с инвертированным флуоресцентным фазовым микроскопом6. Вместо обширного пересмотра метода AFM читать 7,8,9.
Этот протокол описывает базовый метод подготовки образцов и общий метод измерения эластичности клеточных стенок растений на основе AFM.
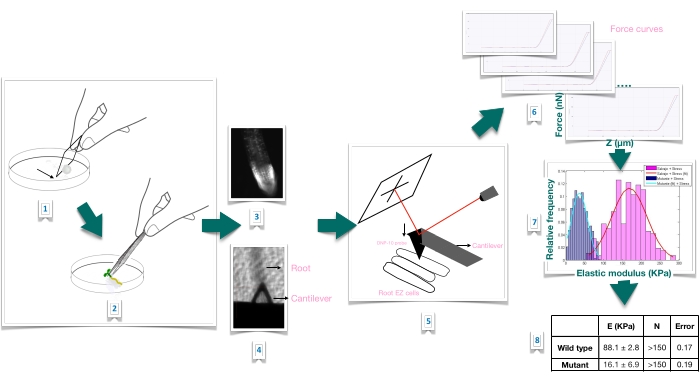
Рисунок 1: Схематический обзор эксперимента по силовому отступу в корнях Arabidopsis с использованием атомно-силовой микроскопии (AFM). Схема дает обзор этапов эксперимента по силовому углублению от подготовки субстрата для прочной иммобилизации образца корня (1-2), подтверждения жизнеспособности корня через окрашивание йодида пропидия (3), консольного позиционирования на поверхности удлиненной эпидермальной клетки первичного корня (4-5), измерения кривых силы (6) и обработки кривой силы для расчета кажущегося модуля Юнга (7-8). EZ: зона удлинения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Механика клеток и клеточных стенок становится все более актуальной, чтобы получить представление о том, как механика влияет на процессы роста. Поскольку физические силы распространяются на значительные расстояния в твердых тканях, изучение изменений физических свойств клеточной сте?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование финансировалось CSIC I+D 2018, грант No 95 (Мариана Сотело Силвейра).; CSIC Grupos (Омар Борсани) и PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

