화학 이미징을 위한 하이퍼스펙트럼 자극 라만 산란 및 일관된 안티스토크스 라만 산란 현미경의 직접 비교
Summary
이 논문은 동일한 현미경 플랫폼에 통합 된 자극 된 라만 산란 (SRS)과 일관된 스토크스 라만 산란 (CARS)의 해상도, 감도 및 이미징 대비를 직접 비교합니다. 결과는 CARS가 더 나은 공간 분해능을 가지며, SRS는 더 나은 콘트라스트와 스펙트럼 분해능을 제공하며, 두 방법 모두 비슷한 감도를 가지고 있음을 보여줍니다.
Abstract
자극된 라만 산란(SRS) 및 일관된 스토크스 라만 산란(CARS) 현미경은 가장 널리 사용되는 일관된 라만 산란 영상 기술입니다. 하이퍼스펙트럼 SRS 및 CARS 이미징은 모든 픽셀에서 라만 스펙트럼 정보를 제공하므로 다양한 화학 성분을 더 잘 분리할 수 있습니다. 두 기술 모두 두 개의 여기 레이저가 필요하지만 신호 감지 체계와 스펙트럼 특성은 상당히 다릅니다. 이 프로토콜의 목표는 단일 플랫폼에서 하이퍼스펙트럼 SRS 및 CARS 이미징을 모두 수행하고 서로 다른 생물학적 샘플을 이미징하기 위한 두 현미경 기술을 비교하는 것입니다. 스펙트럼 초점 방법은 펨토초 레이저를 사용하여 스펙트럼 정보를 획득하기 위해 사용된다. 표준 화학 샘플을 사용함으로써, 동일한 여기 조건(즉, 샘플에서의 전력, 픽셀 체류 시간, 대물 렌즈, 펄스 에너지)에서 SRS 및 CARS의 감도, 공간 분해능 및 스펙트럼 분해능을 비교한다. 생물학적 샘플에 대한 CARS 및 SRS의 이미징 콘트라스트는 병치되고 비교됩니다. CARS와 SRS 성능을 직접 비교하면 화학 이미징을위한 양식을 최적으로 선택할 수 있습니다.
Introduction
라만 산란 현상은 1928년 C. V. 라만1에 의해 처음 관찰되었다. 입사 광자가 샘플과 상호 작용할 때, 비탄성 산란 사건이 자발적으로 발생할 수 있으며, 여기서 광자의 에너지 변화는 분석 된 화학 종의 진동 전이와 일치합니다. 이 공정은 화학 태그를 사용할 필요가 없으므로 시료 교란을 최소화하면서 화학 분석을위한 다용도의 라벨이없는 도구입니다. 장점에도 불구하고, 자발적인 라만 산란은 낮은 산란 단면 (일반적으로 적외선 [IR] 흡수 단면보다10,11 낮음)을 앓고 있으며, 이는 분석2를 위해 긴 획득 시간을 필요로합니다. 따라서, 라만 산란 공정의 감도를 증가시키기 위한 탐구는 실시간 이미징을 위한 라만 기술을 추진하는데 필수적이다.
라만 산란의 감도를 크게 향상시키는 한 가지 효과적인 방법은 일관된 라만 산란 (CRS) 프로세스를 사용하는 것이며, 일반적으로 두 개의 레이저 펄스가 분자 진동 전이 3,4를 자극하는 데 사용됩니다. 두 레이저 사이의 광자 에너지 차이가 샘플 분자의 진동 모드와 일치하면 강한 라만 신호가 생성됩니다. 이미징을 위해 가장 일반적으로 사용되는 두 가지 CRS 프로세스는 일관된 안티 스토크스 라만 산란 (CARS)과 자극 라만 산란 (SRS)5입니다. 지난 이십 년 동안 기술 개발은 CARS 및 SRS 현미경 검사 기술을 발전시켜 생물학적 샘플의 화학적 변화에 대한 라벨 없는 정량화 및 해명을위한 강력한 도구가되었습니다.
CARS 현미경에 의한 화학 이미징은 Duncan et al6에 의해 입증 된 CARS 이미지를 얻기 위해 레이저 스캐닝이 처음 적용되었을 때 1982 년으로 거슬러 올라갈 수 있습니다. CARS 현미경의 현대화는 레이저 스캐닝 다중 광자 형광 현미경7의 광범위한 적용 후에 크게 가속화되었습니다. 높은 반복률 레이저를 사용하는 Xie 그룹의 초기 연구는 CARS를 생물학적 샘플 8,9,10에서 분자의 특성화를위한 고속, 라벨이없는 화학 이미징 플랫폼으로 전환했습니다. CARS 이미징의 주요 문제 중 하나는 비공진 배경의 존재로 이미지 대비가 감소하고 라만 스펙트럼이 왜곡된다는 것입니다. 비공진 배경 11,12,13,14,15를 감소시키거나 CARS 스펙트럼(16,17)으로부터 공진 라만 신호를 추출하기 위해 많은 노력이 이루어졌다. 이 분야를 크게 발전시킨 또 다른 발전은 하이퍼 스펙트럼 CARS 이미징으로, 화학적 선택성18,19,20,21이 향상된 각 이미지 픽셀에서 스펙트럼 매핑을 허용합니다.
자극 라만 산란 (SRS)은 CARS보다 젊은 이미징 기술이지만22 년 초에 발견되었습니다. 2007년에, SRS 현미경은 낮은 반복률 레이저 소스(23)를 사용하여 보고되었다. 곧, 몇몇 그룹은 높은 반복률 레이저24,25,26을 사용하여 고속 SRS 이미징을 시연했습니다. CARS에 대한 SRS 현미경 검사의 주요 장점 중 하나는 비공진 배경(27)의 부재이지만, 교차 위상 변조(XPM), 과도 흡수(TA), 이광자 흡수(TPA) 및 광열(PT) 효과와 같은 다른 배경은 SRS(28)에서 발생할 수 있다. 또한, SRS 신호 및 샘플 농도는 CARS와 달리 선형 관계를 가지며, 이는 직교 신호-농도 의존성(29)을 갖는다. 이것은 화학적 정량화와 스펙트럼 언믹싱을 단순화합니다. 다색 및 하이퍼스펙트럼 SRS는 30,31,32,33,34,35,36 형태로 진화해 왔으며, 스펙트럼 초점은 화학 이미징 37,38에 대한 가장 보편적인 접근법 중 하나이다.
CARS와 SRS 모두 신호 여기를 위한 분자의 진동 전이와 일치하도록 펌프와 스토크스 레이저 빔을 샘플에 집중해야 합니다. CARS 및 SRS 현미경도 공통점이 많습니다. 그러나 이러한 두 프로세스의 근간이 되는 물리학과 이러한 현미경 기술에 관련된 신호 검출은3,39의 불균형을 가지고 있습니다. CARS는 순 광자-분자 에너지 커플링3을 갖지 않는 파라메트릭 공정이다. 그러나, SRS는 비모수 프로세스이며, 광자와 분자 시스템(27) 사이의 에너지 전달에 기여한다. CARS에서는 스토크스 방지 주파수에서 새로운 신호가 생성되고, SRS는 펌프와 스토크스 레이저 빔 사이의 에너지 전달로 나타납니다.
CARS 신호는 Eq (1)28을 만족한다.
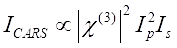 (1)
(1)
한편, SRS 신호는 Eq(2)28로서 기입될 수 있다.
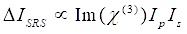 (2)
(2)
여기서, I p, Is, I CARS 및 ΔI SRS는 각각 펌프 빔, 스토크스 빔, CARS 신호 및 SRS 신호의 강도이다. χ(3)은 샘플의 3차 비선형 광학 감수성이며, 실제 및 허수 부분으로 구성된 복합 값입니다.
이들 방정식은 CARS 및 SRS의 스펙트럼 프로파일과 신호-농도 의존성을 표현한다. 물리학의 차이는이 두 현미경 기술에 대한 이질적인 검출 체계를 초래합니다. CARS에서의 신호 검출은 일반적으로 새로 생성된 광자의 스펙트럼 분리 및 광승수 튜브(PMT) 또는 전하 결합 장치(CCD)를 사용한 검출을 포함한다. SRS의 경우, 펌프와 스토크스 빔 사이의 에너지 교환은 일반적으로 광 변조기를 사용하는 고속 강도 변조 및 록인 증폭기와 페어링된 광 다이오드(PD)를 사용한 복조로 측정됩니다.
최근 몇 년 동안 CARS 및 SRS 분야에서 많은 기술 개발 및 응용 프로그램이 발표되었지만 두 CRS 기술에 대한 체계적인 비교는 동일한 플랫폼, 특히 하이퍼 스펙트럼 CARS 및 SRS 현미경에 대해 수행되지 않았습니다. 감도, 공간 분해능, 스펙트럼 분해능 및 화학적 분리 능력을 직접 비교하면 생물학자가 화학 정량화에 가장 적합한 형식을 선택할 수 있습니다. 이 프로토콜에서는 펨토초 레이저 시스템 및 스펙트럼 포커싱을 기반으로 하이퍼스펙트럼 CARS 및 SRS 형식을 모두 갖춘 멀티모달 이미징 플랫폼을 구축하기 위한 상세한 단계가 제공됩니다. 두 기술은 스펙트럼 해상도, 검출 감도, 공간 해상도 및 세포의 이미징 대비를 위해 전진 방향으로 비교되었습니다.
Protocol
Representative Results
Discussion
여기에 제시된 프로토콜은 다중 모드 CRS 현미경의 구축과 CARS와 SRS 이미징 간의 직접적인 비교를 설명합니다. 현미경 제작의 중요한 단계는 공간 및 시간적 빔 중첩 및 빔 크기 최적화입니다. SNR을 최적화하고 라만 이동을 교정하기 위해 생물학적 이미징 전에 DMSO와 같은 표준 샘플을 사용하는 것이 좋습니다. CARS와 SRS 이미지를 직접 비교하면 CARS가 더 나은 공간 해상도를 갖는 반면, SRS는 더 나은 …
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 퍼듀 대학 화학과 스타트업 펀드의 지원을 받았다.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

