Comparación directa de la dispersión Raman estimulada hiperespectral y la microscopía de dispersión Raman antiespecial coherente para imágenes químicas
Summary
Este artículo compara directamente la resolución, la sensibilidad y los contrastes de imagen de la dispersión Raman estimulada (SRS) y la dispersión Raman anti-Stokes coherente (CARS) integradas en la misma plataforma de microscopio. Los resultados muestran que CARS tiene una mejor resolución espacial, SRS da mejores contrastes y resolución espectral, y ambos métodos tienen una sensibilidad similar.
Abstract
La dispersión Raman estimulada (SRS) y la microscopía coherente de dispersión Raman anti-Stokes (CARS) son las tecnologías de imágenes de dispersión Raman coherente más utilizadas. Las imágenes hiperespectrales SRS y CARS ofrecen información espectral Raman en cada píxel, lo que permite una mejor separación de las diferentes composiciones químicas. Aunque ambas técnicas requieren dos láseres de excitación, sus esquemas de detección de señales y propiedades espectrales son bastante diferentes. El objetivo de este protocolo es realizar imágenes hiperespectrales SRS y CARS en una sola plataforma y comparar las dos técnicas de microscopía para obtener imágenes de diferentes muestras biológicas. El método de enfoque espectral se emplea para adquirir información espectral utilizando láseres de femtosegundo. Mediante el uso de muestras químicas estándar, se comparan la sensibilidad, la resolución espacial y la resolución espectral de SRS y CARS en las mismas condiciones de excitación (es decir, potencia en la muestra, tiempo de permanencia de píxeles, lente objetivo, energía de pulso). Los contrastes de imagen de CARS y SRS para muestras biológicas se yuxtaponen y comparan. La comparación directa de los rendimientos de CARS y SRS permitiría una selección óptima de la modalidad de imagen química.
Introduction
El fenómeno de dispersión Raman fue observado por primera vez en 1928 por C. V. Raman1. Cuando un fotón incidente está interactuando con una muestra, puede ocurrir espontáneamente un evento de dispersión inelástica, en el que el cambio de energía del fotón coincide con una transición vibratoria de la especie química analizada. Este proceso no requiere el uso de una etiqueta química, por lo que es una herramienta versátil y sin etiquetas para el análisis químico al tiempo que minimiza la perturbación de la muestra. A pesar de sus ventajas, la dispersión Raman espontánea sufre de una sección transversal de dispersión baja (típicamente 1011 más baja que la sección transversal de absorción infrarroja [IR]), lo que requiere largos tiempos de adquisición para el análisis2. Por lo tanto, la búsqueda de aumentar la sensibilidad del proceso de dispersión Raman es esencial para impulsar las tecnologías Raman para obtener imágenes en tiempo real.
Una forma efectiva de mejorar en gran medida la sensibilidad de la dispersión Raman es a través de procesos coherentes de dispersión Raman (CRS), para los cuales generalmente se utilizan dos pulsos láser para excitar transiciones vibracionales moleculares 3,4. Cuando la diferencia de energía de fotones entre los dos láseres coincide con los modos vibratorios de las moléculas de muestra, se generarán fuertes señales Raman. Los dos procesos CRS más utilizados para la obtención de imágenes son la dispersión Raman anti-Stokes coherente (CARS) y la dispersión Raman estimulada (SRS)5. En las últimas dos décadas, los desarrollos tecnológicos han avanzado las técnicas de microscopía CARS y SRS para convertirse en herramientas poderosas para la cuantificación y elucidación sin etiquetas de los cambios químicos en muestras biológicas.
Las imágenes químicas por microscopía CARS se pueden fechar en 1982, cuando el escaneo láser se aplicó por primera vez para adquirir imágenes CARS, demostrado por Duncan et al6. La modernización de la microscopía CARS se aceleró enormemente después de las amplias aplicaciones de la microscopía de fluorescencia multifotónica de barrido láser7. Los primeros trabajos del grupo Xie utilizando láseres de alta tasa de repetición han hecho que CARS sea una plataforma de imágenes químicas de alta velocidad, sin etiquetas, para la caracterización de moléculas en muestras biológicas 8,9,10. Uno de los principales problemas para las imágenes CARS es la presencia de un fondo no resonante, lo que reduce el contraste de la imagen y distorsiona el espectro Raman. Se han hecho muchos esfuerzos para reducir el fondo no resonante 11,12,13,14,15 o para extraer señales Raman resonantes de los espectros CARS 16,17. Otro avance que ha avanzado mucho en el campo es la imagen hiperespectral CARS, que permite el mapeo espectral en cada píxel de imagen con una selectividad química mejorada 18,19,20,21.
La dispersión Raman estimulada (SRS) es una tecnología de imagen más joven que CARS, aunque se descubrió antes22. En 2007, se informó de microscopía SRS utilizando una fuente láser de baja tasa de repetición23. Pronto, varios grupos demostraron imágenes SRS de alta velocidad utilizando láseres de alta tasa de repetición 24,25,26. Una de las principales ventajas de la microscopía SRS sobre CARS es la ausencia del fondo no resonante27, aunque otros fondos como la modulación de fase cruzada (XPM), la absorción transitoria (TA), la absorción de dos fotones (TPA) y el efecto fototérmico (PT), pueden ocurrir con SRS28. Además, la señal SRS y la concentración de la muestra tienen relaciones lineales, a diferencia de CARS, que tiene una dependencia cuadrática de concentración de señal29. Esto simplifica la cuantificación química y la desmezcla espectral. El SRS multicolor e hiperespectral ha evolucionado en diferentes formas 30,31,32,33,34,35,36, siendo el enfoque espectral uno de los enfoques más populares para la obtención de imágenes químicas 37,38.
Tanto CARS como SRS requieren el enfoque de la bomba y los rayos láser Stokes en la muestra para que coincida con la transición vibratoria de las moléculas para la excitación de la señal. Los microscopios CARS y SRS también comparten mucho en común. Sin embargo, la física subyacente a estos dos procesos, y las detecciones de señales involucradas en estas tecnologías de microscopía tienen disparidades 3,39. CARS es un proceso paramétrico que no tiene acoplamiento neto de energía fotón-molécula3. SRS, sin embargo, es un proceso no paramétrico, y contribuye a la transferencia de energía entre fotones y sistemas moleculares27. En CARS, se genera una nueva señal a frecuencia anti-Stokes, mientras que SRS se manifiesta como la transferencia de energía entre la bomba y los rayos láser stokes.
La señal CARS satisface Eq (1)28.
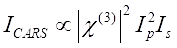 (1)
(1)
Mientras tanto, la señal SRS se puede escribir como Eq (2)28.
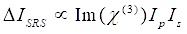 (2)
(2)
Aquí, Ip, Is, ICARS y ΔISRS son las intensidades del haz de la bomba, el haz de Stokes, la señal CARS y las señales SRS, respectivamente. χ(3) es la susceptibilidad óptica no lineal de tercer orden de la muestra, y es un valor complejo compuesto de partes reales e imaginarias.
Estas ecuaciones expresan los perfiles espectrales y la dependencia de la concentración de señal de CARS y SRS. Las diferencias en la física dan como resultado esquemas de detección dispares para estas dos tecnologías de microscopía. La detección de señales en CARS generalmente implica la separación espectral de fotones recién generados y la detección utilizando un tubo fotomultiplicador (PMT) o un dispositivo de carga acoplada (CCD); para SRS, el intercambio de energía entre la bomba y los haces de Stokes generalmente se mide mediante modulación de intensidad de alta velocidad utilizando un modulador óptico y demodulación utilizando un fotodiodo (PD) emparejado con un amplificador de bloqueo.
Aunque en los últimos años se han publicado muchos desarrollos y aplicaciones tecnológicas en los campos CARS y SRS, no se han realizado comparaciones sistemáticas de las dos técnicas CRS en la misma plataforma, especialmente para CARS hiperespectrales y microscopía SRS. Las comparaciones directas en sensibilidad, resolución espacial, resolución espectral y capacidades de separación química permitirían a los biólogos seleccionar la mejor modalidad para la cuantificación química. En este protocolo, se proporcionan pasos detallados para construir una plataforma de imágenes multimodales con modalidades hiperespectrales CARS y SRS basadas en un sistema láser de femtosegundo y enfoque espectral. Las dos técnicas se han comparado en la dirección hacia adelante para la resolución espectral, la sensibilidad de detección, la resolución espacial y los contrastes de imágenes de las células.
Protocol
Representative Results
Discussion
El protocolo presentado aquí describe la construcción de un microscopio CRS multimodal y la comparación directa entre CARS y SRS imaging. Para la construcción del microscopio, los pasos críticos son la superposición espacial y temporal del haz y la optimización del tamaño del haz. Se recomienda utilizar una muestra estándar como DMSO antes de la imagen biológica para optimizar el SNR y calibrar los turnos Raman. La comparación directa entre las imágenes CARS y SRS revela que CARS tiene una mejor resolución e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada por el fondo de inicio del Departamento de Química de la Universidad de Purdue.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

