Direkte sammenligning af hyperspektral stimuleret Raman-spredning og sammenhængende anti-stokes Raman-spredningsmikroskopi til kemisk billeddannelse
Summary
Dette papir sammenligner direkte opløsning, følsomhed og billedkontraster af stimuleret Raman-spredning (SRS) og sammenhængende anti-Stokes Raman-spredning (CARS) integreret i den samme mikroskopplatform. Resultaterne viser, at CARS har en bedre rumlig opløsning, SRS giver bedre kontraster og spektral opløsning, og begge metoder har samme følsomhed.
Abstract
Stimuleret Raman-spredning (SRS) og sammenhængende anti-Stokes Raman-spredning (CARS) mikroskopi er de mest anvendte sammenhængende Raman-spredningsteknologier. Hyperspektral SRS- og CARS-billeddannelse tilbyder Raman-spektral information ved hver pixel, hvilket muliggør bedre adskillelse af forskellige kemiske sammensætninger. Selvom begge teknikker kræver to excitationslasere, er deres signaldetekteringsordninger og spektrale egenskaber helt forskellige. Målet med denne protokol er at udføre både hyperspektral SRS- og CARS-billeddannelse på en enkelt platform og sammenligne de to mikroskopiteknikker til billeddannelse af forskellige biologiske prøver. Den spektrale fokuseringsmetode anvendes til at erhverve spektral information ved hjælp af femtosekundlasere. Ved at bruge standard kemiske prøver sammenlignes følsomheden, rumlig opløsning og spektralopløsning af SRS og CARS under de samme exciteringsforhold (dvs. effekt ved prøven, pixelopholdstid, objektiv linse, pulsenergi). Billedkontrastene for CARS og SRS for biologiske prøver sidestilles og sammenlignes. Den direkte sammenligning af CARS- og SRS-præstationer ville give mulighed for optimal udvælgelse af modaliteten til kemisk billeddannelse.
Introduction
Raman-spredningsfænomenet blev først observeret i 1928 af C. V. Raman1. Når en hændelsesfoton interagerer med en prøve, kan der spontant forekomme en uelastisk spredningshændelse, hvor fotonens energiændring matcher en vibrationsovergang af den analyserede kemiske art. Denne proces kræver ikke brug af et kemisk mærke, hvilket gør det til et alsidigt, etiketfrit værktøj til kemisk analyse, samtidig med at prøveforstyrrelser minimeres. På trods af sine fordele lider spontan Raman-spredning af et lavt spredningstværsnit (typisk 1011 lavere end det infrarøde [IR] absorptionstværsnit), hvilket nødvendiggør lange anskaffelsestider for analyse2. Således er søgen efter at øge følsomheden af Raman-spredningsprocessen afgørende for at skubbe Raman-teknologier til billeddannelse i realtid.
En effektiv måde at forbedre følsomheden af Raman-spredning i høj grad er gennem sammenhængende Raman-spredningsprocesser (CRS), for hvilke to laserimpulser typisk bruges til at excitere molekylære vibrationsovergange 3,4. Når fotonenergiforskellen mellem de to lasere matcher prøvemolekylernes vibrationstilstande, genereres stærke Raman-signaler. De to mest almindeligt anvendte CRS-processer til billeddannelse er sammenhængende anti-Stokes Raman-spredning (CARS) og stimuleret Raman-spredning (SRS)5. I løbet af de sidste to årtier har den teknologiske udvikling avanceret CARS- og SRS-mikroskopiteknikker til at blive kraftfulde værktøjer til mærkningsfri kvantificering og belysning af kemiske ændringer i biologiske prøver.
Kemisk billeddannelse ved CARS mikroskopi kan dateres til 1982, da laserscanning først blev anvendt til at erhverve CARS-billeder, demonstreret af Duncan et al6. Moderniseringen af CARS-mikroskopi blev kraftigt fremskyndet efter de brede anvendelser af laserscanning multiphoton fluorescensmikroskopi7. Tidligt arbejde fra Xie-gruppen ved hjælp af lasere med høj gentagelseshastighed har overført CARS til at være en højhastigheds, etiketfri, kemisk billeddannelsesplatform til karakterisering af molekyler i biologiske prøver 8,9,10. Et af de største problemer for CARS-billeddannelse er tilstedeværelsen af en ikke-resonant baggrund, hvilket reducerer billedkontrasten og forvrænger Raman-spektret. Der er gjort mange bestræbelser på enten at reducere den ikke-resonante baggrund 11,12,13,14,15 eller at udtrække resonans Raman-signaler fra CARS-spektrene 16,17. Et andet fremskridt, der i høj grad har avanceret feltet, er hyperspektral CARS-billeddannelse, som giver mulighed for spektral kortlægning ved hver billedpixel med forbedret kemisk selektivitet 18,19,20,21.
Stimuleret Raman spredning (SRS) er en yngre billeddannelsesteknologi end CARS, selvom den blev opdaget tidligere22. I 2007 blev SRS-mikroskopi rapporteret ved hjælp af en laserkilde med lav gentagelseshastighed23. Snart demonstrerede flere grupper højhastigheds SRS-billeddannelse ved hjælp af lasere med høj gentagelseshastighed 24,25,26. En af de største fordele ved SRS-mikroskopi i forhold til CARS er fraværet af den ikke-resonante baggrund27, selvom andre baggrunde såsom tværfasemodulation (XPM), forbigående absorption (TA), to-fotonabsorption (TPA) og fototermisk (PT) effekt kan forekomme med SRS28. Derudover har SRS-signalet og prøvekoncentrationen lineære forhold, i modsætning til CARS, som har en kvadratisk signalkoncentrationsafhængighed29. Dette forenkler kemisk kvantificering og spektral ublanding. Flerfarvet og hyperspektral SRS har udviklet sig i forskellige former 30,31,32,33,34,35,36, hvor spektralfokusering er en af de mest populære tilgange til kemisk billeddannelse 37,38.
Både CARS og SRS kræver fokusering af pumpen og Stokes laserstråler på prøven for at matche molekylernes vibrationsovergang til signal excitation. CARS og SRS mikroskoper deler også meget til fælles. Imidlertid har fysikken bag disse to processer og signaldetektioner involveret i disse mikroskopiteknologier forskelle 3,39. CARS er en parametrisk proces, der ikke har netto fotonmolekyle energikobling3. SRS er imidlertid en ikke-parametrisk proces og bidrager til energioverførsel mellem fotoner og molekylære systemer27. I CARS genereres et nyt signal ved anti-Stokes-frekvens, mens SRS manifesterer sig som energioverførslen mellem pumpen og Stokes laserstråler.
CARS signal opfylder Eq (1)28.
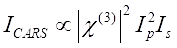 (1)
(1)
I mellemtiden kan SRS-signal skrives som Eq (2)28.
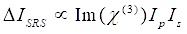 (2)
(2)
Her er Ip, Is, ICARS og ΔISRS intensiteten af henholdsvis pumpebjælken, Stokes-strålen, CARS-signalet og SRS-signalerne. χ(3) er prøvens tredjeordens ikke-lineære optiske modtagelighed og er en kompleks værdi sammensat af reelle og imaginære dele.
Disse ligninger udtrykker spektralprofilerne og signalkoncentrationsafhængigheden af CARS og SRS. Forskelle i fysik resulterer i forskellige detektionsordninger for disse to mikroskopiteknologier. Signaldetektion i CARS involverer normalt spektral adskillelse af nyligt genererede fotoner og detektion ved hjælp af et fotomultiplierrør (PMT) eller ladningskoblet enhed (CCD); for SRS måles energiudvekslingen mellem pumpen og Stokes-strålerne normalt ved højhastighedsintensitetsmodulation ved hjælp af en optisk modulator og demodulation ved hjælp af en fotodiode (PD) parret med en låseforstærker.
Selv om der i de senere år er blevet offentliggjort mange teknologiske udviklinger og anvendelser inden for både CARS- og SRS-områder, er der ikke foretaget systematiske sammenligninger af de to CRS-teknikker på samme platform, især for hyperspektral CARS- og SRS-mikroskopi. Direkte sammenligninger i følsomhed, rumlig opløsning, spektral opløsning og kemiske separationsfunktioner ville give biologer mulighed for at vælge den bedste modalitet til kemisk kvantificering. I denne protokol gives detaljerede trin til konstruktion af en multimodal billeddannelsesplatform med både hyperspektrale CARS- og SRS-modaliteter baseret på et femtosekundlasersystem og spektralfokusering. De to teknikker er blevet sammenlignet i fremadgående retning for spektral opløsning, detektionsfølsomhed, rumlig opløsning og billedkontraster af celler.
Protocol
Representative Results
Discussion
Protokollen, der præsenteres her, beskriver konstruktionen af et multimodalt CRS-mikroskop og den direkte sammenligning mellem CARS- og SRS-billeddannelse. For mikroskopkonstruktionen er de kritiske trin rumlig og tidsmæssig stråleoverlapning og optimering af strålestørrelse. Det anbefales at bruge en standardprøve som DMSO før den biologiske billeddannelse til optimering af SNR og kalibrering af Raman-skift. Direkte sammenligning mellem CARS- og SRS-billeder afslører, at CARS har en bedre rumlig opløsning, mens…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev støttet af Purdue University Department of Chemistry opstartsfond.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

