Kimyasal Görüntüleme için Hiperspektral Uyarılmış Raman Saçılması ve Tutarlı Anti-Stokes Raman Saçılma Mikroskobunun Doğrudan Karşılaştırılması
Summary
Bu makale, aynı mikroskop platformuna entegre edilmiş uyarılmış Raman saçılmasının (SRS) ve tutarlı anti-Stokes Raman saçılmasının (CARS) çözünürlüğünü, hassasiyetini ve görüntüleme kontrastlarını doğrudan karşılaştırmaktadır. Sonuçlar, CARS’ın daha iyi bir uzamsal çözünürlüğe sahip olduğunu, SRS’nin daha iyi kontrastlar ve spektral çözünürlük sağladığını ve her iki yöntemin de benzer hassasiyete sahip olduğunu göstermektedir.
Abstract
Uyarılmış Raman saçılması (SRS) ve tutarlı anti-Stokes Raman saçılması (CARS) mikroskobu en yaygın kullanılan tutarlı Raman saçılma görüntüleme teknolojileridir. Hiperspektral SRS ve CARS görüntüleme, her pikselde Raman spektral bilgisi sunar ve bu da farklı kimyasal bileşimlerin daha iyi ayrılmasını sağlar. Her iki teknik de iki uyarma lazeri gerektirse de, sinyal algılama şemaları ve spektral özellikleri oldukça farklıdır. Bu protokolün amacı, hem hiperspektral SRS hem de CARS görüntülemeyi tek bir platformda gerçekleştirmek ve farklı biyolojik örnekleri görüntülemek için iki mikroskopi tekniğini karşılaştırmaktır. Spektral odaklama yöntemi, femtosaniye lazerler kullanılarak spektral bilgi elde etmek için kullanılır. Standart kimyasal numuneler kullanılarak, SRS ve CARS’ın aynı uyarma koşullarında (yani, numunedeki güç, piksel bekleme süresi, objektif lens, darbe enerjisi) hassasiyeti, uzamsal çözünürlüğü ve spektral çözünürlüğü karşılaştırılır. Biyolojik örnekler için CARS ve SRS’nin görüntüleme kontrastları yan yana getirilir ve karşılaştırılır. CARS ve SRS performanslarının doğrudan karşılaştırılması, kimyasal görüntüleme için modalitenin optimal seçimine izin verecektir.
Introduction
Raman saçılma fenomeni ilk olarak 1928’de C. V. Raman1 tarafından gözlemlenmiştir. Bir olay fotonu bir örnekle etkileşime girdiğinde, fotonun enerji değişiminin analiz edilen kimyasal türlerin titreşimsel geçişiyle eşleştiği elastik olmayan bir saçılma olayı kendiliğinden meydana gelebilir. Bu işlem kimyasal etiket kullanımını gerektirmez, bu da onu numune bozulmasını en aza indirirken kimyasal analiz için çok yönlü, etiketsiz bir araç haline getirir. Avantajlarına rağmen, spontan Raman saçılması, analiz2 için uzun edinme süreleri gerektiren düşük bir saçılma kesitinden (tipik olarak kızılötesi [IR] absorpsiyon kesitinden 1011 daha düşük) muzdariptir. Bu nedenle, Raman saçılma işleminin hassasiyetini artırma arayışı, Raman teknolojilerini gerçek zamanlı görüntüleme için zorlamak için çok önemlidir.
Raman saçılmasının hassasiyetini büyük ölçüde arttırmanın etkili bir yolu, moleküler titreşimsel geçişleri uyarmak için tipik olarak iki lazer darbesinin kullanıldığı tutarlı Raman saçılma (CRS) işlemleridir 3,4. İki lazer arasındaki foton enerji farkı, örnek moleküllerin titreşim modlarıyla eşleştiğinde, güçlü Raman sinyalleri üretilecektir. Görüntüleme için en sık kullanılan iki CRS işlemi, tutarlı anti-Stokes Raman saçılması (CARS) ve uyarılmış Raman saçılmasıdır (SRS)5. Son yirmi yılda, teknolojik gelişmeler, biyolojik numunelerdeki kimyasal değişikliklerin etiketsiz nicelleştirilmesi ve aydınlatılması için güçlü araçlar haline gelmek üzere CARS ve SRS mikroskopi tekniklerini geliştirmiştir.
CARS mikroskobu ile kimyasal görüntüleme, Duncan ve ark.6 tarafından gösterilen CARS görüntülerini elde etmek için lazer taramanın ilk kez uygulandığı 1982 yılına tarihlenebilir. CARS mikroskobunun modernizasyonu, lazer taramalı multifoton floresan mikroskopi7’nin geniş uygulamalarından sonra büyük ölçüde hızlandırılmıştır. Xie grubunun yüksek tekrarlama oranlı lazerler kullanan erken çalışmaları, CARS’ı biyolojik örneklerdeki moleküllerin karakterizasyonu için yüksek hızlı, etiketsiz, kimyasal bir görüntüleme platformu haline getirdi 8,9,10. CARS görüntüleme için en önemli sorunlardan biri, görüntü kontrastını azaltan ve Raman spektrumunu bozan rezonans olmayan bir arka planın varlığıdır. Rezonans olmayan arka plan 11,12,13,14,15’i azaltmak veya CARS spektrumu 16,17’den rezonans Raman sinyallerini çıkarmak için birçok çaba sarf edilmiştir. Alanı büyük ölçüde geliştiren bir diğer gelişme, her görüntü pikselinde gelişmiş kimyasal seçicilik18,19,20,21 ile spektral haritalamaya izin veren hiperspektral CARS görüntülemedir.
Uyarılmış Raman saçılması (SRS),22 yıl önce keşfedilmesine rağmen, CARS’tan daha genç bir görüntüleme teknolojisidir. 2007 yılında, SRS mikroskobu düşük tekrarlama oranlı lazer kaynağı23 kullanılarak rapor edilmiştir. Kısa süre sonra, birkaç grup yüksek tekrarlama oranlı lazerler kullanarak yüksek hızlı SRS görüntüleme gösterdi24,25,26. SRS mikroskopisinin CARS üzerindeki en büyük avantajlarından biri, rezonans olmayan arka plan27’nin olmamasıdır, ancak çapraz faz modülasyonu (XPM), geçici absorpsiyon (TA), iki foton absorpsiyonu (TPA) ve fototermal (PT) etkisi gibi diğer arka planlar SRS28 ile ortaya çıkabilir. Ek olarak, SRS sinyali ve numune konsantrasyonu, ikinci dereceden bir sinyal-konsantrasyon bağımlılığına sahip olan CARS’ın aksine doğrusal ilişkilere sahiptir29. Bu, kimyasal niceliği ve spektral karıştırmayı basitleştirir. Çok renkli ve hiperspektral SRS, 30,31,32,33,34,35,36 farklı formlarda evrimleşmiştir ve spektral odaklama kimyasal görüntüleme için en popüler yaklaşımlardan biridir 37,38.
Hem CARS hem de SRS, sinyal uyarımı için moleküllerin titreşimsel geçişine uymak için pompanın ve Stokes lazer ışınlarının numuneye odaklanmasını gerektirir. CARS ve SRS mikroskopları da birçok ortak noktayı paylaşır. Bununla birlikte, bu iki sürecin altında yatan fizik ve bu mikroskopi teknolojilerinde yer alan sinyal tespitleri3,39 eşitsizliklere sahiptir. CARS, net foton-molekül enerji kuplajına sahip olmayan parametrik bir işlemdir3. Bununla birlikte, SRS, parametrik olmayan bir süreçtir ve fotonlar ile moleküler sistemler arasındaki enerji transferine katkıda bulunur27. CARS’da, anti-Stokes frekansında yeni bir sinyal üretilirken, SRS, pompa ve Stokes lazer ışınları arasındaki enerji transferi olarak kendini gösterir.
CARS sinyali Eq (1)28’i tatmin eder.
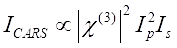 (1)
(1)
Bu arada SRS sinyali Eq (2)28 olarak yazılabilir.
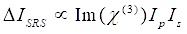 (2)
(2)
Burada, I p, I s, I CARS ve ΔISRS, sırasıyla pompa ışınının, Stokes ışınının, CARS sinyalinin ve SRS sinyallerinin yoğunluklarıdır. χ(3), numunenin üçüncü dereceden doğrusal olmayan optik duyarlılığıdır ve gerçek ve hayali parçalardan oluşan karmaşık bir değerdir.
Bu denklemler, CARS ve SRS’nin spektral profillerini ve sinyal-konsantrasyon bağımlılığını ifade eder. Fizikteki farklılıklar, bu iki mikroskopi teknolojisi için farklı algılama şemalarına neden olur. CARS’ta sinyal algılama genellikle yeni üretilen fotonların spektral olarak ayrılmasını ve bir fotoçarpan tüpü (PMT) veya şarj bağlantılı cihaz (CCD) kullanılarak algılanmasını içerir; SRS için, pompa ve Stokes ışınları arasındaki enerji alışverişi genellikle bir optik modülatör kullanılarak yüksek hızlı yoğunluk modülasyonu ve kilitli bir amplifikatör ile eşleştirilmiş bir fotodiyot (PD) kullanılarak demodülasyon ile ölçülür.
Son yıllarda hem CARS hem de SRS alanlarında birçok teknolojik gelişme ve uygulama yayınlanmış olmasına rağmen, özellikle hiperspektral CARS ve SRS mikroskopisi için iki CRS tekniğinin sistematik bir karşılaştırması aynı platformda yapılmamıştır. Hassasiyet, uzamsal çözünürlük, spektral çözünürlük ve kimyasal ayırma yeteneklerindeki doğrudan karşılaştırmalar, biyologların kimyasal niceleme için en iyi yöntemi seçmelerine izin verecektir. Bu protokolde, femtosaniye lazer sistemine ve spektral odaklamaya dayalı hem hiperspektral CARS hem de SRS modaliteleri ile multimodal bir görüntüleme platformu oluşturmak için ayrıntılı adımlar sağlanmaktadır. İki teknik, spektral çözünürlük, algılama duyarlılığı, uzamsal çözünürlük ve hücrelerin görüntüleme kontrastları için ileri yönde karşılaştırılmıştır.
Protocol
Representative Results
Discussion
Burada sunulan protokol, multimodal CRS mikroskobunun yapımını ve CARS ile SRS görüntüleme arasındaki doğrudan karşılaştırmayı açıklamaktadır. Mikroskop yapımı için kritik adımlar mekansal ve zamansal ışın örtüşmesi ve ışın boyutu optimizasyonudur. SNR’yi optimize etmek ve Raman kaymalarını kalibre etmek için biyolojik görüntülemeden önce DMSO gibi standart bir numune kullanılması önerilir. CARS ve SRS görüntüleri arasındaki doğrudan karşılaştırma, CARS’ın daha iyi bir uza…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu araştırma Purdue Üniversitesi Kimya Bölümü başlangıç fonu tarafından desteklenmiştir.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

