Multiplex chemische beeldvorming op basis van breedband gestimuleerde Raman-verstrooiingsmicroscopie
Summary
We presenteren een protocol om chemische beelden te verkrijgen met breedband gestimuleerde Raman scattering (SRS) microscopie. Gebaseerd op een SRS-microscoop die werkt met differentiële meerkanaals-lock-in detectie, beschrijft het protocol de monstervoorbereiding, aanpassing van het SRS-apparaat en chemometrie om verschillende bestanddelen van chemisch heterogene monsters te ontwarren.
Abstract
Stimulated Raman scattering (SRS) microscopie is een niet-lineaire optische techniek voor labelvrije chemische beeldvorming. Deze analytische tool levert chemische kaarten met hoge snelheid en hoge ruimtelijke resolutie van dunne monsters door hun moleculaire trillingen rechtstreeks te onderzoeken. In de standaardimplementatie is SRS-microscopie smalbandig en vormt het beelden met slechts één trillingsfrequentie tegelijk. Deze benadering belemmert echter niet alleen de chemische specificiteit van SRS, maar verwaarloost ook de schat aan informatie die is gecodeerd in trillingsspectra.
Deze beperkingen kunnen worden overwonnen door breedband SRS, een implementatie die in staat is om parallel een trillingsspectrum per pixel van het beeld te extraheren. Dit levert hyperspectrale gegevens op die, in combinatie met chemometrische analyse, de hoeveelheid informatie die uit het monster wordt opgehaald, maximaliseren. Breedband-SRS verbetert dus de chemische specificiteit van het systeem, waardoor de kwantitatieve bepaling van de concentratie van de verschillende bestanddelen van een monster mogelijk is. Hier rapporteren we een protocol voor chemische beeldvorming met breedband SRS-microscopie, gebaseerd op een zelfgebouwde SRS-microscoop die werkt met een aangepaste differentiële meerkanaals-lock-in versterkerdetectie. Het bespreekt de monstervoorbereiding, uitlijning van het SRS-apparaat en chemometrische analyse. Door vibrationele Raman-spectra te verkrijgen, illustreert het protocol hoe verschillende chemische soorten in een mengsel kunnen worden geïdentificeerd en hun relatieve concentraties kunnen worden bepaald.
Introduction
Raman-microscopie is een krachtige beeldvormingstechniek die rijke chemische kaarten levert door Raman-verstrooiing1 te meten, een inelastisch stralingsproces dat afkomstig is van moleculen die trillen als reactie op invallend licht 2,3. Elke pixel van een Raman-kaart bevat een spectrum dat directe informatie bevat over de chemische samenstelling en structuur van het monster, wat resulteert in beelden met intrinsiek trillingscontrast. Tot op heden is Raman-microscopie het referentiestandpunt voor microspectroscopiestudies van moleculaire trillingen, omdat geen enkele andere beeldvormingstechniek beelden kan produceren met zowel een hoge chemische specificiteit als een hoge ruimtelijke resolutie4. Ondanks de uitstekende chemische specificiteit is de opwekkingsefficiëntie van Raman-verstrooiing laag, wat vraagt om langere pixelverblijftijden of excitatie met een hoog vermogen, wat respectievelijk leidt tot lage acquisitiesnelheden en incompatibiliteit met gevoelige monsters.
Deze enkele tekortkoming van Raman-microscopie leidde ertoe dat onderzoekers coherente Raman-verstrooiing 5,6,7,8,9 toepasten als een bron van contrast voor microscopie. Dit is een niet-lineair optisch proces dat de trillingsrespons met verschillende (tot zeven) ordes van grootte verbetert, waardoor snelle chemische beeldvorming 10,11,12,13 mogelijk is. In het bijzonder zijn de twee meest gebruikte coherente Raman-verstrooiingstechnieken coherente anti-Stokes Raman-verstrooiing (CARS)14 en gestimuleerde Raman-verstrooiing (SRS)15. In tegenstelling tot CARS vertoont SRS een lineaire afhankelijkheid van de concentratie van resonante moleculen. Het is immuun voor de niet-resonante achtergrond, een niet-lineair effect dat geen verband houdt met enige trillingsovergang, maar vervormt voor de Lorentziaanse vormen die kenmerkend zijn voor de Raman-spectra van de moleculaire trillingen16,17. SRS-microscopie levert dus authentieke Raman-informatie op die directe kwantitatieve beeldanalyse mogelijk maakt.
SRS is een derde-orde, niet-lineair, optisch proces dat directe informatie geeft over de chemische bindingen van een monster. Het is afkomstig van de spatiotemporale superpositie van twee optische velden in het algemeen in het nabij-infrarode spectrale gebied, namelijk de pomp en de Stokes bij frequentie ωpu en ωS, respectievelijk 10,11,18. Deze superpositie genereert een kloppend op de pomp-Stokes frequentie detuning Ω = ωpu-ω S. Wanneer Ω overeenkomt met een moleculaire trilling ΩR, resoneert het molecuul, waardoor een coherente energieoverdracht ontstaat tussen de lichtvelden en het molecuul. Als gevolg hiervan bereikt het molecuul een trillingsaangeslagen toestand. Dit proces kan worden gevolgd door het meten van de vernietiging van pompfotonen (een signaal dat bekend staat als gestimuleerd Raman-verlies [SRL]) of de gelijktijdige versterking van Stokes-fotonen (een proces dat bekend staat als gestimuleerde Raman-versterking [SRG]). SRG en SRL zijn kleine signalen (ΔI) die bovenop een intense en fluctuerende achtergrond (I) zitten. Omdat typische waarden van het SRS-signaal (ΔI/I) zich in het bereik 10-6-10-4 bevinden, kan de laserruis het gemakkelijk verduisteren. Om de schadelijke effecten van de laserruis op de signaal-ruisverhouding (SNR) en bijgevolg op de beeldsnelheid te beperken, vertrouwt SRS-detectie op modulatieoverdrachtstechnieken (bijv. Lock-in-versterkers, resonantiecircuits of box-car averagers) bij hoge modulatiefrequenties (>1 MHz), waarbij de laserruis zijn minimumwaarden 15,19,20 bereikt.
Conventionele SRS-microscopie maakt gebruik van smalbandige (≈10 cm−1) pomp- en Stokes-pulsen om chemische beelden te produceren met een enkele trillingsfrequentie, waardoor videosnelheidsbeelden mogelijk zijn met pixelverblijftijden zo laag als ≈100 ns21,22. Omdat smalband SRS-microscopie echter chemische kaarten vormt door het monster sequentieel te scannen met slechts enkele trillingsfrequenties, is de informatie beperkt23. SRS-beelden met een of twee trillingscontrasten zijn mogelijk niet voldoende om chemische soorten met overlappende Raman-banden te onderscheiden, vooral binnen heterogene systemen. Daarom benut de paradigmatische smalband SRS-microscoop niet het volledige potentieel van SRS, omdat het onderzoeken van een handvol trillingsfrequenties de chemische specificiteit ervan belemmert en de schat aan informatie verwaarloost die is gecodeerd in trillingsspectra. Bovendien resulteert sequentieel scannen van het monster op verschillende frequenties in verlengde pixelverblijftijden die fotoschade kunnen veroorzaken en rigoureuze ruimtelijke coregistratie tussen opeenvolgende afbeeldingen kunnen voorkomen, wat leidt tot bewegingsartefacten.
In tegenstelling tot zijn smalbandige tegenhanger haalt breedband SRS-microscopie bij elke monsterscan een trillingsspectrum per pixel op 10,12,24. Breedband SRS biedt dus hyperspectrale beeldvorming met strikte ruimtelijke coregistratie van verschillende trillingscontrasten, waardoor rigoureuze gegevensanalyse mogelijk is. Dit onthult niet alleen de chemische bestanddelen van het monster via Raman-spectra, maar helpt ook om hun relatieve concentraties te bepalen. Afhankelijk van hoe de spectra worden verkregen, wordt breedband SRS-microscopie geclassificeerd als hyperspectrale SRS of multiplex SRS. In hyperspectrale SRS wordt het SRS-spectrum per gescand punt van het monster sequentieel verkregen (d.w.z. het wordt opgehaald door de frequentie-detuning Ω te vegen), waardoor een SRS-spectrum wordt opgebouwd door de SRS-signalen bij opeenvolgende Raman-verschuivingen samen te stapelen. Het Raman-spectrum wordt gelijktijdig gemeten bij verschillende trillingsmodi in multiplex SRS. De multiplex SRS-benadering combineert dus een gemoduleerde smalbandpuls met een breedbandpuls om het SRS-signaal op verschillende frequenties aan te drijven, en gebruikt een meerkanaalsdetector met een gevoeligheid die vergelijkbaar is met die van smalband SRS om de SRS-spectra te detecteren.
Dit artikel presenteert een protocol om chemische kaarten van heterogene monsters te produceren met behulp van multiplex SRS-microscopie. Een schema van de in dit protocol gebruikte SRS-microscoop is weergegeven in figuur 1 en elders in detail beschreven 25,26,27. Kortom, een commerciële modus-vergrendelde Yb fiberlaser, die 140 fs pulsen produceert gecentreerd op 1040 nm, met 10 W gemiddeld vermogen en een herhalingsfrequentie van 80 MHz, drijft de breedband SRS-microscoop aan. Een polariserende bundelsplitser (PBS) scheidt de fundamentele bundel in twee takken. Om de smalband stokes pulsen te produceren, wordt een tak met 4 W van de fundamentele bundel naar een etalon gestuurd die een smalbandige (≈15 cm-1) bundel genereert, die vervolgens wordt gemoduleerd op 1,6 MHz met een akoestische optische modulator (AOM). De resterende fractie met 6 W van de fundamentele bundel wordt frequentieverdubbeld met een 2,8 mm dik lithiumtriboraat (LBO) kristal, gesneden voor type-I fase matching (θ = 90°, φ = 13,8°). De resulterende tweede harmonische generatie bij 520 nm reist naar een X-gevouwen holte om een optische parametrische oscillator (OPO) te pompen, een apparaat dat een 3,0 mm dik LBO-kristal (type I fase matching, θ = 90 °, φ = 9,8 °) als actief medium gebruikt om een breedband optische straling af te geven die niet instelbaar is binnen het spectrale gebied van 680-910 nm (figuur 2). Deze breedbandpulsen dienen als de pomp in de SRS-experimenten en verspreiden zich naar een prismacompressor om de dispersie-effecten veroorzaakt door het microscoopobjectief te precompenseren.
Na de compressiefase produceert een λ/2-golfplaat, gecombineerd met een YVO4 birefringentplaat, twee orthogonaal gepolariseerde replica’s waarvan de elektronische aftrekking aan het detectievlak het geluid van de breedbandpomp annuleert. Een dichroïsche spiegel combineert de pomp en Stokes-stralen en stuurt ze naar een rechtopstaande microscoop. Een water-immersie objectief met een numeriek diafragma (NA) van 1,27 richt het licht op het monster, terwijl een olie-onderdompeling objectief met een NA van 1,4 het verzamelt. Vóór de detectiefase verwijdert een kortdoorlaatfilter (SPF) de gemoduleerde Stokes, terwijl een diffractierooster dat in Littrow-configuratie werkt, de verzonden breedbandpomp dispergeert. Een tweede PBS2 scheidt de pompreplica’s en een lens richt ze op twee fotodiode-arrays. De signalen van deze fotodiode-arrays worden elektronisch afgetrokken en verzonden naar een zelfgebouwde meerkanaals-lock-in versterker (M-LIA). Het gedemoduleerde signaal wordt vervolgens genormaliseerd door de gelijkstroom (DC) metingen van een van de fotodiode-arrays, waardoor het SRL-spectrum wordt geproduceerd.
Als voorbeeldig experiment stellen we mengsels van verschillende bekende Raman-strooiers in beeld, elk met een uniek Raman-spectrum. Het protocol begint dus met het beschrijven van hoe de referentiemonsters moeten worden voorbereid. Terwijl we SRL detecteren, blijven we uitleggen hoe we smalband stokespulsen kunnen verkrijgen en de optische bron kunnen instellen die de breedband (≈250 cm-1) pomppulsen levert, namelijk de zelfgebouwde OPO. Het protocol toont de uitlijning en optimalisatie van de optische bundels en beschrijft kritische parameters zoals het vermogen en de spectra van de smalband Stokes en de breedbandpomp. Het protocol beschrijft in detail het optische pad van de breedbandpomp omdat het speciale optische elementen vereist. Het legt ook uit hoe de spatiotemporale overlap tussen pomp-Stokes-pulsen kan worden gevonden en toont een praktische manier om de relatieve intensiteitsruis (RIN) te bepalen, wat op zijn beurt helpt bij het definiëren van de beste modulatiefrequentie voor SRS-experimenten. Vervolgens leggen we het werkingsprincipe en de kalibratie van de detectieketen uit. Ten slotte toont het protocol het data-acquisitieproces, chemometrie en beeldverwerkingspijplijn.
Protocol
Representative Results
Discussion
Breedband SRS-microscopie is een krachtige beeldvormingstechniek die authentiek chemisch contrast biedt om de chemische bestanddelen van een heterogeen monster te identificeren en te ontwarren. Het potentieel van dit analytische instrument kan gunstig zijn voor verschillende onderzoeksgebieden, variërend van materiaalkunde tot histopathologie. Het nadeel van breedband SRS-microscopie is het feit dat het technisch veeleisend is; de experimentalist vereist niet alleen kennis van breedbandlaserbronnen, maar moet ook de laserpulsen manipuleren om efficiënt SRS te genereren, een signaal dat op zijn beurt moet worden gemeten met geavanceerde detectieschema’s. Dit artikel presenteert een protocol dat een workflow beschrijft om chemische kaarten van gemengde chemische verbindingen te produceren met behulp van een multiplex breedband SRS-microscoop. Hoewel het beschreven werk triviaal kan zijn voor sommige laserfysici en niet-lineaire microscopisten, is dit misschien niet het geval voor lezers die geïnteresseerd zijn in de voordelen van breedband SRS-microscopie waarvan de wetenschappelijke kennis zich buiten deze domeinen bevindt. Daarom wilden we elke stap gedetailleerd beschrijven om het brede publiek te begeleiden dat geïnteresseerd is in breedband SRS-microscopie.
Het protocol bij de hand begon met het laten zien hoe een eenvoudig maar spectroscopisch rijk monster te bereiden dat bestond uit verschillende sterke en bekende Raman-strooiers. We bespraken hoe we de breedbandpomp en smalband Stokes-balken konden verkrijgen die nodig zijn om een SRS-microscoop op te zetten. Figuur 5C toont een schema van de SHG- en OPO-opstellingen. Merk op dat lens f1 de fundamentele straal op LBO1 richt om de SHG te genereren, terwijl een dichroïsche spiegel de SHG-straling reflecteert en de resterende fundamentele straal doorgeeft. Een tweede lens f2 collimeert de SHG-bundel. Als f2 > f1 wordt de SHG-bundel uitgebreid met een factor gelijk aan f2/f1. Een derde lens f3 richt de uitgebreide SHG-bundel op een tweede Type I LBO-kristal (LBO2) gesneden op θ = 90° en φ = 29,0°. Door LBO2 te pompen met de eerder genoemde SGH (520 nm), zal straling binnen het bereik van 680-910 nm uit LBO2 komen door middel van verschilfrequentiegeneratie (DFG), waardoor twee bundels worden geproduceerd: het signaal en idler27 (figuur 5D, E). De laatste wordt weggegooid, terwijl de eerste wordt versterkt in de OPO-holte om de pomppulsen af te leveren die in de SRS-experimenten worden gebruikt. De pomp van de OPO bij 520 nm, namelijk de SHG-bundel, moet niet worden verward met de pomp van de SRS-experimenten (d.w.z. de signaalbundel van de OPO).
Het contrast in SRS-microscopie komt voort uit een niet-lineair signaal dat wordt gegenereerd op de brandpuntsplek van de microscoop, een signaal dat vereist dat een groot aantal fotonen op een bepaald moment in het monstervlak wordt beperkt. Deze fotonenopsluiting wordt bereikt met een microscoopobjectief met hoog numeriek diafragma (NA), een reeks lenzen die ook de ruimtelijke resolutie van het systeem bepaalt: hoe hoger de NA, hoe hoger de ruimtelijke resolutie. Hoge NA-objectieven zijn echter dicht opeengepakt met glas, wat positieve GDD introduceert voor gepulseerde straling, een frequentie-tjirp die uiteindelijk het temporele profiel van de pulsenverbreedt 39. De GDD die door het microscoopobjectief wordt geïntroduceerd, kan dus de duur van de breedbandpomppulsen verlengen, waardoor deze zelfs langer wordt dan de Stokes-temporele envelop en de effectieve, toegankelijke bandbreedte van het Raman-signaal wordt verminderd. Bovendien zou deze verbreding ook kunnen leiden tot een vervorming van het spectrale profiel van het gemeten SRS-spectrum.
In CARS ontstaat het spectroscopisch relevante signaal op golflengten die verschillen van die van de excitatievelden. Een eenvoudige fotomultiplicatorbuis of CCD-camera (charge-coupled device) kan worden gebruikt om het CARS-signaal op tijd te integreren, waarbij duizenden pulsen worden samengevat om de laserruis te berekenen. In plaats daarvan verschijnt het SRS-signaal als een zwakke modulatieoverdracht ingebed in een sterke en fluctuerende laserachtergrond. Omdat deze modulatie zwak is, kan de laserruis deze gemakkelijk overweldigen, waardoor zowel de beeldsnelheid als de gevoeligheid van de SRS-microscoop worden verminderd. Daarom is het vóór de beeldvorming noodzakelijk om de relatieve intensiteitsruis (RIN) te meten om te bepalen of de laser geschikt is voor snelle SRS-beeldvorming en om de modulatiefrequentie met de laagste ruis te selecteren. Het RIN wordt gedefinieerd als de spectrale dichtheid van het ruisvermogen [δP(f), met W2/Hz-eenheden] van de laser, genormaliseerd met het gemiddelde optische vermogen (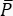 )40,41. Met andere woorden, het RIN beschrijft de genormaliseerde laserfluctuaties op verschillende frequenties (Eq [4]).
)40,41. Met andere woorden, het RIN beschrijft de genormaliseerde laserfluctuaties op verschillende frequenties (Eq [4]).
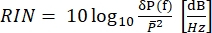 (4)
(4)
Het RIN is dus een parameter van het SRS-systeem die het ideale modulatiefrequentiebereik voor de experimenten bepaalt. De olijfbalk in figuur 8 toont bijvoorbeeld het ideale modulatiefrequentiebereik voor SRS-beeldvorming. In het geval van smalband SRS moet de gebruiker de RIN van zowel de pomp als de Stokes meten om te kiezen welke bundel moet worden gemoduleerd om optimale prestaties te bereiken. Merk bijvoorbeeld op uit figuur 8 dat de Stokes-bundel een iets hogere RIN heeft dan de pomp, wat impliceert dat de SRG-metingen luidruchtiger zouden uitpakken dan hun SRL-tegenhangers. In het geval van breedband-SRS is de bundel die moet worden gemoduleerd de smalbandbundel.
De hoekverdeling D van het rooster drukt de diffractiehoek uit als functie van de golflengte en wordt gedefinieerd als de afgeleide van de roostervergelijking. Voor de Littrow-configuratie wordt de hoekverdeling gegeven door Eq (5).
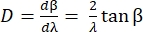 (5)
(5)
Om Eq (5) te krijgen, gingen we uit van α = β, losten Eq (2) op voor m/d en voegden het resultaat toe in dβ/ dλ. Merk op dat in de Littrow-configuratie β = sin-1(mλ/2d). Binnen de benadering van de kleine hoek is de verandering in positie langs het spectrum fdβ ≈ dl (figuur 10). Door dβ in Eq (5) in te voegen, kunnen we dus de lineaire dispersie berekenen, een grootheid met eenheden van nm mm-1 met behulp van Eq (6):
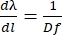 (6)
(6)
Voor een diffractierooster in de Littrow-configuratie met 1.851,85 groeven/mm, d = 540 nm. Als we de eerste-orde diffractie van licht gebruiken bij ~789 nm, dan is D = 0,0027 rad nm-1. Met een f = 750 mm lens krijgen we een lineaire dispersie van ≈ 0,5 nm mm-1, wat zich vertaalt in ≈ 7,8 cm-1 mm-1. De brandpuntsafstand van de lens bepaalt dus de “dichtheid” van nm per mm op het detectorvlak: hoe langer de brandpuntsafstand, hoe minder nm per mm wordt verkregen, waardoor de ruimte tussen de spectraallijnen van de breedbandpomp toeneemt. Omgekeerd zal er bij kortere brandpuntsafstanden meer nm per mm op het detectorvlak zijn, waardoor de ruimte die door de verspreide pomp wordt ingenomen, wordt verminderd.
Gebalanceerde detectie verbetert de beeldkwaliteit en gevoeligheid van luidruchtige opstellingen. Volgens de RIN-spectra in figuur 8 en rekening houdend met typische SRS met een amplitude van 1 x 10-5 is de ongebalanceerde signaal-ruisverhouding (SNR) bijvoorbeeld ≈60. Met behulp van gebalanceerde detectie (d.w.z. dicht bij de shot-ruis) is het mogelijk om een SNR van ≈145 te bereiken. Figuur 11 toont spectra en samengestelde beelden onder evenwichtige en onevenwichtige omstandigheden. Uiteraard hebben de effecten van gebalanceerde detectie invloed op de eindresultaten van de experimenten, namelijk de chemische kaarten. Ondersteund door deze resultaten benadrukken we dat gebalanceerde detectie een krachtige techniek is om de schadelijke effecten van laserfluctuaties op de beeldkwaliteit tegen te gaan. Het is vermeldenswaard dat gebalanceerde detectie het meest geschikt is voor luidruchtige lasers, zoals vezeloscillatoren. SRS-microscopen die werken met stille optische lichtbronnen (bijv. Solid-state lasers) vereisen mogelijk geen gebalanceerde detectie.
Het protocol verklaart ook een benadering op basis van niet-lineaire optica om de spatiotemporale overlap tussen de pulsen van deze bundels te vinden. We beschreven de voordelen van het gebruik van de 1st in plaats van de 0e diffractie-orde van een AOM als de gemoduleerde Stokes-bundel. Verder werden de schadelijke effecten van dispersie op de SRS-opwekkingsefficiëntie beschreven met suggesties voor manieren om ze te verminderen via een prismacompressor. Daarnaast legt het protocol uit hoe de prisma’s moeten worden uitgelijnd en worden drie kritieke aspecten belicht waarmee rekening moet worden gehouden voor optimale prestaties. We bespreken niet alleen de relevantie van het RIN voor SRS-microscopie, maar laten ook zien hoe het te meten met een lock-in versterker en, met het RIN-spectrum, de beste modulatiefrequentie te definiëren. Met een concreet voorbeeld legt dit artikel uit hoe de roostervergelijking helpt bij het ontwerpen van de detectieketen. Ten slotte illustreert het protocol, met echte SRS-gegevens, de structuur van de SRS-hyperkubus en hoe deze te analyseren met een conventioneel gebruikte wetenschappelijke programmeertaal.
Dit protocol heeft drie kleine beperkingen. Ten eerste bestaat het detectieschema dat in deze bijdrage wordt gebruikt uit een niet-conventionele, meerkanaals lock-in detector die in eigen huis is ontworpen en gebouwd door Sciortino et al.26 Zoals eerderaangetoond 25, kan deze detector worden vervangen door een kant-en-klare gebalanceerde fotodiode. Hoewel deze wijziging alleen betrekking heeft op de detector en het protocol vrijwel ongewijzigd laat, moet men met een enkele fotodiode elke spectrale component op de detector scannen in plaats van ze allemaal tegelijk te meten. Ten tweede maakt dit protocol gebruik van inline gebalanceerde detectie, waarvoor verschillende optische elementen in het bundelpad moeten worden ingevoegd. Deze optische elementen verhogen de complexiteit van het systeem en leiden tot verlies van optisch vermogen en pulsverbreding.
Inline gebalanceerde detectie vereist ook dat de twee pompreplica’s door het monster gaan, een situatie die mogelijk niet ideaal is voor lichtgevoelige monsters, zoals levende cellen, of voor sterk birefringente monsters waarin de twee pompreplica’s verschillende optische eigenschappen kunnen ervaren, waardoor de gebalanceerde detectie wordt geannuleerd. Ten derde vertrouwt het protocol op een zelfgebouwde OPO, een apparaat dat mogelijk niet direct beschikbaar is. Alternatieven voor de breedbandspectra die door de OPO worden geleverd, zijn echter het supercontinua van niet-lineaire optische vezels of bulkkristallen. De laatste kon alleen worden gebruikt met lasers met een lage herhalingssnelheid (tot 5 MHz). Dus, zoals bij elk experimenteel ontwerp, heeft het betreffende protocol enkele beperkingen. Ze zijn echter minimaal en brengen het succes van deze aanpak niet in gevaar.
Hoewel hier een referentiemonster wordt beschreven, kan dit protocol met succes chemische soorten in cellen en dierlijke en plantaardige weefsels, zoals cellulose, lipidesoorten of eiwitten, ontwarren, praktische toepassingen vinden in verschillende biochemische zoektochten of als een diagnostisch hulpmiddel in histopathologie. Evenzo kan dit protocol een waardevol hulpmiddel zijn in de materiaalwetenschappen. Volgens dit protocol kan men bijvoorbeeld de moleculaire samenstelling en concentratie van polymere soorten42 ondervragen. Bovendien is deze methodologie compatibel met andere niet-lineaire microscopietechnieken, zoals breedbandmicroscopie op basis van pompsonde43 en heterodyne CARS44, viergolfmengprocessen die, net als bij SRS, ook twee excitatielichtbundels en modulatie-overdrachtsmetingen vereisen. Ten slotte kan een deel van de informatie in dit artikel worden toegepast op niet-lineaire beeldvormingstechnieken die niet afhankelijk zijn van modulatieoverdrachtstechnieken, maar die twee of meer gepulseerde laserstralen vereisen, zoals conventionele CARS45– en SFG-microscopieën46.
Samenvattend beschrijft dit protocol een krachtige methodologie op basis van breedband SRS-microscopie om chemische kaarten en hun karakteristieke SRS-spectra uit chemisch heterogene mengsels te extraheren, waardoor datasets worden geleverd die eenvoudige kwantitatieve gegevensanalyse mogelijk maken. De veelzijdigheid en eenvoud van de methode geven de geïnteresseerde lezer ook de mogelijkheid om deze aan te passen aan verschillende niet-lineaire technieken.
Disclosures
The authors have nothing to disclose.
Acknowledgements
D.P. erkent de financiering van het project CRIMSON van de Europese Unie onder subsidieovereenkomst nr. 101016923 en het Regione Lombardia-project NEWMED onder subsidieovereenkomst nr. POR FESR 2014-2020. G. C. erkent de financiering van het PROJECT GRAPHENE Core3 van de Europese Unie onder nummer 881603. G. C. erkent ook financiering van de King Abdullah University of Science and Technology, Grant Award Number: OSR-2016-CRG5-3017-01.
Materials
| Collection objective | Nikon | CFI Apo Lambda S 60x Oil, NA=1.4, Nikon | Oil immersion objective |
| Coverslips | Thermo Fisher | 043211-KJ | Quartz, cover slip for microscope slide, 25.4 x 25.4 x 0.15 mm |
| Delay line | Physik Instrumente (PI) | M-406.6PD | Precision microtranslation stage, 150 mm travel range |
| DMSO | Merck | D8418-500ML | Methylsulfinylmethane, Molecular Biology Grade DMSO, DMSO, Methyl Sulfoxide |
| Etalon | SLS Optics Ltd | Custom made | Anti reflective coating at 1,040 nm, Mounted in a 38 mm diameter x 35.5 mm long stainless steel cell with protective dust caps, and a 50 mm diameter ‘pinch-clamp’ mounting ring |
| Excitation objective | Nikon | CFI Plan Apo IR 60XC WI, NA=1.27, Nikon | Water immersion objective |
| Grating | LightSmyth | T-1850-800s Series | High Efficiency Transmission Grating T-1850-800s Series |
| Laser | Coherent | Custom made | Fidelity, HP |
| λ/2 | Thorlabs | SAHWP05M-1700 | Mounted superachromatic half-wave plate |
| PBS | Thorlabs | CM5-PBS203/M | 16 mm Cage-Cube-Mounted Polarizing Beamsplitter Cube, |
| PMMA beads | Merck | MFCD00198073 | Micro particles based on polymethacrylate |
| Prisms | Crisel | 320-8218 | LASER DISPERSING PRISMS in SF11 |
| PS beads | Merck | 72986-10ML-F | Micro particles based on polystyrene |
| YVO4 crystal | Dr. Sztatecsny GmbH | Custom made | thickness 8 mm, dia 1.00 cm, 1 689,00 689,00 suitable for 1" mount, coated for 850 – 1,100 nm |
References
- Stewart, S., Priore, R. J., Nelson, M. P., Treado, P. J. Raman Imaging. Annual Review of Analytical Chemistry. 5 (1), 337-360 (2012).
- Smekal, A. Zur quantentheorie der dispersion. Die Naturwissenschaften. 11 (43), 873-875 (1923).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Vanna, R., et al. Vibrational imaging for label-free cancer diagnosis and classification. La Rivista del Nuovo Cimento. 45, 107-187 (2021).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Hellwarth, R. W. Theory of stimulated Raman scattering. Physical Review. 130 (5), 1850-1852 (1963).
- Maker, P. D., Terhune, R. W. Study of optical effects due to an induced polarization third order in the electric field strength. Physical Review. 137 (3), 801-818 (1965).
- Bloembergen, N. The stimulated Raman effect. American Journal of Physics. 35 (11), 989-1023 (1967).
- Levenson, M. D., Flytzanis, C., Bloembergen, N. Interference of resonant and nonresonant three-wave mixing in diamond. Physical Review B. 6 (10), 3962-3965 (1972).
- Polli, D., Kumar, V., Valensise, C. M., Marangoni, M., Cerullo, G. Broadband coherent Raman scattering microscopy. Laser & Photonics Reviews. 12 (9), 1800020 (2018).
- Rigneault, H., Berto, P. Tutorial: Coherent Raman light matter interaction processes. APL Photonics. 3 (9), 091101 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-stokes raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363 (2009).
- Valensise, C. M., et al. Removing non-resonant background from CARS spectra via deep learning. APL Photonics. 5 (6), 061305 (2020).
- Cheng, J. X., Xie, X. S. . Coherent Raman scattering microscopy. , (2012).
- Slipchenko, M. N., Oglesbee, R. A., Zhang, D., Wu, W., Cheng, J. X. Heterodyne detected nonlinear optical imaging in a lock-in free manner. Journal of Biophotonics. 5 (10), 801-807 (2012).
- Blume, R. J. Boxcar” integrator with long holding times. Review of Scientific Instruments. 32 (9), 1016-1018 (1961).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Sarri, B., et al. Stimulated Raman histology: one to one comparison with standard hematoxylin and eosin staining. Biomedical Optics Express. 10 (10), 5378 (2019).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- De la Cadena, A., et al. Broadband stimulated Raman imaging based on multi-channel lock-in detection for spectral histopathology. APL Photonics. 7 (7), (2022).
- Dela Cadena, A., Valensise, C. M., Marangoni, M., Cerullo, G., Polli, D. Broadband stimulated Raman scattering microscopy with wavelength-scanning detection. Journal of Raman Spectroscopy. 51 (10), 1951-1959 (2020).
- Sciortino, G., et al. Four-channel differential lock-in amplifiers with autobalancing network for stimulated Raman spectroscopy. IEEE Journal of Solid-State Circuits. 56 (6), 1859-1870 (2021).
- Coluccelli, N., et al. Tunable 30 fs light pulses at 1 W power level from a Yb-pumped optical parametric oscillator. Optics Letters. 42 (21), 4545 (2017).
- Monmayrant, A., Weber, S., Chatel, B. A newcomer’s guide to ultrashort pulse shaping and characterization. Journal of Physics B: Atomic, Molecular and Optical Physics. 43 (10), 103001 (2010).
- Fork, R. L., Martinez, O. E., Gordon, J. P. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150 (1984).
- Crisafi, F., et al. In-line balanced detection stimulated Raman scattering microscopy. Scientific Reports. 7 (1), 10475 (2017).
- Alem, M. Noise spectral density measured with lock-in amplifiers. Zurich Instruments Company Blog. , (2021).
- Palmer, C., Loewen, E. G. . Diffraction grating handbook. , (2005).
- . Multivariate curve resolution homepage Available from: https://mcrals.wordpress.com/download/mcr-als-2-0-toolbox/ (2021)
- Tauler, R. Multivariate curve resolution applied to second order data. Chemometrics and Intelligent Laboratory Systems. 30 (1), 133-146 (1995).
- de Juan, A., Jaumot, J., Tauler, R. Multivariate Curve Resolution (MCR). Solving the mixture analysis problem. Analytical Methods. 6 (14), 4964-4976 (2014).
- Zhang, D., et al. Quantitative vibrational imaging by hyperspectral stimulated Raman scattering microscopy and multivariate curve resolution analysis. Analytical Chemistry. 85 (1), 98-106 (2013).
- Chitra Ragupathy, I., Schweikhard, V., Zumbusch, A. Multivariate analysis of hyperspectral stimulated Raman scattering microscopy images. Journal of Raman Spectroscopy. 52 (9), 1630-1642 (2021).
- Brown, S. D., Tauler, R., Walczak, B. . Comprehensive Chemometrics: Chemical and Biochemical Data Analysis. , (2020).
- Guild, J. B., Xu, C., Webb, W. W. Measurement of group delay dispersion of high numerical aperture objective lenses using two-photon excited fluorescence. Applied Optics. 36 (1), 397 (1997).
- RP Photonics Encyclopedia. Article on "Relative Intensity Noise." Available from: https://www.rp-photonics.com/relative_intensity_noise.html (2021)
- Audier, X., Heuke, S., Volz, P., Rimke, I., Rigneault, H. Noise in stimulated Raman scattering measurement: From basics to practice. APL Photonics. 5 (1), 011101 (2020).
- Xu, S., Camp, C. H., Lee, Y. J. Coherent anti-Stokes Raman scattering microscopy for polymers. Journal of Polymer Science. , (2021).
- Davydova, D., de al Cadena, A., Akimov, D., Dietzek, B. Transient absorption microscopy: advances in chemical imaging of photoinduced dynamics. Laser & Photonics Reviews. 10 (1), 62-81 (2016).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241 (2006).
- Cheng, J. X., Volkmer, A., Xie, X. S. Theoretical and experimental characterization of coherent anti-Stokes Raman scattering microscopy. Journal of the Optical Society of America B. 19 (6), 1363 (2002).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891 (2011).

