Imagerie chimique multiplex basée sur la microscopie à diffusion Raman stimulée à large bande
Summary
Nous présentons un protocole pour acquérir des images chimiques avec la microscopie à diffusion Raman stimulée à large bande (SRS). Basé sur un microscope SRS qui fonctionne avec une détection différentielle multicanal, le protocole décrit la préparation de l’échantillon, l’ajustement de l’appareil SRS et la chimiométrie pour démêler différents constituants d’échantillons chimiquement hétérogènes.
Abstract
La microscopie à diffusion Raman stimulée (SRS) est une technique optique non linéaire pour l’imagerie chimique sans étiquette. Cet outil analytique fournit des cartes chimiques à grande vitesse et une résolution spatiale élevée d’échantillons minces en interrogeant directement leurs vibrations moléculaires. Dans sa mise en œuvre standard, la microscopie SRS est à bande étroite et forme des images avec une seule fréquence vibratoire à la fois. Cependant, cette approche non seulement entrave la spécificité chimique du SRS, mais néglige également la richesse des informations codées dans les spectres vibratoires.
Ces limitations peuvent être surmontées par le SRS à large bande, une implémentation capable d’extraire un spectre vibratoire par pixel de l’image en parallèle. Cela fournit des données hyperspectrales qui, lorsqu’elles sont associées à une analyse chimiométrique, maximisent la quantité d’informations extraites de l’échantillon. Ainsi, le SRS à large bande améliore la spécificité chimique du système, permettant la détermination quantitative de la concentration des différents constituants d’un échantillon. Ici, nous rapportons un protocole d’imagerie chimique avec microscopie SRS à large bande, basé sur un microscope SRS fabriqué à la maison fonctionnant avec une détection d’amplificateur différentiel multicanal personnalisé. Il traite de la préparation de l’échantillon, de l’alignement de l’appareil SRS et de l’analyse chimiométrique. En acquérant des spectres Raman vibratoires, le protocole illustre comment identifier différentes espèces chimiques dans un mélange, en déterminant leurs concentrations relatives.
Introduction
La microscopie Raman est une technique d’imagerie puissante qui fournit de riches cartes chimiques en mesurant la diffusion Raman1, un processus radiatif inélastique qui provient de molécules vibrantes en réponse à la lumière incidente 2,3. Chaque pixel d’une carte Raman contient un spectre qui transporte des informations directes sur la composition chimique et la structure de l’échantillon, ce qui donne des images avec un contraste vibratoire intrinsèque. À ce jour, la microscopie Raman est le point de vue de référence pour les études de microspectroscopie des vibrations moléculaires, car aucune autre technique d’imagerie ne peut produire des images à la fois avec une spécificité chimique élevée et une résolution spatiale élevée4. Malgré sa spécificité chimique exceptionnelle, l’efficacité de génération de la diffusion Raman est faible, ce qui nécessite soit des temps de séjour prolongés des pixels, soit une excitation de haute puissance, entraînant respectivement de faibles taux d’acquisition et une incompatibilité avec des échantillons sensibles.
Cette seule déficience de la microscopie Raman a conduit les chercheurs à appliquer la diffusion Raman cohérente 5,6,7,8,9 comme source de contraste pour la microscopie. Il s’agit d’un processus optique non linéaire qui améliore la réponse vibratoire de plusieurs (jusqu’à sept) ordres de grandeur, permettant ainsi une imagerie chimique à grande vitesse 10,11,12,13. En particulier, les deux techniques de diffusion Raman cohérente les plus utilisées sont la diffusion Raman anti-Stokes cohérente (CARS)14 et la diffusion Raman stimulée (SRS)15. Contrairement à CARS, SRS montre une dépendance linéaire à la concentration de molécules résonnantes. Il est immunisé contre le fond non résonant, un effet non linéaire sans rapport avec une transition vibratoire mais déformant les formes lorentziennes caractéristiques des spectres Raman des vibrations moléculaires16,17. Ainsi, la microscopie SRS produit des informations Raman authentiques qui permettent une analyse quantitative directe de l’image.
SRS est un processus optique non linéaire de troisième ordre qui fournit des informations directes sur les liaisons chimiques d’un échantillon. Elle provient de la superposition spatio-temporelle de deux champs optiques généralement dans la région spectrale proche infrarouge, à savoir la pompe et les Stokes à la fréquence ωpu et ωS, respectivement 10,11,18. Cette superposition génère un battement au désaccordage de fréquence pompe-Stokes Ω = ωpu-ω S. Lorsque Ω correspond à une vibration moléculaire ΩR, la molécule résonne, provoquant un transfert d’énergie cohérent entre les champs lumineux et la molécule. En conséquence, la molécule atteint un état vibratoirement excité. Ce processus peut être surveillé en mesurant soit l’annihilation des photons de la pompe (un signal connu sous le nom de perte Raman stimulée [SRL]) ou l’amplification concomitante des photons de Stokes (un processus connu sous le nom de gain Raman stimulé [SRG]). SRG et SRL sont de petits signaux (ΔI) qui se trouvent au-dessus d’un arrière-plan intense et fluctuant (I). Comme les valeurs typiques du signal SRS (ΔI/I) sont dans la gamme 10-6-10-4, le bruit laser peut facilement l’obscurcir. Pour atténuer les effets néfastes du bruit laser sur le rapport signal/bruit (SNR) et, par conséquent, sur la vitesse d’imagerie, la détection SRS repose sur des techniques de transfert de modulation (par exemple, des amplificateurs de verrouillage, des circuits de résonance ou des moyenneurs de wagons-boîtes) à des fréquences de modulation élevées (>1 MHz), où le bruit laser atteint ses valeurs minimales 15,19,20.
La microscopie SRS conventionnelle utilise une pompe à bande étroite (≈10 cm−1) et des impulsions de Stokes pour produire des images chimiques à une seule fréquence vibratoire, permettant une imagerie à débit vidéo avec des temps de séjour en pixels aussi bas que ≈100 ns21,22. Cependant, comme la microscopie SRS à bande étroite forme des cartes chimiques en scannant séquentiellement l’échantillon à seulement quelques fréquences vibratoires, ses informations sont limitées23. Les images SRS avec un ou deux contrastes vibratoires peuvent ne pas suffire à différencier les espèces chimiques avec des bandes Raman qui se chevauchent, en particulier dans les systèmes hétérogènes. Par conséquent, le microscope SRS à bande étroite paradigmatique n’exploite pas tout le potentiel du SRS, car l’étude d’une poignée de fréquences vibratoires entrave sa spécificité chimique et néglige la richesse des informations codées dans les spectres vibratoires. De plus, le balayage séquentiel de l’échantillon à différentes fréquences entraîne des temps de séjour prolongés des pixels qui peuvent déclencher des photodommages et empêcher un corsage spatial rigoureux entre des images consécutives, conduisant à des artefacts de mouvement.
Contrairement à son homologue à bande étroite, la microscopie SRS à large bande récupère un spectre vibratoire par pixel à chaque balayage d’échantillon 10,12,24. Ainsi, le SRS à large bande fournit une imagerie hyperspectrale avec un enregistrement spatial strict des différents contrastes vibratoires, permettant une analyse rigoureuse des données. Cela révèle non seulement les constituants chimiques de l’échantillon à travers les spectres Raman, mais aide également à déterminer leurs concentrations relatives. Selon la façon dont les spectres sont acquis, la microscopie SRS à large bande est classée soit comme SRS hyperspectrale, soit srS multiplex. Dans le SRS hyperspectral, le spectre SRS par point scanné de l’échantillon est acquis séquentiellement (c’est-à-dire qu’il est récupéré en balayant le désaccordage de fréquence Ω), construisant un spectre SRS en empilant les signaux SRS lors de décalages Raman consécutifs. Le spectre Raman est mesuré simultanément à plusieurs modes vibratoires dans le SRS multiplex. Ainsi, l’approche SRS multiplex combine une impulsion modulée en bande étroite avec une impulsion à large bande pour piloter le signal SRS à différentes fréquences, et utilise un détecteur multicanal avec une sensibilité comparable à celle du SRS à bande étroite pour détecter les spectres SRS.
Cet article présente un protocole pour produire des cartes chimiques d’échantillons hétérogènes en utilisant la microscopie SRS multiplex. Un schéma du microscope SRS utilisé dans ce protocole est représenté à la figure 1 et décrit en détail ailleurs 25,26,27. En bref, un laser à fibre Yb à verrouillage de mode commercial, produisant des impulsions de 140 fs centrées à 1040 nm, avec une puissance moyenne de 10 W et un taux de répétition de 80 MHz, pilote le microscope SRS à large bande. Un séparateur de faisceau polarisant (PBS) sépare le faisceau fondamental en deux branches. Pour produire les impulsions de Stokes à bande étroite, une branche avec 4 W du faisceau fondamental est envoyée à un étalon qui génère un faisceau à bande étroite (≈15 cm-1), qui est ensuite modulé à 1,6 MHz avec un modulateur optique acoustique (AOM). La fraction restante avec 6 W du faisceau fondamental est doublée de fréquence avec un cristal de triborate de lithium (LBO) de 2,8 mm d’épaisseur, coupé pour l’appariement de phase de type I (θ = 90°, φ = 13,8°). La deuxième génération harmonique résultante à 520 nm se déplace vers une cavité pliée en X pour pomper un oscillateur paramétrique optique (OPO), un dispositif qui utilise un cristal LBO de 3,0 mm d’épaisseur (correspondance de phase de type I, θ = 90 °, φ = 9,8 °) comme milieu actif pour délivrer un rayonnement optique à large bande accordable dans la région spectrale 680-910 nm (Figure 2). Ces impulsions à large bande servent de pompe dans les expériences SRS et se propagent à un compresseur à prisme pour précompenser les effets de dispersion induits par l’objectif du microscope.
Après l’étape de compression, une plaque d’onde λ/2, combinée à une plaque biréfringente YVO4 , produit deux répliques orthogonalement polarisées dont la soustraction électronique au plan de détection annule le bruit de la pompe à large bande. Un miroir dichroïque combine la pompe et les faisceaux de Stokes et les envoie à un microscope vertical. Un objectif d’immersion dans l’eau avec une ouverture numérique (NA) de 1,27 concentre la lumière sur l’échantillon, tandis qu’un objectif d’immersion dans l’huile avec un NA de 1,4 la recueille. Avant l’étape de détection, un filtre passe-court (FPS) élimine les Stokes modulés, tandis qu’un réseau de diffraction fonctionnant en configuration Littrow disperse la pompe à large bande transmise. Un deuxième PBS2 sépare les répliques de pompe et un objectif les concentre sur deux réseaux de photodiodes. Les signaux de ces réseaux de photodiodes sont soustraits électroniquement et envoyés à un amplificateur multicanal (M-LIA) construit à la maison. Le signal démodulé est ensuite normalisé par les lectures de courant continu (DC) de l’un des réseaux de photodiodes, produisant ainsi le spectre SRL.
À titre d’expérience exemplaire, nous imageons des mélanges de plusieurs diffuseurs Raman bien connus, chacun avec un spectre Raman unique. Ainsi, le protocole commence par décrire comment préparer les échantillons de référence. Au fur et à mesure que nous détectons SRL, nous continuons à expliquer comment obtenir des impulsions Stokes à bande étroite et configurer la source optique qui délivre les impulsions de pompe à large bande (≈250 cm-1), à savoir l’OPO maison. Le protocole montre l’alignement et l’optimisation des faisceaux optiques, décrivant des paramètres critiques tels que la puissance et les spectres de la Stokes à bande étroite et de la pompe à large bande. Le protocole décrit en détail le chemin optique de la pompe à large bande car il nécessite des éléments optiques spéciaux. Il explique également comment trouver le chevauchement spatio-temporel entre les impulsions pump-Stokes et montre un moyen pratique de déterminer le bruit d’intensité relative (RIN), qui à son tour aide à définir la meilleure fréquence de modulation pour les expériences SRS. Ensuite, nous expliquons le principe de fonctionnement et l’étalonnage de la chaîne de détection. Enfin, le protocole montre le processus d’acquisition de données, la chimiométrie et le pipeline de traitement d’images.
Protocol
Representative Results
Discussion
La microscopie SRS à large bande est une technique d’imagerie puissante qui offre un contraste chimique authentique pour identifier et démêler les constituants chimiques d’un échantillon hétérogène. Le potentiel de cet outil analytique peut être bénéfique pour plusieurs domaines de recherche, allant de la science des matériaux à l’histopathologie. L’inconvénient de la microscopie SRS à large bande est le fait qu’elle est techniquement exigeante; l’expérimentateur a non seulement besoin d’un savoir-faire sur les sources laser à large bande, mais doit également manipuler les impulsions laser pour générer efficacement srS, un signal qui, à son tour, doit être mesuré avec des schémas de détection sophistiqués. Cet article présente un protocole qui décrit un flux de travail pour produire des cartes chimiques de composés chimiques mélangés à l’aide d’un microscope SRS multiplex à large bande. Bien que les travaux décrits puissent être triviaux pour certains physiciens laser et microscopistes non linéaires, ce n’est peut-être pas le cas pour les lecteurs intéressés par les avantages de la microscopie SRS à large bande dont les connaissances scientifiques résident en dehors de ces domaines. Par conséquent, nous avons cherché à détailler chaque étape pour guider le large public intéressé par la microscopie SRS à large bande.
Le protocole en question a commencé par montrer comment préparer un échantillon simple mais riche en spectroscopie composé de plusieurs diffuseurs Raman forts et bien connus. Nous avons discuté de la façon d’obtenir la pompe à large bande et les faisceaux Stokes à bande étroite nécessaires à la mise en place d’un microscope SRS. La figure 5C montre un schéma des configurations SHG et OPO. Notez que la lentille f1 focalise le faisceau fondamental sur le LBO1 pour générer le SHG, tandis qu’un miroir dichroïque réfléchit le rayonnement SHG et transmet le faisceau fondamental résiduel. Une deuxième lentille f2 collimale le faisceau SHG. Comme f2 > f1, le faisceau SHG est élargi d’un facteur égal à f2/f1. Une troisième lentille f3 focalise le faisceau SHG expansé sur un deuxième cristal LBO de type I (LBO2) coupé à θ = 90° et φ = 29,0°. En pompant le LBO2 avec le SGH susmentionné (520 nm), le rayonnement dans la plage de 680-910 nm émergera du LBO2 par génération de fréquence de différence (DFG), produisant deux faisceaux: le signal et le ralenti27 (Figure 5D, E). Ce dernier est jeté tandis que le premier est amplifié dans la cavité OPO pour délivrer les impulsions de pompe utilisées dans les expériences SRS. La pompe de l’OPO à 520 nm, à savoir le faisceau SHG, ne doit pas être confondue avec la pompe des expériences SRS (c’est-à-dire le faisceau de signal de l’OPO).
Le contraste en microscopie SRS provient d’un signal non linéaire généré au point focal du microscope, un signal qui exige de confiner un grand nombre de photons dans le plan de l’échantillon à un moment donné. Ce confinement des photons est réalisé avec un objectif de microscope à haute ouverture numérique (NA), un ensemble de lentilles qui définit également la résolution spatiale du système: plus le NA est élevé, plus la résolution spatiale est élevée. Cependant, les objectifs NA élevés sont densément remplis de verre, ce qui introduit un GDD positif au rayonnement pulsé, un gazouillis de fréquence qui élargit finalement le profil temporel des impulsions39. Ainsi, le GDD introduit par l’objectif du microscope pourrait augmenter la durée des impulsions de la pompe à large bande, la rendant encore plus longue que l’enveloppe temporelle de Stokes et réduisant la bande passante effective et accessible du signal Raman. En outre, cet élargissement pourrait également introduire une distorsion du profil spectral du spectre SRS mesuré.
Dans CARS, le signal spectroscopiquement pertinent émerge à des longueurs d’onde différentes de celles des champs d’excitation. Un simple tube photomultiplicateur ou une caméra CCD (Charge-Coupled Device) peut être utilisé pour intégrer le signal CARS à temps, résumant des milliers d’impulsions pour faire la moyenne du bruit laser. Au lieu de cela, le signal SRS apparaît comme un léger transfert de modulation intégré dans un arrière-plan laser fort et fluctuant. Parce que cette modulation est faible, le bruit laser peut facilement la submerger, réduisant à la fois la vitesse d’imagerie et la sensibilité du microscope SRS. Par conséquent, avant l’imagerie, il est impératif de mesurer le bruit d’intensité relative (RIN) pour déterminer si le laser convient à l’imagerie SRS à grande vitesse et pour sélectionner la fréquence de modulation avec le bruit le plus faible. Le RIN est défini comme la densité spectrale de puissance de bruit [δP(f), avec des unités W2/Hz] du laser normalisée par la puissance optique moyenne (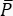 )40,41. En d’autres termes, le RIN décrit les fluctuations laser normalisées à différentes fréquences (Eq [4]).
)40,41. En d’autres termes, le RIN décrit les fluctuations laser normalisées à différentes fréquences (Eq [4]).
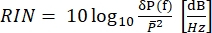 (4)
(4)
Ainsi, le RIN est un paramètre du système SRS qui détermine la gamme de fréquences de modulation idéale pour les expériences. Par exemple, la barre d’olive de la figure 8 montre la plage de fréquences de modulation idéale pour l’imagerie SRS. Dans le cas du SRS à bande étroite, l’utilisateur doit mesurer le RIN de la pompe et de Stokes pour choisir le faisceau à moduler pour obtenir des performances optimales. Notez de la figure 8, par exemple, que le faisceau de Stokes a un RIN légèrement plus élevé que la pompe, ce qui implique que les mesures SRG s’avéreraient plus bruyantes que leurs homologues SRL. Dans le cas du SRS à large bande, le faisceau à moduler est le faisceau à bande étroite.
La dispersion angulaire D du réseau exprime l’angle de diffraction en fonction de la longueur d’onde et est définie comme la dérivée de l’équation du réseau. Pour la configuration de Littrow, la dispersion angulaire est donnée par Eq (5).
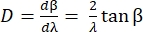 (5)
(5)
Pour obtenir Eq (5), nous avons supposé α = β, résolu Eq (2) pour m/d et inséré le résultat dans dβ/ dλ. Notez que dans la configuration de Littrow, β = sin-1(mλ/2d). Dans l’approximation à petit angle, le changement de position le long du spectre est fdβ ≈ dl (Figure 10). Ainsi, en insérant dβ dans Eq (5), on peut calculer la dispersion linéaire, une grandeur avec des unités de nm mm-1 en utilisant Eq (6) :
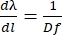 (6)
(6)
Pour un réseau de diffraction fonctionnant dans la configuration Littrow avec 1 851,85 rainures/mm, d = 540 nm. Si nous utilisons la diffraction de premier ordre de la lumière à ~789 nm, D = 0,0027 rad nm-1. Avec un objectif f = 750 mm, nous obtenons une dispersion linéaire de ≈ 0,5 nm mm-1, se traduisant par ≈ 7,8 cm-1 mm-1. Ainsi, la distance focale de la lentille détermine la « densité » de nm par mm au niveau du plan du détecteur : plus la distance focale est longue, moins on obtient de nm par mm, ce qui augmente l’espace entre les raies spectrales de la pompe à large bande. Inversement, avec des distances focales plus courtes, il y aura plus de nm par mm au niveau du plan du détecteur, ce qui réduira l’espace occupé par la pompe dispersée.
La détection équilibrée améliore la qualité d’image et la sensibilité des configurations bruyantes. Par exemple, selon les spectres RIN illustrés à la figure 8 et compte tenu du SRS typique d’une amplitude de 1 x 10-5, le rapport signal/bruit (SNR) déséquilibré est de ≈60. En utilisant une détection équilibrée (c’est-à-dire proche du bruit de tir), il est possible d’atteindre un SNR de ≈145. La figure 11 montre des spectres et des images composites dans des conditions équilibrées et déséquilibrées. Naturellement, les effets de la détection équilibrée ont un impact sur les résultats finaux des expériences, à savoir les cartes chimiques. Forts de ces résultats, nous soulignons que la détection équilibrée est une technique puissante pour contrer les effets néfastes des fluctuations laser sur la qualité de l’image. Il convient de mentionner que la détection équilibrée est la mieux adaptée aux lasers bruyants, tels que les oscillateurs à fibre. Les microscopes SRS fonctionnant avec des sources lumineuses optiques silencieuses (p. ex., les lasers à semi-conducteurs) peuvent ne pas nécessiter une détection équilibrée.
Le protocole explique également une approche basée sur l’optique non linéaire pour trouver le chevauchement spatio-temporel entre les impulsions de ces faisceaux. Nous avons décrit les avantages d’utiliser le 1ème au lieu du 0ème ordre de diffraction d’une AOM comme faisceau de Stokes modulé. En outre, les effets néfastes de la dispersion sur l’efficacité de la production de SRS ont été décrits avec des suggestions de moyens de les atténuer via un compresseur à prisme. En outre, le protocole explique comment aligner les prismes et met en évidence trois aspects critiques à prendre en compte pour des performances optimales. Nous discutons non seulement de la pertinence du RIN pour la microscopie SRS, mais nous montrons également comment le mesurer avec un amplificateur à verrouillage et, avec le spectre RIN, définir la meilleure fréquence de modulation. Avec un exemple concret, cet article explique comment l’équation de caillebotis aide à concevoir la chaîne de détection. Enfin, le protocole illustre, avec des données SRS réelles, la structure de l’hypercube SRS et comment l’analyser avec un langage de programmation scientifique classiquement utilisé.
Ce protocole comporte trois limitations mineures. Tout d’abord, le schéma de détection utilisé dans cette contribution consiste en un détecteur de verrouillage multicanal non conventionnel conçu et construit en interne par Sciortino et al.26 Comme démontré précédemment25, ce détecteur peut être remplacé par une photodiode équilibrée prête à l’emploi. Bien que cette modification ne concerne que le détecteur et laisse le protocole pratiquement inchangé, avec une photodiode unique, il faut scanner chaque composant spectral du détecteur au lieu de les mesurer tous en même temps. Deuxièmement, ce protocole utilise la détection équilibrée en ligne, ce qui nécessite l’insertion de plusieurs éléments optiques dans le trajet du faisceau. Ces éléments optiques augmentent la complexité du système et entraînent des pertes de puissance optique et un élargissement des impulsions.
La détection équilibrée en ligne exige également que les deux répliques de pompe traversent l’échantillon, une situation qui peut ne pas être idéale pour les échantillons sensibles à la lumière, tels que les cellules vivantes, ou pour les échantillons fortement biréfringents dans lesquels les deux répliques de pompe peuvent présenter des propriétés optiques différentes, annulant ainsi la détection équilibrée. Troisièmement, le protocole repose sur un OPO construit à la maison, un appareil qui peut ne pas être facilement disponible. Cependant, les alternatives aux spectres à large bande délivrés par l’OPO sont le supercontinua des fibres optiques non linéaires ou des cristaux en vrac. Ce dernier ne pouvait être utilisé qu’avec des lasers à faible taux de répétition (jusqu’à 5 MHz). Ainsi, comme pour toute conception expérimentale, le protocole en question présente certaines limites. Cependant, ils sont minimes et ne compromettent pas le succès de cette approche.
Bien qu’un échantillon de référence soit décrit ici, ce protocole peut démêler avec succès des espèces chimiques dans les cellules et les tissus animaux et végétaux, tels que la cellulose, les espèces lipidiques ou les protéines, trouvant des applications pratiques dans différentes quêtes biochimiques ou comme outil de diagnostic en histopathologie. De même, ce protocole peut être un outil précieux en sciences des matériaux. Par exemple, en suivant ce protocole, on peut interroger la composition moléculaire et la concentration des espèces polymères42. En outre, cette méthodologie est compatible avec d’autres techniques de microscopie non linéaire, telles que la microscopie à large bande basée sur la sonde pompe43 et les procédés de mélange hétérodyne CARS44 à quatre ondes qui, comme avec SRS, nécessitent également deux faisceaux lumineux d’excitation et des mesures de modulation-transfert. Enfin, certaines des informations contenues dans cet article peuvent être appliquées à des techniques d’imagerie non linéaire qui ne reposent pas sur des techniques de transfert de modulation, mais nécessitent l’alignement de deux faisceaux laser pulsés ou plus, tels que les microscopies conventionnelles CARS45 et SFG46.
En résumé, ce protocole décrit une méthodologie puissante basée sur la microscopie SRS à large bande pour extraire des cartes chimiques et leurs spectres SRS caractéristiques à partir de mélanges chimiquement hétérogènes, fournissant des ensembles de données qui permettent une analyse quantitative simple des données. La polyvalence et la simplicité de la méthode donnent également au lecteur intéressé la possibilité de l’adapter à différentes techniques non linéaires.
Disclosures
The authors have nothing to disclose.
Acknowledgements
D. P. reconnaît le financement du projet CRIMSON de l’Union européenne dans le cadre de la convention de subvention n° 101016923 et du projet NEWMED de la région Lombardie au titre de la convention de subvention n° POR FESR 2014-2020. G. C. reconnaît le financement du projet de l’Union européenne GRAPHENE Core3 dans le cadre de la convention de subvention numéro 881603. G. C. reconnaît également le financement de l’Université des sciences et de la technologie du roi Abdallah, numéro de subvention: OSR-2016-CRG5-3017-01.
Materials
| Collection objective | Nikon | CFI Apo Lambda S 60x Oil, NA=1.4, Nikon | Oil immersion objective |
| Coverslips | Thermo Fisher | 043211-KJ | Quartz, cover slip for microscope slide, 25.4 x 25.4 x 0.15 mm |
| Delay line | Physik Instrumente (PI) | M-406.6PD | Precision microtranslation stage, 150 mm travel range |
| DMSO | Merck | D8418-500ML | Methylsulfinylmethane, Molecular Biology Grade DMSO, DMSO, Methyl Sulfoxide |
| Etalon | SLS Optics Ltd | Custom made | Anti reflective coating at 1,040 nm, Mounted in a 38 mm diameter x 35.5 mm long stainless steel cell with protective dust caps, and a 50 mm diameter ‘pinch-clamp’ mounting ring |
| Excitation objective | Nikon | CFI Plan Apo IR 60XC WI, NA=1.27, Nikon | Water immersion objective |
| Grating | LightSmyth | T-1850-800s Series | High Efficiency Transmission Grating T-1850-800s Series |
| Laser | Coherent | Custom made | Fidelity, HP |
| λ/2 | Thorlabs | SAHWP05M-1700 | Mounted superachromatic half-wave plate |
| PBS | Thorlabs | CM5-PBS203/M | 16 mm Cage-Cube-Mounted Polarizing Beamsplitter Cube, |
| PMMA beads | Merck | MFCD00198073 | Micro particles based on polymethacrylate |
| Prisms | Crisel | 320-8218 | LASER DISPERSING PRISMS in SF11 |
| PS beads | Merck | 72986-10ML-F | Micro particles based on polystyrene |
| YVO4 crystal | Dr. Sztatecsny GmbH | Custom made | thickness 8 mm, dia 1.00 cm, 1 689,00 689,00 suitable for 1" mount, coated for 850 – 1,100 nm |
References
- Stewart, S., Priore, R. J., Nelson, M. P., Treado, P. J. Raman Imaging. Annual Review of Analytical Chemistry. 5 (1), 337-360 (2012).
- Smekal, A. Zur quantentheorie der dispersion. Die Naturwissenschaften. 11 (43), 873-875 (1923).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Vanna, R., et al. Vibrational imaging for label-free cancer diagnosis and classification. La Rivista del Nuovo Cimento. 45, 107-187 (2021).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Hellwarth, R. W. Theory of stimulated Raman scattering. Physical Review. 130 (5), 1850-1852 (1963).
- Maker, P. D., Terhune, R. W. Study of optical effects due to an induced polarization third order in the electric field strength. Physical Review. 137 (3), 801-818 (1965).
- Bloembergen, N. The stimulated Raman effect. American Journal of Physics. 35 (11), 989-1023 (1967).
- Levenson, M. D., Flytzanis, C., Bloembergen, N. Interference of resonant and nonresonant three-wave mixing in diamond. Physical Review B. 6 (10), 3962-3965 (1972).
- Polli, D., Kumar, V., Valensise, C. M., Marangoni, M., Cerullo, G. Broadband coherent Raman scattering microscopy. Laser & Photonics Reviews. 12 (9), 1800020 (2018).
- Rigneault, H., Berto, P. Tutorial: Coherent Raman light matter interaction processes. APL Photonics. 3 (9), 091101 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-stokes raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363 (2009).
- Valensise, C. M., et al. Removing non-resonant background from CARS spectra via deep learning. APL Photonics. 5 (6), 061305 (2020).
- Cheng, J. X., Xie, X. S. . Coherent Raman scattering microscopy. , (2012).
- Slipchenko, M. N., Oglesbee, R. A., Zhang, D., Wu, W., Cheng, J. X. Heterodyne detected nonlinear optical imaging in a lock-in free manner. Journal of Biophotonics. 5 (10), 801-807 (2012).
- Blume, R. J. Boxcar” integrator with long holding times. Review of Scientific Instruments. 32 (9), 1016-1018 (1961).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Sarri, B., et al. Stimulated Raman histology: one to one comparison with standard hematoxylin and eosin staining. Biomedical Optics Express. 10 (10), 5378 (2019).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- De la Cadena, A., et al. Broadband stimulated Raman imaging based on multi-channel lock-in detection for spectral histopathology. APL Photonics. 7 (7), (2022).
- Dela Cadena, A., Valensise, C. M., Marangoni, M., Cerullo, G., Polli, D. Broadband stimulated Raman scattering microscopy with wavelength-scanning detection. Journal of Raman Spectroscopy. 51 (10), 1951-1959 (2020).
- Sciortino, G., et al. Four-channel differential lock-in amplifiers with autobalancing network for stimulated Raman spectroscopy. IEEE Journal of Solid-State Circuits. 56 (6), 1859-1870 (2021).
- Coluccelli, N., et al. Tunable 30 fs light pulses at 1 W power level from a Yb-pumped optical parametric oscillator. Optics Letters. 42 (21), 4545 (2017).
- Monmayrant, A., Weber, S., Chatel, B. A newcomer’s guide to ultrashort pulse shaping and characterization. Journal of Physics B: Atomic, Molecular and Optical Physics. 43 (10), 103001 (2010).
- Fork, R. L., Martinez, O. E., Gordon, J. P. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150 (1984).
- Crisafi, F., et al. In-line balanced detection stimulated Raman scattering microscopy. Scientific Reports. 7 (1), 10475 (2017).
- Alem, M. Noise spectral density measured with lock-in amplifiers. Zurich Instruments Company Blog. , (2021).
- Palmer, C., Loewen, E. G. . Diffraction grating handbook. , (2005).
- . Multivariate curve resolution homepage Available from: https://mcrals.wordpress.com/download/mcr-als-2-0-toolbox/ (2021)
- Tauler, R. Multivariate curve resolution applied to second order data. Chemometrics and Intelligent Laboratory Systems. 30 (1), 133-146 (1995).
- de Juan, A., Jaumot, J., Tauler, R. Multivariate Curve Resolution (MCR). Solving the mixture analysis problem. Analytical Methods. 6 (14), 4964-4976 (2014).
- Zhang, D., et al. Quantitative vibrational imaging by hyperspectral stimulated Raman scattering microscopy and multivariate curve resolution analysis. Analytical Chemistry. 85 (1), 98-106 (2013).
- Chitra Ragupathy, I., Schweikhard, V., Zumbusch, A. Multivariate analysis of hyperspectral stimulated Raman scattering microscopy images. Journal of Raman Spectroscopy. 52 (9), 1630-1642 (2021).
- Brown, S. D., Tauler, R., Walczak, B. . Comprehensive Chemometrics: Chemical and Biochemical Data Analysis. , (2020).
- Guild, J. B., Xu, C., Webb, W. W. Measurement of group delay dispersion of high numerical aperture objective lenses using two-photon excited fluorescence. Applied Optics. 36 (1), 397 (1997).
- RP Photonics Encyclopedia. Article on "Relative Intensity Noise." Available from: https://www.rp-photonics.com/relative_intensity_noise.html (2021)
- Audier, X., Heuke, S., Volz, P., Rimke, I., Rigneault, H. Noise in stimulated Raman scattering measurement: From basics to practice. APL Photonics. 5 (1), 011101 (2020).
- Xu, S., Camp, C. H., Lee, Y. J. Coherent anti-Stokes Raman scattering microscopy for polymers. Journal of Polymer Science. , (2021).
- Davydova, D., de al Cadena, A., Akimov, D., Dietzek, B. Transient absorption microscopy: advances in chemical imaging of photoinduced dynamics. Laser & Photonics Reviews. 10 (1), 62-81 (2016).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241 (2006).
- Cheng, J. X., Volkmer, A., Xie, X. S. Theoretical and experimental characterization of coherent anti-Stokes Raman scattering microscopy. Journal of the Optical Society of America B. 19 (6), 1363 (2002).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891 (2011).

