広帯域刺激ラマン散乱顕微鏡に基づく多重化学イメージング
Summary
我々は、広帯域刺激ラマン散乱(SRS)顕微鏡で化学画像を取得するためのプロトコルを提示する。差動マルチチャンネルロックイン検出で動作するSRS顕微鏡に基づいて、このプロトコルは、サンプル調製、SRS装置の調整、および化学的に不均一なサンプルの異なる成分を解きほぐすためのケモメトリックスを記述しています。
Abstract
誘導ラマン散乱(SRS)顕微鏡は、ラベルフリーの化学イメージングのための非線形光学技術です。この分析ツールは、薄いサンプルの分子振動を直接調べることで、薄いサンプルの高速かつ高い空間分解能で化学マップを提供します。その標準的な実装では、SRS顕微鏡は狭帯域であり、一度に単一の振動周波数のみを有する画像を形成する。しかし、このアプローチはSRSの化学的特異性を妨げるだけでなく、振動スペクトル内にコード化された豊富な情報を無視します。
これらの制限は、広帯域SRSによって克服することができ、画像のピクセル当たりの振動スペクトルを並列に抽出することができる実装である。これにより、化学測定分析と組み合わせると、検体から取得される情報量を最大化するハイパースペクトルデータが提供されます。したがって、広帯域SRSは、システムの化学的特異性を改善し、試料の異なる構成成分の濃度の定量的決定を可能にする。ここでは、カスタム差動マルチチャンネルロックインアンプ検出で動作する自家製のSRS顕微鏡に基づいて、広帯域SRS顕微鏡による化学イメージングのプロトコルを報告します。サンプル調製、SRS装置の位置合わせ、およびケモメトリック分析について説明します。振動ラマンスペクトルを取得することにより、プロトコルは、混合物内の異なる化学種を同定し、それらの相対濃度を決定する方法を示す。
Introduction
ラマン顕微鏡は、入射光2,3に応答して振動する分子に由来する非弾性放射プロセスであるラマン散乱1を測定することによって、豊富な化学マップを提供する強力なイメージング技術です。ラマンマップの各ピクセルには、サンプルの化学組成と構造に関する直接的な情報を含むスペクトルが含まれており、固有の振動コントラストを持つ画像が得られます。今日まで、ラマン顕微鏡は、他のイメージング技術では高い化学的特異性と高い空間分解能の両方を持つ画像を生成することができないため、分子振動のマイクロ分光法研究の基準的立場です4。その優れた化学的特異性にもかかわらず、ラマン散乱の発生効率は低く、ピクセル滞留時間の延長または高出力励起のいずれかが必要であり、それぞれ低い集録率と敏感なサンプルとの非互換性につながります。
ラマン顕微鏡のこの単一の欠陥により、研究者はコヒーレントなラマン散乱5、6、7、8、9を顕微鏡検査のコントラスト源として適用することになった。これは、振動応答を数桁(最大7桁)高める非線形光学プロセスであり、したがって、高速化学画像化10、11、12、13を可能にする。特に、最も採用されている2つのコヒーレントラマン散乱技術は、コヒーレント抗ストークスラマン散乱(CARS)14および刺激ラマン散乱(SRS)15である。CARSとは対照的に、SRSは共鳴分子の濃度に線形依存性を示す。それは非共鳴背景の影響を受けず、いかなる振動遷移にも無関係であるが、分子振動16,17のラマンスペクトルに特徴的なローレンツ形状に歪曲する非線形効果である。したがって、SRS顕微鏡検査は、直接定量的な画像分析を可能にする本物のラマン情報を生成します。
SRSは、サンプルの化学結合に関する直接情報を提供する3次非線形の光学プロセスです。これは、一般に近赤外スペクトル領域における2つの光学場、すなわち周波数ωpuおよびωSにおけるポンプおよびストークスの時空間重ね合わせに由来し、それぞれ10、11、18である。この重ね合わせは、ポンプストークス周波数デチューンΩ=ωpu-ω Sで拍動を発生させる。Ωが分子振動ΩRと一致すると、分子は共鳴し、光場と分子の間に一貫したエネルギー移動を引き起こす。その結果、分子は振動励起状態に達する。このプロセスは、ポンプ光子の消滅(刺激ラマン損失[SRL]として知られる信号)またはストークス光子の付随する増幅(刺激ラマンゲイン[SRG]として知られるプロセス)のいずれかを測定することによって監視することができる。SRGとSRLは、強烈で変動する背景(I)の上に座る小さな信号(ΔI)です。SRS信号の標準値(ΔI/I)は10-6-10-4の範囲にあるため、レーザーノイズによって容易に不明瞭になる可能性があります。レーザーノイズが信号対雑音比(SNR)に、ひいてはイメージング速度に及ぼす有害な影響を軽減するために、SRS検出は、レーザーノイズが最小値15、19、20に達する高変調周波数(>1MHz)での変調転送技術(ロックインアンプ、共振回路、ボックスカー平均器など)に依存しています。
従来のSRS顕微鏡は、狭帯域(≈10cm-1)ポンプとストークスパルスを用いて単一の振動周波数で化学画像を生成するため、100ns21,22の低画素滞留時間でのビデオレートイメージングが可能で≈。しかしながら、狭帯域SRS顕微鏡は、ほんの数振動周波数で試料を順次走査することによって化学マップを形成するので、その情報は限定的である23。1つまたは2つの振動コントラストを持つSRS画像は、特に異種系内で、ラマンバンドが重なり合う化学種を区別するのに十分ではないかもしれません。したがって、パラダイム的な狭帯域SRS顕微鏡は、一握りの振動周波数を調べることはその化学的特異性を妨げ、振動スペクトル内にコード化された豊富な情報を無視するため、SRSの可能性を最大限に活用しません。さらに、異なる周波数でのサンプルのシーケンシャルスキャンは、光損傷を引き起こし、連続する画像間の厳密な空間的共登録を防ぎ、モーションアーチファクトにつながるピクセル滞留時間を延長する結果をもたらす。
その狭帯域対応物とは対照的に、広帯域SRS顕微鏡は、各サンプルスキャン10、12、24でピクセルごとの振動スペクトルを取得する。したがって、広帯域SRSは、異なる振動コントラストの厳密な空間的共登録を伴うハイパースペクトルイメージングを提供し、厳密なデータ分析を可能にする。これは、ラマンスペクトルを通して試料の化学成分を明らかにするだけでなく、それらの相対濃度を決定するのにも役立ちます。スペクトルの取得方法に応じて、広帯域SRS顕微鏡はハイパースペクトルSRSまたはマルチプレックスSRSのいずれかに分類されます。ハイパースペクトルSRSでは、サンプルの走査点当たりのSRSスペクトルを順次取得し(すなわち、周波数デチューンΩを掃引して取得し)、連続したラマンシフトでSRS信号を積み重ねてSRSスペクトルを構築する。ラマンスペクトルは、マルチプレックスSRSの複数の振動モードで同時に測定されます。したがって、多重SRSアプローチは、変調された狭帯域パルスと広帯域パルスを組み合わせて異なる周波数でSRS信号を駆動し、狭帯域SRSに匹敵する感度を有するマルチチャネル検出器を使用してSRSスペクトルを検出する。
この論文では、多重SRS顕微鏡を使用して異種サンプルの化学マップを作成するためのプロトコルを提示する。このプロトコルで採用されたSRS顕微鏡のスキームを 図1 に示し、他の場所25、26、27で詳細に説明する。簡単に言うと、1040nmを中心とする140fsパルスを生成し、平均電力が10W、繰り返しレートが80MHzの商用モードロックYbファイバレーザが広帯域SRS顕微鏡を駆動します。偏光ビームスプリッタ(PBS)は、基本ビームを2つの分岐に分離します。狭帯域ストークスパルスを生成するために、基本ビームの4Wを有する1つの分岐が狭帯域(≈15cm-1)ビームを生成するエタロンに送られ、次いで音響光学変調器(AOM)を用いて1.6MHzで変調される。基本ビームの6Wを持つ残りのフラクションは、厚さ2.8mmの三ホウ酸リチウム(LBO)結晶で周波数を2倍にし、タイプIの位相マッチング(θ = 90°、φ = 13.8°)のために切断します。その結果、520nmでの第2高調波発生は、厚さ3.0mmのLBO水晶(タイプI位相マッチング、θ = 90°、φ = 9.8°)を活性媒体として使用し、680~910nmのスペクトル領域内で調整可能な広帯域の光放射を提供するデバイスである光パラメトリック発振器(OPO)をポンピングするためにX折り畳みキャビティに移動します(図2)。これらの広帯域パルスは、SRS実験においてポンプとして機能し、プリズムコンプレッサに伝播して顕微鏡対物レンズによって誘導される分散効果を事前に補償する。
圧縮段の後、λ/2波長板をYVO4 複屈折板と組み合わせると、検出面での電子減算によって広帯域ポンプのノイズが相殺される2つの直交偏光レプリカが生成されます。ダイクロイックミラーは、ポンプビームとストークスビームを組み合わせて、直立顕微鏡に送ります。開口数(NA)が1.27の水浸漬対物レンズは光をサンプルに集光し、NAが1.4の油浸対物レンズはサンプルを収集します。検出段の前に、ショートパスフィルタ(SPF)が変調されたストークスを除去し、リットロー構成で動作する回折格子が透過広帯域ポンプを分散させます。2番目のPBS 2がポンプレプリカを分離し、レンズがそれらを2 つのフォトダイオードアレイに集束させます。これらのフォトダイオードアレイからの信号は電子的に減算され、自家製のマルチチャンネルロックインアンプ(M-LIA)に送られます。復調された信号は、フォトダイオードアレイの1つの直流(DC)読み取り値によって正規化され、SRLスペクトルが生成されます。
例示的な実験として、我々は、それぞれが固有のラマンスペクトルを有するいくつかのよく知られているラマン散乱体の混合物を画像化する。したがって、プロトコルは、参照サンプルを準備する方法を説明することから始まります。SRLを検出したら、狭帯域ストークスパルスの取得方法と、広帯域(≈250cm-1)ポンプパルスを供給する光源、すなわち自家製OPOの設定方法について引き続き説明します。このプロトコルは、光ビームのアライメントと最適化を示し、狭帯域ストークスや広帯域ポンプのパワーやスペクトルなどの重要なパラメータを記述します。このプロトコルは、特殊な光学素子を必要とするため、広帯域ポンプの光路を詳細に記述しています。また、ポンプストークスパルス間の時空間的なオーバーラップを見つける方法についても説明し、相対強度ノイズ(RIN)を決定する実用的な方法を示し、SRS実験に最適な変調周波数を定義するのに役立ちます。次に、検出チェーンの動作原理と較正について説明します。最後に、プロトコルは、データ収集プロセス、ケモメトリックス、および画像処理パイプラインを示しています。
Protocol
Representative Results
Discussion
広帯域SRS顕微鏡は、不均一なサンプルの化学成分を同定し、解きほぐすために本物の化学的コントラストを提供する強力なイメージング技術です。この分析ツールの可能性は、材料科学から組織病理学に至るまで、いくつかの研究分野にとって有益であり得る。ブロードバンドSRS顕微鏡の欠点は、技術的に要求が厳しいという事実です。実験家は、広帯域レーザー光源に関するノウハウを必要とするだけでなく、レーザーパルスを操作してSRSを効率的に生成する必要があり、その信号は高度な検出方式で測定する必要があります。この論文は、多重広帯域SRS顕微鏡を使用して混合化合物の化学マップを生成するワークフローを記述するプロトコルを提示する。説明されている研究は、一部のレーザー物理学者や非線形顕微鏡学者にとっては些細なことかもしれませんが、科学的知識がこれらの領域外に存在するブロードバンドSRS顕微鏡の利点に興味がある読者にとっては当てはまらないかもしれません。したがって、私たちは、ブロードバンドSRS顕微鏡に興味を持つ幅広い聴衆を導くために、すべてのステップを詳述することを目的としていました。
手元にあるプロトコルは、いくつかの強力で有名なラマン散乱体で構成されるシンプルでありながら分光学的に豊富なサンプルを調製する方法を示すことから始まりました。SRS顕微鏡のセットアップに必要な広帯域ポンプと狭帯域ストークスビームの入手方法について説明しました。図 5C は、SHG セットアップと OPO セットアップのスキームを示しています。レンズf1は基本ビームをLBO1に集束させてSHGを生成し、ダイクロイックミラーはSHG放射を反射して残留基本ビームを透過することに注意してください。第2レンズf2は、SHGビームを平行化する。f 2 > f 1 として、SHG ビームは f2/f1 に等しい係数だけ拡張されます。第3レンズf3は、膨張したSHGビームをθ=90°およびφ=29.0°で切断された第2のI型LBO結晶(LBO2)に集束させる。前述のSGH(520nm)でLBO 2をポンピングすることにより、680〜910nmの範囲内の放射が差分周波数生成(DFG)を介してLBO 2から出現し、信号とアイドラー27の2つのビームを生成する(図5D、E)。後者は廃棄され、前者はOPOキャビティ内で増幅され、SRS実験で使用されたポンプパルスを送達する。520nmにおけるOPOのポンプ、すなわちSHGビームは、SRS実験のポンプ(すなわち、OPOの信号ビーム)と混同してはならない。
SRS顕微鏡におけるコントラストは、顕微鏡の焦点で生成された非線形信号、すなわち所定の時間に試料平面内に多数の光子を閉じ込めることを要求する信号に由来する。この光子閉じ込めは、高開口数(NA)顕微鏡の対物レンズ、系の空間分解能も設定するレンズの配列で達成される:NAが高いほど、空間分解能は高い。しかしながら、高いNA対物レンズはガラスで密に詰め込まれており、これはパルス放射に正のGDDをもたらし、パルス39の時間的プロファイルを最終的に広げる周波数チャープである。したがって、顕微鏡対物レンズによって導入されたGDDは、広帯域ポンプパルスの持続時間を増加させ、ストークス時間エンベロープよりもさらに長くし、ラマン信号の有効でアクセス可能な帯域幅を減少させる可能性がある。さらに、この拡大は、測定されたSRSスペクトルのスペクトルプロファイルの歪みも引き起こす可能性がある。
CARSでは、分光学的に関連する信号は、励起場の波長とは異なる波長で出現します。シンプルな光電子増倍管または電荷結合素子(CCD)カメラを使用して、CARS信号を時間内に統合し、数千パルスを合計してレーザーノイズを平均化することができます。代わりに、SRS信号は、強く変動するレーザー背景に埋め込まれたかすかな変調転送として表示されます。この変調は弱いため、レーザーノイズが容易にそれを圧倒し、SRS顕微鏡のイメージング速度と感度の両方を低下させる可能性があります。したがって、イメージングの前に、相対強度ノイズ(RIN)を測定して、レーザが高速SRSイメージングに適しているかどうかを判断し、ノイズが最も低い変調周波数を選択することが不可欠です。RINは、平均光パワー()40,41で正規化されたレーザーのノイズパワースペクトル密度[δP(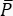 f)、W2/Hz単位]として定義されます。言い換えれば、RINは異なる周波数での正規化されたレーザー変動を記述する(Eq [4])。
f)、W2/Hz単位]として定義されます。言い換えれば、RINは異なる周波数での正規化されたレーザー変動を記述する(Eq [4])。
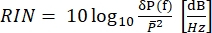 (4)
(4)
したがって、RINは、実験のための理想的な変調周波数範囲を決定するSRSシステムのパラメータである。たとえば、 図8 のオリーブバーは、SRSイメージングに理想的な変調周波数範囲を示しています。狭帯域SRSの場合、ユーザーはポンプとストークスの両方のRINを測定して、最適な性能を達成するために変調する必要があるビームを選択する必要があります。たとえば、 図8から、ストークスビームのRINはポンプよりもわずかに高いため、SRG測定はSRL測定よりもノイズが多いことが示唆されています。広帯域SRSの場合、変調すべきビームは狭帯域ビームである。
格子の角度分散 D は、回折角を波長の関数として表し、格子方程式の微分として定義される。リットロー配置の場合、角度分散は式(5)で与えられる。
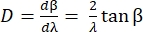 (5)
(5)
Eq (5) を得るために、α = βと仮定し、m/d の Eq (2) を解き、その結果を d β/d λ に挿入します。リトロウ構成では、β = sin-1(m λ/2 d) であることに注意してください。小角近似では、スペクトルに沿った位置の変化はfdβ ≈dlです(図10)。したがって、式(5)にdβを挿入することにより、式(6)を使用してnmmm-1の単位を持つ線形分散量を計算できます。
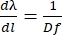 (6)
(6)
1,851.85 溝/mmのリットロー構成で動作する回折格子の場合、d = 540 nmです。約789 nmの光の一次回折を使用すると、D = 0.0027 rad nm-1になります。f = 750 mm レンズでは、≈ 0.5 nm mm-1 の線形分散が得られ、≈ 7.8 cm-1 mm-1 に変換されます。したがって、レンズの焦点距離は、検出器平面におけるnm/mmの「密度」を決定する:焦点距離が長いほど、得られるnm/mmは少なくなり、広帯域ポンプのスペクトル線間の空間が増加する。逆に、焦点距離が短いと、検出器平面でmmあたりのnmが多くなり、分散ポンプが占有するスペースが減少します。
バランスの取れた検出により、ノイズの多いセットアップの画質と感度が向上します。 たとえば、図8に示すRINスペクトルに従って、振幅が1 x 10-5の典型的なSRSを考慮すると、不平衡信号対雑音比(SNR)は≈60です。バランスの取れた検出(すなわち、ショットノイズに近い)を使用して、≈145のSNRを達成することができる。図11は、平衡条件下および不均衡条件下でのスペクトルおよび合成画像を示す。当然のことながら、バランスのとれた検出の効果は、実験の最終結果、すなわち化学マップに影響を与える。これらの結果に裏付けられて、我々は、バランスの取れた検出が画質に対するレーザー変動の有害な影響に対抗する強力な技術であることを強調する。 バランスの取れた検出は、ファイバ発振器などのノイズの多いレーザに最も適していることに言及する価値があります。静かな光学光源(例えば、固体レーザー)で動作するSRS顕微鏡は、バランスのとれた検出を必要としないかもしれない。
このプロトコルはまた、これらのビームのパルス間の時空間的重複を見つけるための非線形光学に基づくアプローチも説明する。AOMの0番目の回 折次数の代わりに1st を変調ストークスビームとして使用する利点について説明しました。さらに、SRS生成効率に対する分散の有害な影響は、プリズムコンプレッサを介してそれらを緩和する方法の提案とともに説明されました。さらに、このプロトコルでは、プリズムの位置合わせ方法を説明し、最適な性能を得るために考慮すべき3つの重要な側面を強調しています。SRS顕微鏡に対するRINの関連性について論じるだけでなく、ロックインアンプでRINを測定し、RINスペクトルを使用して最適な変調周波数を定義する方法も示します。このホワイトペーパーでは、具体的な例を挙げて、格子方程式が検出チェーンの設計にどのように役立つかを説明します。最後に、このプロトコルは、実際のSRSデータを使用して、SRSハイパーキューブの構造と、従来使用されてきた科学プログラミング言語で分析する方法を示しています。
このプロトコルには 3 つの小さな制限があります。第一に、この貢献で採用された検出方式は、Sciortino et al.26によって社内で設計および構築された非従来型のマルチチャンネルロックイン検出器で構成されています25で実証したように、この検出器は既製の平衡フォトダイオードに置き換えることができます。この変更は検出器にのみ関係し、プロトコルは実質的に変更されませんが、単一のフォトダイオードでは、検出器上の各スペクトル成分を一度にすべて測定するのではなく、スキャンする必要があります。第2に、このプロトコルはインライン平衡検出を採用しており、ビーム経路にいくつかの光学素子を挿入する必要があります。これらの光学素子は、システムの複雑さを増大させ、光パワーの損失とパルスの広がりにつながります。
インラインバランス検出はまた、2つのポンプレプリカがサンプルを通過することを要求し、生細胞などの光感受性サンプル、または2つのポンプレプリカが異なる光学特性を経験する可能性がある強複屈折サンプルには理想的ではない可能性があり、したがってバランスのとれた検出をキャンセルする。第三に、このプロトコルは自家製のOPOに依存しており、容易には入手できない可能性があるデバイスです。しかし、OPOによって送達される広帯域スペクトルの代替案は、非線形光ファイバまたはバルク結晶からの超連続体である。後者は、低繰り返しレートレーザ(最大5MHz)でのみ採用できた。したがって、すべての実験計画と同様に、手元にあるプロトコルにはいくつかの制限があります。ただし、それらは最小限であり、このアプローチの成功を損なうことはありません。
参照サンプルがここで説明されていますが、このプロトコルは、セルロース、脂質種、タンパク質などの細胞および動植物組織内の化学種をうまく解きほぐし、さまざまな生化学的探求における実用的な用途や組織病理学における診断ツールとして見つけることができます。同様に、このプロトコルは材料科学において貴重なツールとなり得ます。例えば、このプロトコールに従って、ポリマー種42の分子組成および濃度を調べることができる。さらに、この方法論は、ポンププローブ43およびヘテロダインCARS44に基づく広帯域顕微鏡法、SRSと同様に、2つの励起光ビームおよび変調伝達測定も必要とする4波混合プロセスなどの他の非線形顕微鏡技術と互換性がある。最後に、この論文に含まれる情報の一部は、変調伝達技術に依存しないが、従来のCARS45およびSFG顕微鏡46のような2つ以上のパルスレーザビームを位置合わせすることを必要とする非線形画像化技術に適用することができる。
要約すると、このプロトコルは、広帯域SRS顕微鏡に基づく強力な方法論を説明し、化学的に不均一な混合物から化学マップとその特徴的なSRSスペクトルを抽出し、簡単な定量的データ分析を可能にするデータセットを提供する。この方法の汎用性と単純さは、関心のある読者に、それを異なる非線形技術に適応させる可能性も与えます。
Disclosures
The authors have nothing to disclose.
Acknowledgements
D. P.は、グラント協定第101016923号に基づく欧州連合のプロジェクトCRIMSONおよびグラント契約第号に基づく地域ロンバルディアプロジェクトNEWMEDからの資金提供を認める。POR FESR 2014-2020.G. C.は、欧州連合のプロジェクトGRAPHENE Core3からの助成金契約番号881603の資金提供を認めています。G. C.はまた、キング・アブドラ科学技術大学、助成金賞番号:OSR-2016-CRG5-3017-01からの資金提供を認めています。
Materials
| Collection objective | Nikon | CFI Apo Lambda S 60x Oil, NA=1.4, Nikon | Oil immersion objective |
| Coverslips | Thermo Fisher | 043211-KJ | Quartz, cover slip for microscope slide, 25.4 x 25.4 x 0.15 mm |
| Delay line | Physik Instrumente (PI) | M-406.6PD | Precision microtranslation stage, 150 mm travel range |
| DMSO | Merck | D8418-500ML | Methylsulfinylmethane, Molecular Biology Grade DMSO, DMSO, Methyl Sulfoxide |
| Etalon | SLS Optics Ltd | Custom made | Anti reflective coating at 1,040 nm, Mounted in a 38 mm diameter x 35.5 mm long stainless steel cell with protective dust caps, and a 50 mm diameter ‘pinch-clamp’ mounting ring |
| Excitation objective | Nikon | CFI Plan Apo IR 60XC WI, NA=1.27, Nikon | Water immersion objective |
| Grating | LightSmyth | T-1850-800s Series | High Efficiency Transmission Grating T-1850-800s Series |
| Laser | Coherent | Custom made | Fidelity, HP |
| λ/2 | Thorlabs | SAHWP05M-1700 | Mounted superachromatic half-wave plate |
| PBS | Thorlabs | CM5-PBS203/M | 16 mm Cage-Cube-Mounted Polarizing Beamsplitter Cube, |
| PMMA beads | Merck | MFCD00198073 | Micro particles based on polymethacrylate |
| Prisms | Crisel | 320-8218 | LASER DISPERSING PRISMS in SF11 |
| PS beads | Merck | 72986-10ML-F | Micro particles based on polystyrene |
| YVO4 crystal | Dr. Sztatecsny GmbH | Custom made | thickness 8 mm, dia 1.00 cm, 1 689,00 689,00 suitable for 1" mount, coated for 850 – 1,100 nm |
References
- Stewart, S., Priore, R. J., Nelson, M. P., Treado, P. J. Raman Imaging. Annual Review of Analytical Chemistry. 5 (1), 337-360 (2012).
- Smekal, A. Zur quantentheorie der dispersion. Die Naturwissenschaften. 11 (43), 873-875 (1923).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Vanna, R., et al. Vibrational imaging for label-free cancer diagnosis and classification. La Rivista del Nuovo Cimento. 45, 107-187 (2021).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Hellwarth, R. W. Theory of stimulated Raman scattering. Physical Review. 130 (5), 1850-1852 (1963).
- Maker, P. D., Terhune, R. W. Study of optical effects due to an induced polarization third order in the electric field strength. Physical Review. 137 (3), 801-818 (1965).
- Bloembergen, N. The stimulated Raman effect. American Journal of Physics. 35 (11), 989-1023 (1967).
- Levenson, M. D., Flytzanis, C., Bloembergen, N. Interference of resonant and nonresonant three-wave mixing in diamond. Physical Review B. 6 (10), 3962-3965 (1972).
- Polli, D., Kumar, V., Valensise, C. M., Marangoni, M., Cerullo, G. Broadband coherent Raman scattering microscopy. Laser & Photonics Reviews. 12 (9), 1800020 (2018).
- Rigneault, H., Berto, P. Tutorial: Coherent Raman light matter interaction processes. APL Photonics. 3 (9), 091101 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-stokes raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363 (2009).
- Valensise, C. M., et al. Removing non-resonant background from CARS spectra via deep learning. APL Photonics. 5 (6), 061305 (2020).
- Cheng, J. X., Xie, X. S. . Coherent Raman scattering microscopy. , (2012).
- Slipchenko, M. N., Oglesbee, R. A., Zhang, D., Wu, W., Cheng, J. X. Heterodyne detected nonlinear optical imaging in a lock-in free manner. Journal of Biophotonics. 5 (10), 801-807 (2012).
- Blume, R. J. Boxcar” integrator with long holding times. Review of Scientific Instruments. 32 (9), 1016-1018 (1961).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Sarri, B., et al. Stimulated Raman histology: one to one comparison with standard hematoxylin and eosin staining. Biomedical Optics Express. 10 (10), 5378 (2019).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- De la Cadena, A., et al. Broadband stimulated Raman imaging based on multi-channel lock-in detection for spectral histopathology. APL Photonics. 7 (7), (2022).
- Dela Cadena, A., Valensise, C. M., Marangoni, M., Cerullo, G., Polli, D. Broadband stimulated Raman scattering microscopy with wavelength-scanning detection. Journal of Raman Spectroscopy. 51 (10), 1951-1959 (2020).
- Sciortino, G., et al. Four-channel differential lock-in amplifiers with autobalancing network for stimulated Raman spectroscopy. IEEE Journal of Solid-State Circuits. 56 (6), 1859-1870 (2021).
- Coluccelli, N., et al. Tunable 30 fs light pulses at 1 W power level from a Yb-pumped optical parametric oscillator. Optics Letters. 42 (21), 4545 (2017).
- Monmayrant, A., Weber, S., Chatel, B. A newcomer’s guide to ultrashort pulse shaping and characterization. Journal of Physics B: Atomic, Molecular and Optical Physics. 43 (10), 103001 (2010).
- Fork, R. L., Martinez, O. E., Gordon, J. P. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150 (1984).
- Crisafi, F., et al. In-line balanced detection stimulated Raman scattering microscopy. Scientific Reports. 7 (1), 10475 (2017).
- Alem, M. Noise spectral density measured with lock-in amplifiers. Zurich Instruments Company Blog. , (2021).
- Palmer, C., Loewen, E. G. . Diffraction grating handbook. , (2005).
- . Multivariate curve resolution homepage Available from: https://mcrals.wordpress.com/download/mcr-als-2-0-toolbox/ (2021)
- Tauler, R. Multivariate curve resolution applied to second order data. Chemometrics and Intelligent Laboratory Systems. 30 (1), 133-146 (1995).
- de Juan, A., Jaumot, J., Tauler, R. Multivariate Curve Resolution (MCR). Solving the mixture analysis problem. Analytical Methods. 6 (14), 4964-4976 (2014).
- Zhang, D., et al. Quantitative vibrational imaging by hyperspectral stimulated Raman scattering microscopy and multivariate curve resolution analysis. Analytical Chemistry. 85 (1), 98-106 (2013).
- Chitra Ragupathy, I., Schweikhard, V., Zumbusch, A. Multivariate analysis of hyperspectral stimulated Raman scattering microscopy images. Journal of Raman Spectroscopy. 52 (9), 1630-1642 (2021).
- Brown, S. D., Tauler, R., Walczak, B. . Comprehensive Chemometrics: Chemical and Biochemical Data Analysis. , (2020).
- Guild, J. B., Xu, C., Webb, W. W. Measurement of group delay dispersion of high numerical aperture objective lenses using two-photon excited fluorescence. Applied Optics. 36 (1), 397 (1997).
- RP Photonics Encyclopedia. Article on "Relative Intensity Noise." Available from: https://www.rp-photonics.com/relative_intensity_noise.html (2021)
- Audier, X., Heuke, S., Volz, P., Rimke, I., Rigneault, H. Noise in stimulated Raman scattering measurement: From basics to practice. APL Photonics. 5 (1), 011101 (2020).
- Xu, S., Camp, C. H., Lee, Y. J. Coherent anti-Stokes Raman scattering microscopy for polymers. Journal of Polymer Science. , (2021).
- Davydova, D., de al Cadena, A., Akimov, D., Dietzek, B. Transient absorption microscopy: advances in chemical imaging of photoinduced dynamics. Laser & Photonics Reviews. 10 (1), 62-81 (2016).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241 (2006).
- Cheng, J. X., Volkmer, A., Xie, X. S. Theoretical and experimental characterization of coherent anti-Stokes Raman scattering microscopy. Journal of the Optical Society of America B. 19 (6), 1363 (2002).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891 (2011).

