Imágenes químicas multiplex basadas en microscopía de dispersión Raman estimulada por banda ancha
Summary
Presentamos un protocolo para adquirir imágenes químicas con microscopía de dispersión Raman estimulada por banda ancha (SRS). Basado en un microscopio SRS que opera con detección diferencial de bloqueo multicanal, el protocolo describe la preparación de la muestra, el ajuste del aparato SRS y la quimiometría para desenredar diferentes constituyentes de muestras químicamente heterogéneas.
Abstract
La microscopía de dispersión Raman estimulada (SRS) es una técnica óptica no lineal para obtener imágenes químicas sin etiquetas. Esta herramienta analítica ofrece mapas químicos a alta velocidad y alta resolución espacial de muestras delgadas al interrogar directamente sus vibraciones moleculares. En su implementación estándar, la microscopía SRS es de banda estrecha y forma imágenes con una sola frecuencia vibratoria a la vez. Sin embargo, este enfoque no solo dificulta la especificidad química de SRS, sino que también descuida la riqueza de información codificada dentro de los espectros vibratorios.
Estas limitaciones pueden ser superadas por el SRS de banda ancha, una implementación capaz de extraer un espectro vibratorio por píxel de la imagen en paralelo. Esto proporciona datos hiperespectrales que, cuando se combinan con el análisis quimiométrico, maximizan la cantidad de información recuperada de la muestra. Así, el SRS de banda ancha mejora la especificidad química del sistema, permitiendo la determinación cuantitativa de la concentración de los diferentes constituyentes de una muestra. Aquí, informamos un protocolo para imágenes químicas con microscopía SRS de banda ancha, basado en un microscopio SRS construido en casa que opera con una detección de amplificador diferencial de bloqueo multicanal personalizado. Discute la preparación de la muestra, la alineación del aparato SRS y el análisis quimiométrico. Al adquirir espectros Raman vibracionales, el protocolo ilustra cómo identificar diferentes especies químicas dentro de una mezcla, determinando sus concentraciones relativas.
Introduction
La microscopía Raman es una poderosa técnica de imagen que proporciona mapas químicos ricos mediante la medición de la dispersión Raman1, un proceso radiativo inelástico que se origina a partir de moléculas que vibran en respuesta a la luz incidente 2,3. Cada píxel de un mapa Raman contiene un espectro que lleva información directa sobre la composición química y la estructura de la muestra, lo que resulta en imágenes con contraste vibratorio intrínseco. Hasta la fecha, la microscopía Raman es el punto de vista de referencia para los estudios de microespectroscopía de vibraciones moleculares, ya que ninguna otra técnica de imagen puede producir imágenes con alta especificidad química y alta resolución espacial4. A pesar de su excelente especificidad química, la eficiencia de generación de la dispersión Raman es baja, lo que requiere tiempos de permanencia de píxeles prolongados o excitación de alta potencia, lo que lleva, respectivamente, a bajas tasas de adquisición e incompatibilidad con muestras sensibles.
Esta deficiencia única de microscopía Raman llevó a los investigadores a aplicar la dispersión Raman coherente 5,6,7,8,9 como fuente de contraste para la microscopía. Este es un proceso óptico no lineal que mejora la respuesta vibratoria en varios (hasta siete) órdenes de magnitud, lo que permite imágenes químicas de alta velocidad 10,11,12,13. En particular, las dos técnicas de dispersión Raman coherentes más empleadas son la dispersión Raman anti-Stokes coherente (CARS)14 y la dispersión Raman estimulada (SRS)15. A diferencia de CARS, SRS muestra una dependencia lineal de la concentración de moléculas resonantes. Es inmune al fondo no resonante, un efecto no lineal no relacionado con ninguna transición vibratoria pero distorsionador a las formas lorentzianas características de los espectros Raman de las vibraciones moleculares16,17. Por lo tanto, la microscopía SRS produce información Raman auténtica que permite el análisis cuantitativo directo de imágenes.
SRS es un proceso óptico no lineal de tercer orden que proporciona información directa sobre los enlaces químicos de una muestra. Se origina a partir de la superposición espaciotemporal de dos campos ópticos generalmente en la región espectral del infrarrojo cercano, a saber, la bomba y los Stokes a la frecuencia ωpu y ωS, respectivamente 10,11,18. Esta superposición genera un latido en la frecuencia de la bomba-Stokes desajustando Ω = ωpu-ω S. Cuando Ω coincide con una vibración molecular ΩR, la molécula resuena, causando una transferencia de energía coherente entre los campos de luz y la molécula. Como resultado, la molécula alcanza un estado excitado vibratoriamente. Este proceso se puede monitorear midiendo la aniquilación de los fotones de la bomba (una señal conocida como pérdida de Raman estimulada [SRL]) o la amplificación concomitante de fotones de Stokes (un proceso conocido como ganancia de Raman estimulada [SRG]). SRG y SRL son señales pequeñas (ΔI) que se encuentran sobre un fondo intenso y fluctuante (I). Como los valores típicos de la señal SRS (ΔI /I) están en el rango 10-6-10-4, el ruido del láser puede oscurecerlo fácilmente. Para mitigar los efectos perjudiciales del ruido láser en la relación señal-ruido (SNR) y, en consecuencia, en la velocidad de imagen, la detección SRS se basa en técnicas de transferencia de modulación (por ejemplo, amplificadores de bloqueo, circuitos resonantes o promediadores de box-car) a altas frecuencias de modulación (>1 MHz), donde el ruido láser alcanza sus valores mínimos 15,19,20.
La microscopía SRS convencional emplea una bomba de banda estrecha (≈10 cm−1) y pulsos Stokes para producir imágenes químicas a una sola frecuencia vibratoria, lo que permite imágenes de velocidad de video con tiempos de permanencia de píxeles tan bajos como ≈100 ns21,22. Sin embargo, debido a que la microscopía SRS de banda estrecha forma mapas químicos escaneando secuencialmente la muestra a solo unas pocas frecuencias vibratorias, su información es limitada23. Las imágenes SRS con uno o dos contrastes vibratorios pueden no ser suficientes para diferenciar especies químicas con bandas Raman superpuestas, especialmente dentro de sistemas heterogéneos. Por lo tanto, el microscopio SRS paradigmático de banda estrecha no explota todo el potencial de SRS, porque la investigación de un puñado de frecuencias vibratorias dificulta su especificidad química y descuida la riqueza de información codificada dentro de los espectros vibratorios. Además, el escaneo secuencial de la muestra a diferentes frecuencias da como resultado tiempos de permanencia de píxeles prolongados que pueden desencadenar el fotodaño y evitar la corregistración espacial rigurosa entre imágenes consecutivas, lo que lleva a artefactos de movimiento.
Contrariamente a su contraparte de banda estrecha, la microscopía SRS de banda ancha recupera un espectro vibratorio por píxel en cada escaneo de muestra 10,12,24. Por lo tanto, el SRS de banda ancha proporciona imágenes hiperespectrales con una estricta corregistración espacial de diferentes contrastes vibratorios, lo que permite un análisis riguroso de los datos. Esto no solo revela los componentes químicos del espécimen a través de espectros Raman, sino que también ayuda a determinar sus concentraciones relativas. Dependiendo de cómo se adquieran los espectros, la microscopía SRS de banda ancha se clasifica como SRS hiperespectral o SRS multiplex. En srsis hiperespectral, el espectro SRS por punto escaneado de la muestra se adquiere secuencialmente (es decir, se recupera barriendo la Ω de desajuste de frecuencia), construyendo un espectro SRS apilando las señales SRS en turnos Raman consecutivos. El espectro Raman se mide simultáneamente en varios modos vibratorios en SRS multiplex. Por lo tanto, el enfoque SRS multiplex combina un pulso de banda estrecha modulado con un pulso de banda ancha para impulsar la señal SRS a diferentes frecuencias, y utiliza un detector multicanal con una sensibilidad comparable a la de SRS de banda estrecha para detectar los espectros SRS.
Este artículo presenta un protocolo para producir mapas químicos de muestras heterogéneas utilizando microscopía SRS multiplex. Un esquema del microscopio SRS empleado en este protocolo se representa en la Figura 1 y se describe en detalle en otra parte 25,26,27. Brevemente, un láser de fibra Yb bloqueado en modo comercial, que produce pulsos de 140 fs centrados a 1040 nm, con una potencia promedio de 10 W y una tasa de repetición de 80 MHz, impulsa el microscopio SRS de banda ancha. Un divisor de haz polarizador (PBS) separa el haz fundamental en dos ramas. Para producir los pulsos Stokes de banda estrecha, una rama con 4 W del haz fundamental se envía a un etalón que genera un haz de banda estrecha (≈15 cm-1), que luego se modula a 1,6 MHz con un modulador óptico acústico (AOM). La fracción restante con 6 W del haz fundamental se duplica en frecuencia con un cristal de triborato de litio (LBO) de 2,8 mm de espesor, cortado para la coincidencia de fase de tipo I (θ = 90 °, φ = 13,8 °). La segunda generación armónica resultante a 520 nm viaja a una cavidad plegada en X para bombear un oscilador paramétrico óptico (OPO), un dispositivo que utiliza un cristal LBO de 3,0 mm de espesor (coincidencia de fase tipo I, θ = 90 °, φ = 9,8 °) como medio activo para entregar una radiación óptica de banda ancha sintonizable dentro de la región espectral de 680-910 nm (Figura 2). Estos pulsos de banda ancha sirven como bomba en los experimentos SRS y se propagan a un compresor de prisma para precompensar los efectos de dispersión inducidos por el objetivo del microscopio.
Después de la etapa de compresión, una placa de onda λ/2, combinada con una placa birrefringente YVO4 , produce dos réplicas polarizadas ortogonalmente cuya sustracción electrónica en el plano de detección cancela el ruido de la bomba de banda ancha. Un espejo dicroico combina la bomba y los haces stokes y los envía a un microscopio vertical. Un objetivo de inmersión en agua con una apertura numérica (NA) de 1,27 enfoca la luz en la muestra, mientras que un objetivo de inmersión en aceite con un NA de 1,4 la recoge. Antes de la etapa de detección, un filtro de paso corto (SPF) elimina los Stokes modulados, mientras que una rejilla de difracción que funciona en configuración Littrow dispersa la bomba de banda ancha transmitida. Un segundo PBS2 separa las réplicas de la bomba y una lente las enfoca en dos matrices de fotodiodos. Las señales de estas matrices de fotodiodos se restan electrónicamente y se envían a un amplificador de bloqueo multicanal (M-LIA) construido en casa. La señal demodulada se normaliza mediante las lecturas de corriente continua (CC) de una de las matrices de fotodiodos, produciendo así el espectro SRL.
Como experimento ejemplar, obtenemos imágenes de mezclas de varios dispersores Raman conocidos, cada uno con un espectro Raman único. Por lo tanto, el protocolo comienza describiendo cómo preparar las muestras de referencia. A medida que detectamos SRL, continuamos explicando cómo obtener pulsos Stokes de banda estrecha y configurar la fuente óptica que entrega los pulsos de bomba de banda ancha (≈250 cm-1), es decir, el OPO casero. El protocolo muestra la alineación y optimización de los haces ópticos, describiendo parámetros críticos como la potencia y los espectros de la banda estrecha Stokes y la bomba de banda ancha. El protocolo describe en detalle la ruta óptica de la bomba de banda ancha porque requiere elementos ópticos especiales. También explica cómo encontrar la superposición espaciotemporal entre los pulsos de bomba-Stokes y muestra una forma práctica de determinar el ruido de intensidad relativa (RIN), que a su vez ayuda a definir la mejor frecuencia de modulación para los experimentos de SRS. A continuación, explicamos el principio de funcionamiento y la calibración de la cadena de detección. Finalmente, el protocolo muestra el proceso de adquisición de datos, la quimiometría y la canalización de procesamiento de imágenes.
Protocol
Representative Results
Discussion
La microscopía SRS de banda ancha es una poderosa técnica de imagen que ofrece un auténtico contraste químico para identificar y desenredar los componentes químicos de una muestra heterogénea. El potencial de esta herramienta analítica puede ser beneficioso para varios campos de investigación, que van desde la ciencia de los materiales hasta la histopatología. La desventaja de la microscopía SRS de banda ancha es el hecho de que es técnicamente exigente; el experimentalista no solo requiere conocimientos sobre fuentes láser de banda ancha, sino que también necesita manipular los pulsos láser para generar SRS de manera eficiente, una señal que, a su vez, debe medirse con sofisticados esquemas de detección. Este documento presenta un protocolo que describe un flujo de trabajo para producir mapas químicos de compuestos químicos mixtos utilizando un microscopio SRS de banda ancha multiplex. Aunque el trabajo descrito puede ser trivial para algunos físicos láser y microscopistas no lineales, puede que no sea el caso para los lectores interesados en los beneficios de la microscopía SRS de banda ancha cuyo conocimiento científico reside fuera de estos dominios. Por lo tanto, nuestro objetivo fue detallar cada paso para guiar a la amplia audiencia interesada en la microscopía SRS de banda ancha.
El protocolo en cuestión comenzó mostrando cómo preparar una muestra simple pero espectroscópicamente rica compuesta de varios dispersores Raman fuertes y conocidos. Discutimos cómo obtener la bomba de banda ancha y los haces Stokes de banda estrecha necesarios para configurar un microscopio SRS. La Figura 5C muestra un esquema de las configuraciones SHG y OPO. Tenga en cuenta que la lente f1 enfoca el haz fundamental en LBO1 para generar el SHG, mientras que un espejo dicroico refleja la radiación SHG y transmite el haz fundamental residual. Una segunda lente f2 colima el haz SHG. Como f2 > f1, el haz SHG se expande por un factor igual a f2/f1. Una tercera lente f3 enfoca el haz SHG expandido en un segundo cristal LBO Tipo I (LBO2) cortado a θ = 90° y φ = 29.0°. Al bombear LBO2 con el mencionado SGH (520 nm), la radiación dentro del rango de 680-910 nm surgirá de LBO2 a través de la generación de diferencia de frecuencia (DFG), produciendo dos haces: la señal y el ralentí27 (Figura 5D, E). Este último se descarta, mientras que el primero se amplifica en la cavidad OPO para entregar los pulsos de bomba empleados en los experimentos SRS. La bomba del OPO a 520 nm, es decir, el haz SHG, no debe confundirse con la bomba de los experimentos SRS (es decir, el haz de señal del OPO).
El contraste en la microscopía SRS se origina a partir de una señal no lineal generada en el punto focal del microscopio, una señal que exige confinar un gran número de fotones en el plano de la muestra en un momento dado. Este confinamiento de fotones se logra con un objetivo de microscopio de alta apertura numérica (NA), una matriz de lentes que también establece la resolución espacial del sistema: cuanto mayor es el NA, mayor es la resolución espacial. Sin embargo, los objetivos de NA altos están densamente llenos de vidrio, que introduce GDD positivo a la radiación pulsada, un chirrido de frecuencia que finalmente amplía el perfil temporal de los pulsos39. Por lo tanto, el GDD introducido por el objetivo del microscopio podría aumentar la duración de los pulsos de la bomba de banda ancha, haciéndolo aún más largo que la envolvente temporal de Stokes y reduciendo el ancho de banda efectivo y accesible de la señal Raman. Además, esta ampliación también podría introducir una distorsión del perfil espectral del espectro SRS medido.
En CARS, la señal espectroscópicamente relevante emerge en longitudes de onda que difieren de las de los campos de excitación. Se puede utilizar un simple tubo fotomultiplicador o una cámara de dispositivo de carga acoplada (CCD) para integrar la señal CARS en el tiempo, resumiendo miles de pulsos para promediar el ruido del láser. En cambio, la señal SRS aparece como una débil transferencia de modulación incrustada dentro de un fondo láser fuerte y fluctuante. Debido a que esta modulación es débil, el ruido del láser puede abrumarlo fácilmente, reduciendo tanto la velocidad de imagen como la sensibilidad del microscopio SRS. Por lo tanto, antes de obtener imágenes, es imperativo medir el ruido de intensidad relativa (RIN) para determinar si el láser es adecuado para imágenes SRS de alta velocidad y seleccionar la frecuencia de modulación con el ruido más bajo. El RIN se define como la densidad espectral de potencia de ruido [δP(f), con unidades W2/Hz] del láser normalizada por la potencia óptica media (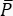 )40,41. En otras palabras, el RIN describe las fluctuaciones normalizadas del láser a diferentes frecuencias (Eq [4]).
)40,41. En otras palabras, el RIN describe las fluctuaciones normalizadas del láser a diferentes frecuencias (Eq [4]).
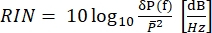 (4)
(4)
Por lo tanto, el RIN es un parámetro del sistema SRS que determina el rango de frecuencia de modulación ideal para los experimentos. Por ejemplo, la barra de olivo en la Figura 8 muestra el rango de frecuencia de modulación ideal para imágenes SRS. En el caso de SRS de banda estrecha, el usuario debe medir el RIN tanto de la bomba como de Stokes para elegir qué haz necesita ser modulado para lograr un rendimiento óptimo. Tenga en cuenta de la Figura 8, por ejemplo, que el haz de Stokes tiene un RIN ligeramente más alto que la bomba, lo que implica que las mediciones de SRG resultarían más ruidosas que sus contrapartes SRL. En el caso del SRS de banda ancha, el haz que debe modularse es el haz de banda estrecha.
La dispersión angular D de la rejilla expresa el ángulo de difracción en función de la longitud de onda, y se define como la derivada de la ecuación de rejilla. Para la configuración littrow, la dispersión angular viene dada por Eq (5).
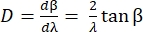 (5)
(5)
Para obtener Eq (5), asumimos α = β, resolvimos Eq (2) para m/d e insertamos el resultado en dβ/ dλ. Nótese que en la configuración de Littrow, β = sin-1(mλ/2d). Dentro de la aproximación de ángulo pequeño, el cambio de posición a lo largo del espectro es fdβ ≈ dl (Figura 10). Así, insertando dβ en Eq (5), podemos calcular la dispersión lineal, una cantidad con unidades de nm mm-1 usando Eq (6):
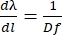 (6)
(6)
Para una rejilla de difracción que funciona en la configuración Littrow con 1.851,85 ranuras/mm, d = 540 nm. Si usamos la difracción de primer orden de la luz a ~789 nm, D = 0.0027 rad nm-1. Con una lente f = 750 mm, obtenemos una dispersión lineal de ≈ 0,5 nm mm-1, lo que se traduce en ≈ 7,8 cm-1 mm-1. Así, la distancia focal de la lente determina la “densidad” de nm por mm en el plano del detector: cuanto mayor es la distancia focal, menos nm por mm se obtiene, aumentando el espacio entre las líneas espectrales de la bomba de banda ancha. Por el contrario, con distancias focales más cortas, habrá más nm por mm en el plano del detector, reduciendo el espacio ocupado por la bomba dispersa.
La detección equilibrada mejora la calidad de imagen y la sensibilidad de las configuraciones ruidosas. Por ejemplo, de acuerdo con los espectros RIN que se muestran en la Figura 8 y considerando el SRS típico con una amplitud de 1 x 10-5, la relación señal-ruido (SNR) desequilibrada es de ≈60. Utilizando la detección equilibrada (es decir, cerca del ruido del disparo), es posible alcanzar un SNR de ≈145. La Figura 11 muestra espectros e imágenes compuestas en condiciones equilibradas y desequilibradas. Naturalmente, los efectos de la detección equilibrada afectan los resultados finales de los experimentos, es decir, los mapas químicos. Con el apoyo de estos resultados, enfatizamos que la detección equilibrada es una técnica poderosa para contrarrestar los efectos perjudiciales de las fluctuaciones del láser en la calidad de la imagen. Vale la pena mencionar que la detección equilibrada es más adecuada para láseres ruidosos, como los osciladores de fibra. Los microscopios SRS que funcionan con fuentes de luz óptica silenciosas (por ejemplo, láseres de estado sólido) pueden no requerir una detección equilibrada.
El protocolo también explica un enfoque basado en la óptica no lineal para encontrar la superposición espaciotemporal entre los pulsos de estos haces. Describimos las ventajas de usar el1º en lugar del0º orden de difracción de una OMA como el haz de Stokes modulado. Además, los efectos perjudiciales de la dispersión en la eficiencia de generación de SRS se describieron con sugerencias de formas de mitigarlos a través de un compresor prisma. Además, el protocolo explica cómo alinear los prismas y destaca tres aspectos críticos a considerar para un rendimiento óptimo. No solo discutimos la relevancia del RIN para la microscopía SRS, sino que también mostramos cómo medirlo con un amplificador de bloqueo y, con el espectro RIN, definir la mejor frecuencia de modulación. Con un ejemplo concreto, este documento explica cómo la ecuación de rejilla ayuda a diseñar la cadena de detección. Finalmente, el protocolo ilustra, con datos reales de SRS, la estructura del hipercubo SRS y cómo analizarlo con un lenguaje de programación científico utilizado convencionalmente.
Este protocolo tiene tres limitaciones menores. En primer lugar, el esquema de detección empleado en esta contribución consiste en un detector de bloqueo multicanal no convencional diseñado y construido internamente por Sciortino et al.26 Como se demostró anteriormente25, este detector puede ser reemplazado por un fotodiodo equilibrado listo para usar. Aunque esta modificación afecta solo al detector y deja el protocolo prácticamente sin cambios, con un solo fotodiodo, es necesario escanear cada componente espectral en el detector en lugar de medirlos todos a la vez. En segundo lugar, este protocolo emplea la detección equilibrada en línea, que requiere insertar varios elementos ópticos en la trayectoria del haz. Estos elementos ópticos aumentan la complejidad del sistema y conducen a pérdidas de potencia óptica y ampliación de pulsos.
La detección equilibrada en línea también exige que las dos réplicas de la bomba pasen a través de la muestra, una situación que puede no ser ideal para muestras sensibles a la luz, como las células vivas, o para las fuertemente birrefringentes en las que las dos réplicas de la bomba pueden experimentar diferentes propiedades ópticas, cancelando así la detección equilibrada. En tercer lugar, el protocolo se basa en un OPO construido en casa, un dispositivo que puede no estar fácilmente disponible. Sin embargo, las alternativas a los espectros de banda ancha entregados por el OPO son la supercontinua de fibras ópticas no lineales o cristales a granel. Este último podría emplearse solo con láseres de baja tasa de repetición (hasta 5 MHz). Por lo tanto, como con todo diseño experimental, el protocolo en cuestión tiene algunas limitaciones. Sin embargo, son mínimos y no comprometen el éxito de este enfoque.
Aunque aquí se describe una muestra de referencia, este protocolo puede desenredar con éxito especies químicas dentro de células y tejidos animales y vegetales, como celulosa, especies lipídicas o proteínas, encontrando aplicaciones prácticas en diferentes búsquedas bioquímicas o como herramienta de diagnóstico en histopatología. Del mismo modo, este protocolo puede ser una herramienta valiosa en las ciencias de los materiales. Por ejemplo, siguiendo este protocolo, se puede interrogar la composición molecular y la concentración de especies poliméricas42. Además, esta metodología es compatible con otras técnicas de microscopía no lineal, como la microscopía de banda ancha basada en bomba-sonda43 y la heterodina CARS44, procesos de mezcla de cuatro ondas que, al igual que con SRS, también requieren dos haces de luz de excitación y mediciones de modulación-transferencia. Finalmente, parte de la información contenida en este trabajo se puede aplicar a técnicas de imagen no lineal que no se basan en técnicas de transferencia de modulación, sino que requieren alinear dos o más rayos láser pulsados, como las microscopías convencionales CARS45 y SFG46.
En resumen, este protocolo describe una potente metodología basada en la microscopía SRS de banda ancha para extraer mapas químicos y sus espectros SRS característicos de mezclas químicamente heterogéneas, entregando conjuntos de datos que permiten un análisis de datos cuantitativo directo. La versatilidad y simplicidad del método también dan al lector interesado la posibilidad de adaptarlo a diferentes técnicas no lineales.
Disclosures
The authors have nothing to disclose.
Acknowledgements
D. P. reconoce la financiación del proyecto de la Unión Europea CRIMSON en virtud del Acuerdo de Subvención Nº 101016923 y del proyecto NEWMED de la Región de Lombardía en virtud del Acuerdo de Subvención No. POR FESR 2014-2020. G. C. reconoce la financiación del proyecto de la Unión Europea GRAPHENE Core3 en virtud del acuerdo de subvención número 881603. G. C. también reconoce la financiación de la Universidad de Ciencia y Tecnología Rey Abdullah, número de concesión de subvención: OSR-2016-CRG5-3017-01.
Materials
| Collection objective | Nikon | CFI Apo Lambda S 60x Oil, NA=1.4, Nikon | Oil immersion objective |
| Coverslips | Thermo Fisher | 043211-KJ | Quartz, cover slip for microscope slide, 25.4 x 25.4 x 0.15 mm |
| Delay line | Physik Instrumente (PI) | M-406.6PD | Precision microtranslation stage, 150 mm travel range |
| DMSO | Merck | D8418-500ML | Methylsulfinylmethane, Molecular Biology Grade DMSO, DMSO, Methyl Sulfoxide |
| Etalon | SLS Optics Ltd | Custom made | Anti reflective coating at 1,040 nm, Mounted in a 38 mm diameter x 35.5 mm long stainless steel cell with protective dust caps, and a 50 mm diameter ‘pinch-clamp’ mounting ring |
| Excitation objective | Nikon | CFI Plan Apo IR 60XC WI, NA=1.27, Nikon | Water immersion objective |
| Grating | LightSmyth | T-1850-800s Series | High Efficiency Transmission Grating T-1850-800s Series |
| Laser | Coherent | Custom made | Fidelity, HP |
| λ/2 | Thorlabs | SAHWP05M-1700 | Mounted superachromatic half-wave plate |
| PBS | Thorlabs | CM5-PBS203/M | 16 mm Cage-Cube-Mounted Polarizing Beamsplitter Cube, |
| PMMA beads | Merck | MFCD00198073 | Micro particles based on polymethacrylate |
| Prisms | Crisel | 320-8218 | LASER DISPERSING PRISMS in SF11 |
| PS beads | Merck | 72986-10ML-F | Micro particles based on polystyrene |
| YVO4 crystal | Dr. Sztatecsny GmbH | Custom made | thickness 8 mm, dia 1.00 cm, 1 689,00 689,00 suitable for 1" mount, coated for 850 – 1,100 nm |
References
- Stewart, S., Priore, R. J., Nelson, M. P., Treado, P. J. Raman Imaging. Annual Review of Analytical Chemistry. 5 (1), 337-360 (2012).
- Smekal, A. Zur quantentheorie der dispersion. Die Naturwissenschaften. 11 (43), 873-875 (1923).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Vanna, R., et al. Vibrational imaging for label-free cancer diagnosis and classification. La Rivista del Nuovo Cimento. 45, 107-187 (2021).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Hellwarth, R. W. Theory of stimulated Raman scattering. Physical Review. 130 (5), 1850-1852 (1963).
- Maker, P. D., Terhune, R. W. Study of optical effects due to an induced polarization third order in the electric field strength. Physical Review. 137 (3), 801-818 (1965).
- Bloembergen, N. The stimulated Raman effect. American Journal of Physics. 35 (11), 989-1023 (1967).
- Levenson, M. D., Flytzanis, C., Bloembergen, N. Interference of resonant and nonresonant three-wave mixing in diamond. Physical Review B. 6 (10), 3962-3965 (1972).
- Polli, D., Kumar, V., Valensise, C. M., Marangoni, M., Cerullo, G. Broadband coherent Raman scattering microscopy. Laser & Photonics Reviews. 12 (9), 1800020 (2018).
- Rigneault, H., Berto, P. Tutorial: Coherent Raman light matter interaction processes. APL Photonics. 3 (9), 091101 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-stokes raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363 (2009).
- Valensise, C. M., et al. Removing non-resonant background from CARS spectra via deep learning. APL Photonics. 5 (6), 061305 (2020).
- Cheng, J. X., Xie, X. S. . Coherent Raman scattering microscopy. , (2012).
- Slipchenko, M. N., Oglesbee, R. A., Zhang, D., Wu, W., Cheng, J. X. Heterodyne detected nonlinear optical imaging in a lock-in free manner. Journal of Biophotonics. 5 (10), 801-807 (2012).
- Blume, R. J. Boxcar” integrator with long holding times. Review of Scientific Instruments. 32 (9), 1016-1018 (1961).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Sarri, B., et al. Stimulated Raman histology: one to one comparison with standard hematoxylin and eosin staining. Biomedical Optics Express. 10 (10), 5378 (2019).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- De la Cadena, A., et al. Broadband stimulated Raman imaging based on multi-channel lock-in detection for spectral histopathology. APL Photonics. 7 (7), (2022).
- Dela Cadena, A., Valensise, C. M., Marangoni, M., Cerullo, G., Polli, D. Broadband stimulated Raman scattering microscopy with wavelength-scanning detection. Journal of Raman Spectroscopy. 51 (10), 1951-1959 (2020).
- Sciortino, G., et al. Four-channel differential lock-in amplifiers with autobalancing network for stimulated Raman spectroscopy. IEEE Journal of Solid-State Circuits. 56 (6), 1859-1870 (2021).
- Coluccelli, N., et al. Tunable 30 fs light pulses at 1 W power level from a Yb-pumped optical parametric oscillator. Optics Letters. 42 (21), 4545 (2017).
- Monmayrant, A., Weber, S., Chatel, B. A newcomer’s guide to ultrashort pulse shaping and characterization. Journal of Physics B: Atomic, Molecular and Optical Physics. 43 (10), 103001 (2010).
- Fork, R. L., Martinez, O. E., Gordon, J. P. Negative dispersion using pairs of prisms. Optics Letters. 9 (5), 150 (1984).
- Crisafi, F., et al. In-line balanced detection stimulated Raman scattering microscopy. Scientific Reports. 7 (1), 10475 (2017).
- Alem, M. Noise spectral density measured with lock-in amplifiers. Zurich Instruments Company Blog. , (2021).
- Palmer, C., Loewen, E. G. . Diffraction grating handbook. , (2005).
- . Multivariate curve resolution homepage Available from: https://mcrals.wordpress.com/download/mcr-als-2-0-toolbox/ (2021)
- Tauler, R. Multivariate curve resolution applied to second order data. Chemometrics and Intelligent Laboratory Systems. 30 (1), 133-146 (1995).
- de Juan, A., Jaumot, J., Tauler, R. Multivariate Curve Resolution (MCR). Solving the mixture analysis problem. Analytical Methods. 6 (14), 4964-4976 (2014).
- Zhang, D., et al. Quantitative vibrational imaging by hyperspectral stimulated Raman scattering microscopy and multivariate curve resolution analysis. Analytical Chemistry. 85 (1), 98-106 (2013).
- Chitra Ragupathy, I., Schweikhard, V., Zumbusch, A. Multivariate analysis of hyperspectral stimulated Raman scattering microscopy images. Journal of Raman Spectroscopy. 52 (9), 1630-1642 (2021).
- Brown, S. D., Tauler, R., Walczak, B. . Comprehensive Chemometrics: Chemical and Biochemical Data Analysis. , (2020).
- Guild, J. B., Xu, C., Webb, W. W. Measurement of group delay dispersion of high numerical aperture objective lenses using two-photon excited fluorescence. Applied Optics. 36 (1), 397 (1997).
- RP Photonics Encyclopedia. Article on "Relative Intensity Noise." Available from: https://www.rp-photonics.com/relative_intensity_noise.html (2021)
- Audier, X., Heuke, S., Volz, P., Rimke, I., Rigneault, H. Noise in stimulated Raman scattering measurement: From basics to practice. APL Photonics. 5 (1), 011101 (2020).
- Xu, S., Camp, C. H., Lee, Y. J. Coherent anti-Stokes Raman scattering microscopy for polymers. Journal of Polymer Science. , (2021).
- Davydova, D., de al Cadena, A., Akimov, D., Dietzek, B. Transient absorption microscopy: advances in chemical imaging of photoinduced dynamics. Laser & Photonics Reviews. 10 (1), 62-81 (2016).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241 (2006).
- Cheng, J. X., Volkmer, A., Xie, X. S. Theoretical and experimental characterization of coherent anti-Stokes Raman scattering microscopy. Journal of the Optical Society of America B. 19 (6), 1363 (2002).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891 (2011).

