Vezeltype en subcellulair-specifieke analyse van lipidedruppelgehalte in skeletspieren
Summary
Toenemend bewijs geeft aan dat overmatige infiltratie van lipiden in de skeletspieren resulteert in lipotoxiciteit en diabetes. Hier presenteren we een compleet protocol, inclusief weefselverwerking, kleuring met Bodipy, beeldacquisitie en analyse, om de grootte, dichtheid en subcellulaire verdeling van lipidedruppels op een vezeltypespecifieke manier te kwantificeren.
Abstract
Skeletspier lipide-infiltratie, bekend als myosteatose, neemt toe met obesitas en veroudering. Myosteatose is onlangs ook ontdekt als een negatieve prognostische factor voor verschillende andere aandoeningen zoals hart- en vaatziekten en kanker. Overmatige lipide-infiltratie vermindert de spiermassa en kracht. Het resulteert ook in lipotoxiciteit en insulineresistentie, afhankelijk van het totale intramyocellulaire lipidengehalte, lipidedruppel (LD) morfologie en subcellulaire distributie. Vezeltype (oxidatieve versus glycolytische) is ook belangrijk, omdat oxidatieve vezels een grotere capaciteit hebben om lipiden te gebruiken. Vanwege hun cruciale implicaties in de pathofysiologie zijn diepgaande studies over LD-dynamica en -functie op een vezeltypespecifieke manier gerechtvaardigd.
Hierin wordt een compleet protocol gepresenteerd voor de kwantificering van het intramyocellulaire lipidengehalte en de analyse van LD-morfologie en subcellulaire distributie op een vezeltypespecifieke manier. Hiertoe werden seriële spier cryosecties gekleurd met de fluorescerende kleurstof Bodipy en antilichamen tegen myosine zware keten isovormen. Dit protocol maakt de gelijktijdige verwerking van verschillende spieren mogelijk, bespaart tijd en vermijdt mogelijke artefacten en dankzij een gepersonaliseerde macro die in Fiji is gemaakt, is de automatisering van LD-analyse ook mogelijk.
Introduction
Skeletspier lipide-infiltratie, bekend als myosteatose, neemt toe met obesitas en veroudering. Myosteatose is negatief gecorreleerd met spiermassa en kracht en met insulinegevoeligheid1. Bovendien geven recente studies aan dat de mate van myosteatose kan worden gebruikt als een prognostische factor voor andere aandoeningen zoals hart- en vaatziekten2, niet-alcoholische leververvetting3 of kanker4. Lipiden kunnen zich ophopen in skeletspieren tussen spiervezels als extramyocellulaire lipiden of in de vezels, als intramyocellulaire lipiden (IMCLs). IMCLs worden voornamelijk opgeslagen als triglyceriden in lipidedruppels (LD’s) die worden gebruikt als metabole brandstof tijdens lichaamsbeweging 5,6. Wanneer het lipidenaanbod echter de vraag overtreft, of wanneer mitochondriën disfunctioneel worden, zullen IMCLs betrokken zijn bij spierinsulineresistentie, zoals gezien bij metabolisch ongezonde, zwaarlijvige personen en bij type 2 diabetespatiënten7. Intrigerend genoeg hebben duursporters vergelijkbare, zo niet hogere, niveaus van IMCLs als die gevonden bij zwaarlijvige patiënten met type 2 diabetes mellitus, met behoud van een hoge insulinegevoeligheid. Dit fenomeen wordt beschreven als de “atleetparadox”8,9 en wordt verklaard door een meer genuanceerde beoordeling van spier-LD’s, gerelateerd aan hun grootte, dichtheid, lokalisatie, dynamiek en samenstelling van lipidesoorten.
Ten eerste is de LD-grootte omgekeerd gecorreleerd aan insulinegevoeligheid en fysieke fitheid10,11. In feite vertonen kleinere LD’s een relatief groter oppervlak voor lipasewerking en hebben ze dus mogelijk een groter vermogen om lipiden te mobiliseren12. Ten tweede speelt LD-dichtheid (getal/oppervlak) een controversiële rol bij insulinewerking 8,10; toch lijkt het bij sporters toe te nemen. Ten derde is de subcellulaire lokalisatie van LD’s belangrijk, omdat LD’s net onder het oppervlaktemembraan (subsarcolemmaal of perifeer) een schadelijker effect uitoefenen op de insulinegevoeligheid dan centrale 8,9,13. Deze laatste leveren brandstof aan centrale mitochondriën, die een grotere ademhalingsactiviteit hebben en meer gespecialiseerd zijn om te voldoen aan de hoge energievraag die nodig is voor contractie14. Perifere LD’s leveren daarentegen subsarcolemmale mitochondriën, die betrokken zijn bij membraangerelateerde processen8. Ten slotte kunnen, naast triglyceriden, specifieke complexe lipiden in de spier schadelijker zijn dan andere. Diacylglycerol, lange-keten acyl-CoA en ceramiden kunnen zich bijvoorbeeld ophopen in spieren wanneer de triglyceridenomloopsnelheid laag is, waardoor insuline wordt aangetast die 9,15 signaleert. Terugkerend naar de “paradox van de atleet”, hebben duursporters een groot aantal kleinere centrale LD’s met verhoogde omloopsnelheden in type I (oxidatieve) vezels, terwijl zwaarlijvige en diabetische patiënten grotere perifere LD’s hebben met lage omloopsnelheden in type II (glycolytische) vezels 8,15,16. Naast hun rol in energieopslag en -afgifte, kunnen LDs via afgeleide vetzuren (FA) en een vachteiwit (perilipin 5) ook functioneren als kritische spelers die betrokken zijn bij de transcriptionele regulatie van FA-oxidatie en mitochondriale biogenese8. Vanwege hun cruciale implicaties in de fysiologie en pathofysiologie, zijn diepgaande studies over de dynamiek en functies van LDs gerechtvaardigd.
Hoewel er verschillende technieken zijn om IMCLs te bestuderen, zijn ze niet allemaal geschikt om de LD-grootte, -dichtheid en -distributie op een vezelspecifieke manier nauwkeurig te kwantificeren. Bijvoorbeeld, de beoordeling van IMCLs door magnetische resonantiespectroscopie, hoewel niet-invasief, biedt een resolutieniveau dat niet voldoende is om de grootte en precieze locatie van LDs in de vezel te bestuderen, en het is niet vezeltypespecifiek17,18. Evenzo kunnen biochemische technieken uitgevoerd op homogene homogenen van de hele spieren19 de locatie en grootte van lipiden niet beoordelen. Bijgevolg is de meest geschikte methode om LD-morfologie en locatie te analyseren kwantitatieve transmissie-elektronische microscopie13, maar deze techniek is duur en tijdrovend. Daarom is confocale fluorescentiebeeldvorming op preparaten met kleurstoffen zoals Oil Red O (ORO)20,21, monodansylpentane (MDH)22 of Bodipy 23,24,25 naar voren gekomen als het beste hulpmiddel voor deze studies.
Hier wordt een compleet protocol beschreven, inclusief weefselbemonstering en -verwerking, Bodipy-kleuring en confocale beeldacquisitie en -analyse om de LD-grootte, het aantal en de lokalisatie in cryosecties van muizenspieren te kwantificeren. Aangezien IMCLs niet gelijkmatig verdeeld zijn over oxidatieve en glycolytische vezels, en elk vezeltype de LD-dynamiek anders reguleert, moet de studie van IMCLs vezeltypespecifiekzijn 16,25,26,27. Daarom gebruikt dit protocol immunofluorescentie op seriële secties om myosine zware keten (MyHC) isovorm (en) uitgedrukt door elke vezel te identificeren. Een ander voordeel van dit protocol is de gelijktijdige verwerking van een glycolytische (extensor digitorum longus, EDL) en een oxidatieve (soleus) spier die naast elkaar worden geplaatst voor het bevriezen (figuur 1). Deze gelijktijdige verwerking bespaart niet alleen tijd, maar voorkomt ook variabiliteit door afzonderlijke verwerking van de monsters.
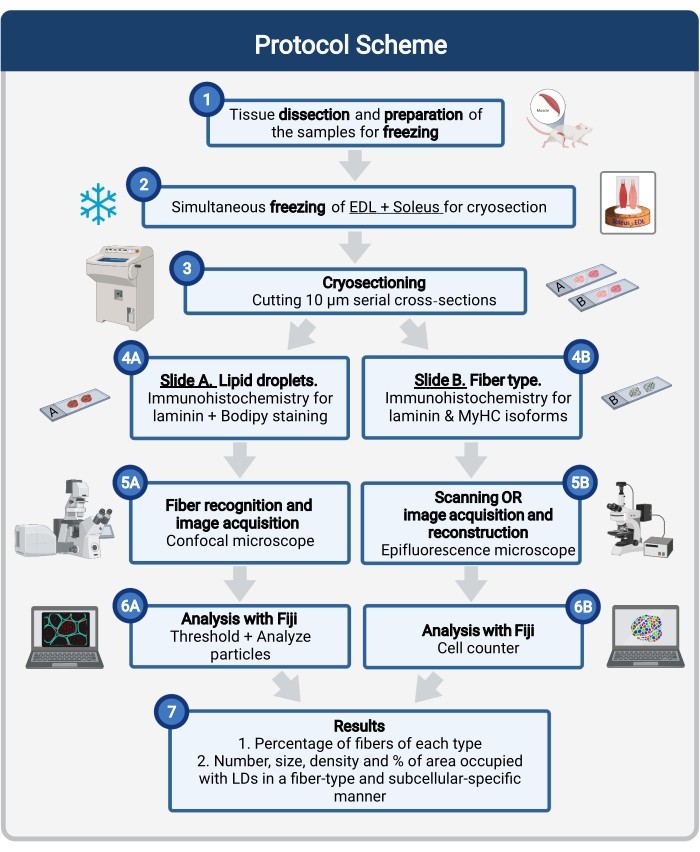
Figuur 1: Schematisch overzicht van de procedure. Na spierdissectie (1) worden geselecteerde spieren van vergelijkbare grootte voorbereid en samen ingevroren (2). Seriële dwarsdoorsneden van 10 μm worden verkregen met behulp van een cryostaat en direct gemonteerd op adhesieglaasjes (3). Van twee seriële dia’s is de eerste (4A) immunoactief gelabeld voor laminine en gekleurd met Bodipy om LDs te herkennen en de tweede (4B) is immunostained met antilichamen tegen MyHC’s voor de herkenning van spiervezeltypen. Beelden worden verkregen met behulp van een confocale microscoop voor Bodipy (5A) en een epifluorescentiemicroscoop voor spiervezeltypen (5B). Afbeeldingen worden in Fiji geanalyseerd door een drempel toe te passen en deeltjes (6A) te kwantificeren om het aantal, de gemiddelde grootte, de dichtheid en het percentage van het totale gebied bezet door LDs (7) of telcellen (6B) te verkrijgen om het percentage vezels van elk type in de sectie (7) te verkrijgen. Afkortingen: LDs = lipidedruppels; EDL = extensor digitorum longus; MyHC’s = myosine zware keten isovormen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het protocol dat hier wordt beschreven, beschrijft een efficiënte methode om LD’s te kwantificeren die zijn getagd met Bodipy op een vezeltype- en subcellulair-specifieke basis. In de afgelopen jaren zijn klassieke lipidekleurstoffen, zoals ORO of Sudan Black B, vervangen door een nieuwe reeks celdoorlatende, lipofiele, fluorescerende kleurstoffen die binden aan neutrale lipiden (bijv. Bodipy). Bodipy is verkrijgbaar als verschillende conjugaten en is zeer effectief gebleken in het taggen van LD’s om hun morfologie, dyn…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door subsidies van het Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) en de Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. is de ontvanger van een Ph.D. fellowship van de FRIA (FNRS). M.A.D.-L.d.C. ontving een fellowship van het Wallonie-Bruxelles International Excellence Program.
De auteurs bedanken Alice Monnier voor haar bijdrage aan de ontwikkeling van dit protocol en Caroline Bouzin voor haar expertise en technische hulp bij het beeldverwervingsproces. We danken ook het 2IP-IREC beeldvormingsplatform voor de toegang tot de cryostaat en de microscopen (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Brussel, België). Tot slot willen de auteurs Nicolas Dubuisson, Romain Versele en Michel Abou-Samra bedanken voor de opbouwende kritiek op het manuscript. Sommige van de figuren van dit artikel zijn gemaakt met BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

