Fasertyp- und subzellspezifische Analyse des Lipidtröpfchengehalts in der Skelettmuskulatur
Summary
Immer mehr Beweise deuten darauf hin, dass eine übermäßige Infiltration von Lipiden in der Skelettmuskulatur zu Lipotoxizität und Diabetes führt. Hier präsentieren wir ein vollständiges Protokoll, einschließlich Gewebeverarbeitung, Färbung mit Bodipy, Bildaufnahme und Analyse, um die Größe, Dichte und subzelluläre Verteilung von Lipidtröpfchen auf fasertypspezifische Weise zu quantifizieren.
Abstract
Die Lipidinfiltration der Skelettmuskulatur, bekannt als Myosteatose, nimmt mit Fettleibigkeit und Alterung zu. Myosteatose wurde kürzlich auch als negativer prognostischer Faktor für mehrere andere Erkrankungen wie Herz-Kreislauf-Erkrankungen und Krebs entdeckt. Übermäßige Lipidinfiltration verringert die Muskelmasse und Kraft. Es führt auch zu Lipotoxizität und Insulinresistenz in Abhängigkeit vom gesamten intramyozellulären Lipidgehalt, der Lipidtröpfchenmorphologie (LD) und der subzellulären Verteilung. Der Fasertyp (oxidativ vs. glykolytisch) ist ebenfalls wichtig, da oxidative Fasern eine größere Kapazität zur Nutzung von Lipiden haben. Aufgrund ihrer entscheidenden Implikationen in der Pathophysiologie sind eingehende Studien zur LD-Dynamik und -Funktion in einer fasertypspezifischen Weise gerechtfertigt.
Hierin wird ein vollständiges Protokoll für die Quantifizierung des intramyozellulären Lipidgehalts und die Analyse der LD-Morphologie und der subzellulären Verteilung in einer fasertypspezifischen Weise vorgestellt. Dazu wurden serielle Muskelkryosektionen mit dem fluoreszierenden Farbstoff Bodipy und Antikörpern gegen Myosin-Schwerkettenisoformen angefärbt. Dieses Protokoll ermöglicht die gleichzeitige Verarbeitung verschiedener Muskeln, spart Zeit und vermeidet mögliche Artefakte und dank eines personalisierten Makros, das in Fidschi erstellt wurde, ist auch die Automatisierung der LD-Analyse möglich.
Introduction
Die Lipidinfiltration der Skelettmuskulatur, bekannt als Myosteatose, nimmt mit Fettleibigkeit und Alterung zu. Die Myosteatose korreliert negativ mit Muskelmasse und Kraft und mit der Insulinsensitivität1. Darüber hinaus deuten neuere Studien darauf hin, dass der Grad der Myosteatose als prognostischer Faktor für andere Erkrankungen wie Herz-Kreislauf-Erkrankungen2, nicht-alkoholische Fettlebererkrankungen3 oder Krebs4 verwendet werden könnte. Lipide können sich in der Skelettmuskulatur zwischen Muskelfasern als extramyozelluläre Lipide oder innerhalb der Fasern, als intramyozelluläre Lipide (IMCLs), ansammeln. IMCLs werden überwiegend als Triglyceride in Lipidtröpfchen (LDs) gespeichert, die als Stoffwechselbrennstoff bei körperlicher Betätigung verwendet werden 5,6. Wenn jedoch das Lipidangebot die Nachfrage übersteigt oder wenn Mitochondrien dysfunktional werden, werden IMCLs an der Muskelinsulinresistenz beteiligt, wie sie bei metabolisch ungesunden, fettleibigen Personen und bei Typ-2-Diabetes-Patientenbeobachtet wird 7. Interessanterweise haben Ausdauersportler ähnliche, wenn nicht sogar höhere IMCLs-Spiegel wie bei adipösen Patienten mit Typ-2-Diabetes mellitus, während sie gleichzeitig eine hohe Insulinsensitivität beibehalten. Dieses Phänomen wird als “Athletenparadoxon”8,9 beschrieben und wird durch eine nuanciertere Bewertung der Muskel-LDs in Bezug auf ihre Größe, Dichte, Lokalisation, Dynamik und Zusammensetzung der Lipidspezies erklärt.
Erstens korreliert die LD-Größe umgekehrt mit der Insulinsensitivität und der körperlichen Fitness10,11. Tatsächlich weisen kleinere LDs eine relativ größere Oberfläche für die Lipasewirkung auf und haben daher möglicherweise eine größere Fähigkeit, Lipide zu mobilisieren12. Zweitens spielt die LD-Dichte (Anzahl/Oberfläche) eine umstrittene Rolle bei der Insulinwirkung 8,10; Dennoch scheint es bei Athleten erhöht zu sein. Drittens ist die subzelluläre Lokalisation von LDs wichtig, da LDs, die sich direkt unter der Oberflächenmembran (subsarkolemmal oder peripher) befinden, eine schädlichere Wirkung auf die Insulinsensitivität ausüben als zentrale 8,9,13. Letztere liefern Brennstoff für zentrale Mitochondrien, die eine größere Atmungsaktivität haben und spezialisierter sind, um den hohen Energiebedarf zu decken, der für die Kontraktionerforderlich ist 14. Im Gegensatz dazu liefern periphere LDs subsarkolämale Mitochondrien, die an membranbezogenen Prozessen beteiligt sind8. Schließlich können über Triglyceride hinaus spezifische komplexe Lipide im Muskel schädlicher sein als andere. Zum Beispiel können sich Diacylglycerin, langkettiges Acyl-CoA und Ceramide im Muskel ansammeln, wenn die Triglycerid-Umsatzrate niedrig ist, wodurch die Insulinsignalisierung 9,15 beeinträchtigt wird. Um auf das “Athletenparadoxon” zurückzukommen: Ausdauersportler haben eine hohe Anzahl kleinerer zentraler LDs mit erhöhten Fluktuationsraten in Typ I (oxidativen) Fasern, während adipöse und diabetische Patienten größere periphere LDs mit niedrigen Fluktuationsraten in Typ II (glykolytischen) Fasern haben 8,15,16. Zusätzlich zu ihrer Rolle bei der Energiespeicherung und -freisetzung könnten LDs über abgeleitete Fettsäuren (FA) und ein Mantelprotein (Perilipin 5) auch als kritische Akteure fungieren, die an der transkriptionellen Regulation der FA-Oxidation und der mitochondrialen Biogenese beteiligt sind8. Aufgrund ihrer entscheidenden Implikationen in der Physiologie und Pathophysiologie sind eingehende Studien über die Dynamik und Funktionen von LDs gerechtfertigt.
Obwohl es mehrere Techniken gibt, um IMCLs zu untersuchen, sind sie nicht alle geeignet, LD-Größe, -Dichte und -Verteilung auf faserspezifische Weise genau zu quantifizieren. Zum Beispiel bietet die Bewertung von IMCLs durch Magnetresonanzspektroskopie zwar nicht-invasiv, bietet aber eine Auflösung, die nicht ausreicht, um die Größe und genaue Position von LDs innerhalb der Faser zu untersuchen, und sie ist nicht fasertypspezifisch17,18. Ebenso können biochemische Techniken, die an Ganzmuskelhomogenaten19 durchgeführt werden, die Lage und Größe von Lipiden nicht beurteilen. Folglich ist die am besten geeignete Methode zur Analyse der LD-Morphologie und -Ortung die quantitative elektronische Transmissionsmikroskopie13, aber diese Technik ist teuer und zeitaufwendig. Daher hat sich die konfokale Fluoreszenzbildgebung auf Präparaten mit Farbstoffen wie Oil Red O (ORO)20,21, Monodansylpentan (MDH)22 oder Bodipy23,24,25 als das beste Werkzeug für diese Studien herausgestellt.
Hier wird ein vollständiges Protokoll beschrieben, einschließlich Gewebeentnahme und -verarbeitung, Bodipy-Färbung und konfokaler Bildaufnahme und -analyse zur Quantifizierung der LD-Größe, -Anzahl und -Lokalisation in Mausmuskel-Kryosektionen. Da IMCLs nicht gleichmäßig auf oxidative und glykolytische Fasern verteilt sind und jeder Fasertyp die LD-Dynamik unterschiedlich reguliert, muss die Untersuchung von IMCLs fasertypspezifischsein 16,25,26,27. Daher verwendet dieses Protokoll Immunfluoreszenz auf seriellen Abschnitten, um Myosin Heavy Chain (MyHC) Isoform(en) zu identifizieren, die von jeder Faser exprimiert werden. Ein weiterer Vorteil dieses Protokolls ist die gleichzeitige Verarbeitung eines glykolytischen (Extensor digitorum longus, EDL) und eines oxidativen (Soleus) Muskels, die vor dem Einfrieren nebeneinander angeordnet sind (Abbildung 1). Diese gleichzeitige Verarbeitung spart nicht nur Zeit, sondern vermeidet auch Variabilität durch die getrennte Verarbeitung der Proben.
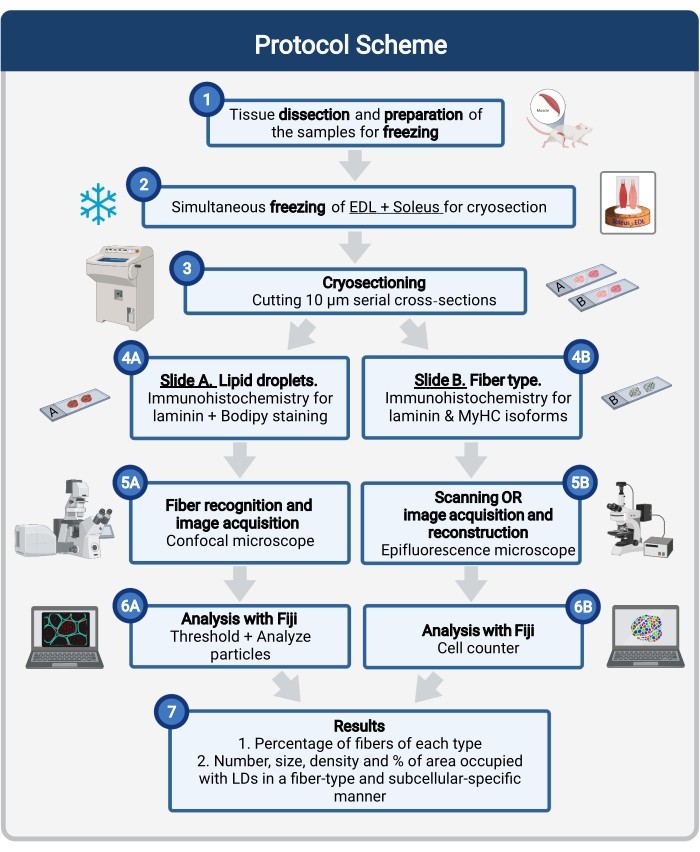
Abbildung 1: Schematische Übersicht des Vorgehens. Nach der Muskeldissektion (1) werden ausgewählte Muskeln ähnlicher Größe vorbereitet und zusammen eingefroren (2). Serielle Querschnitte von 10 μm werden mit einem Kryostaten erhalten und direkt auf Adhäsionsobjektträgern montiert (3). Aus zwei seriellen Objektträgern ist der erste (4A) für Laminin immunmarkiert und mit Bodipy gefärbt, um LDs zu erkennen, und der zweite (4B) ist mit Antikörpern gegen MyHCs zur Erkennung von Muskelfasertypen immunresistent. Die Bilder werden mit einem konfokalen Mikroskop für Bodipy (5A) und einem Epifluoreszenzmikroskop für Muskelfasertypen (5B) aufgenommen. Die Bilder werden in Fidschi analysiert, indem ein Schwellenwert angewendet und Partikel (6A) quantifiziert werden, um die Anzahl, die durchschnittliche Größe, die Dichte und den Prozentsatz der Gesamtfläche zu erhalten, die von LDs (7) oder Zählzellen (6B) eingenommen wird, um den Prozentsatz der Fasern jedes Typs im Abschnitt (7) zu erhalten. Abkürzungen: LDs = Lipidtröpfchen; EDL = Extensor digitorum longus; MyHCs = Myosin-Schwerkettenisoformen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Das hier beschriebene Protokoll beschreibt eine effiziente Methode zur Quantifizierung von LDs, die mit Bodipy auf einer faser- und subzellularspezifischen Basis markiert sind. In den letzten Jahren wurden klassische Lipidfarbstoffe wie ORO oder Sudan Black B durch eine neue Reihe von zelldurchlässigen, lipophilen, fluoreszierenden Farbstoffen ersetzt, die an neutrale Lipide binden (z. B. Bodipy). Bodipy ist als verschiedene Konjugate erhältlich und hat sich als sehr effektiv bei der Markierung von LDs erwiesen, um ihr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch Zuschüsse des Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) und der Société Francophone du Diabète (SFD-Roche Diabetes Care) unterstützt.C.M.S. erhält ein Ph.D.-Stipendium der FRIA (FNRS). M.A.D.-L.d.C. erhielt ein Stipendium des Wallonie-Bruxelles International Excellence Program.
Die Autoren danken Alice Monnier für ihren Beitrag zur Entwicklung dieses Protokolls und Caroline Bouzin für ihre Expertise und technische Hilfe bei der Bildaufnahme. Wir danken auch der Bildgebungsplattform 2IP-IREC für den Zugang zum Kryostaten und den Mikroskopen (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Brüssel, Belgien). Abschließend möchten sich die Autoren bei Nicolas Dubuisson, Romain Versele und Michel Abou-Samra für ihre konstruktive Kritik am Manuskript bedanken. Einige der Figuren dieses Artikels wurden mit BioRender.com erstellt.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

