סוג הסיבים וניתוח ספציפי תת-תאי של תכולת טיפות השומנים בשרירי השלד
Summary
עדויות הולכות וגוברות מצביעות על כך שחדירה מוגזמת של שומנים בתוך שרירי השלד גורמת לליפטוקסיות ולסוכרת. כאן אנו מציגים פרוטוקול שלם, כולל עיבוד רקמות, צביעה עם Bodipy, רכישת תמונה וניתוח, כדי לכמת את הגודל, הצפיפות וההתפלגות התת-תאית של טיפות שומנים באופן ספציפי מסוג סיבים.
Abstract
חדירת שומנים בשריר השלד, המכונה מיואסטאטוזיס, עולה עם השמנת יתר והזדקנות. מיאוסטאטוזיס התגלתה לאחרונה גם כגורם פרוגנוסטי שלילי למספר הפרעות אחרות כגון מחלות לב וכלי דם וסרטן. חדירת שומנים מוגזמת מפחיתה את מסת השריר ואת כוחו. היא גם גורמת לליפטוקסיות ולתנגודת לאינסולין בהתאם לתכולת השומנים התוך-תאיים הכוללת, למורפולוגיה של טיפות השומנים (LD) ולפיזור התת-תאי. סוג הסיבים (חמצון לעומת גליקוליטי) חשוב גם הוא, שכן לסיבים חמצוניים יש יכולת גדולה יותר להשתמש בשומנים. בגלל ההשלכות הקריטיות שלהם בפתופיזיולוגיה, יש צורך במחקרים מעמיקים על דינמיקה ותפקוד של LD באופן ספציפי לסוג הסיבים.
להלן מוצג פרוטוקול מלא לכימות תכולת השומנים התוך-תאיים ולניתוח מורפולוגיה של LD והתפלגות תת-תאית באופן ספציפי לסוג הסיבים. לשם כך, קריוזקציות שרירים סדרתיות הוכתמו בצבע הפלואורסצנטי Bodipy ובנוגדנים נגד איזופורמים של שרשרת כבדה של מיוזין. פרוטוקול זה מאפשר עיבוד סימולטני של שרירים שונים, חוסך זמן ונמנע מממצאים אפשריים, ובזכות מאקרו מותאם אישית שנוצר בפיג’י, האוטומטיזציה של ניתוח LD אפשרית גם כן.
Introduction
חדירת שומנים בשריר השלד, המכונה מיואסטאטוזיס, עולה עם השמנת יתר והזדקנות. מיואסטאטוזיס מתואמת באופן שלילי עם מסת שריר וכוח ועם רגישות לאינסולין1. יתר על כן, מחקרים אחרונים מצביעים על כך שמידת המיוסטאטוזיס יכולה לשמש כגורם פרוגנוסטי למצבים אחרים כגון מחלות לב וכלי דם2, מחלת כבד שומני שאינה אלכוהולית3, או סרטן4. שומנים יכולים להצטבר בשרירי השלד בין סיבי השריר כשומנים חוץ-תאיים או בתוך הסיבים, כמו שומנים תוך-תאיים (IMCLs). IMCLs מאוחסנים בעיקר כטריגליצרידים בטיפות שומנים (LDs) המשמשים כדלק מטבולי במהלך פעילות גופנית 5,6. עם זאת, כאשר היצע השומנים עולה על הביקוש, או כאשר המיטוכונדריה הופכת לבלתי מתפקדת, IMCLs יהיו מעורבים בתנגודת לאינסולין בשרירים, כפי שניתן לראות אצל אנשים לא בריאים מבחינה מטבולית, שמנים ובחולי סוכרת מסוג 27. באופן מסקרן, לספורטאי סיבולת יש רמות דומות, אם לא גבוהות יותר, של IMCLs לאלה שנמצאו בחולים שמנים עם סוכרת מסוג 2, תוך שמירה על רגישות גבוהה לאינסולין. תופעה זו מתוארת כ”פרדוקס הספורטאי”8,9, והיא מוסברת על ידי הערכה ניואנסית יותר של LDs שרירים, הקשורים לגודלם, צפיפותם, לוקליזציה, דינמיקה והרכב מיני שומנים.
ראשית, גודל LD נמצא בקורלציה הפוכה לרגישות לאינסולין ולכושר גופני10,11. למעשה, LDs קטנים יותר מציגים שטח פנים גדול יחסית לפעולת ליפאז, ולכן, יש להם יכולת גדולה יותר לגייס שומנים12. שנית, צפיפות LD (מספר/משטח) ממלאת תפקיד שנוי במחלוקת בפעולתהאינסולין 8,10; עם זאת, נראה כי הוא גדל בספורטאים. שלישית, הלוקליזציה התת-תאית של LDs חשובה, שכן LDs הממוקמים ממש מתחת לממברנה של פני השטח (תת-סרקולמל או היקפי) מפעילים השפעה מזיקה יותר על הרגישות לאינסולין מאשר אלה המרכזיים 8,9,13. אלה האחרונים מספקים דלק למיטוכונדריה מרכזית, שיש לה פעילות נשימתית גדולה יותר ומתמחה יותר כדי לענות על הביקוש האנרגטי הגבוה הנדרש להתכווצות14. לעומת זאת, LDs היקפיים מספקים מיטוכונדריה תת-סרקולמלית, המעורבים בתהליכים הקשורים לממברנה8. לבסוף, מעבר לטריגליצרידים, שומנים מורכבים ספציפיים בתוך השריר עשויים להיות מזיקים יותר מאחרים. לדוגמה, דיאצילגליצרול, אציל-CoA ארוך שרשרת וסרמידים עשויים להצטבר בשריר כאשר שיעור תחלופת הטריגליצרידים נמוך, ובכך לפגוע באינסולין המאותתעל 9,15. אם נחזור ל”פרדוקס של הספורטאי”, לספורטאי סיבולת יש מספר גבוה של LDs מרכזיים קטנים יותר עם שיעורי תחלופה גבוהים בסיבים מסוג I (חמצוניים), בעוד שלחולי השמנת יתר וסוכרת יש LD היקפיים גדולים יותר עם שיעורי תחלופה נמוכים יותר בסיבים מסוג II (גליקוליטי) 8,15,16. בנוסף לתפקידם באגירת ושחרור אנרגיה, LDs באמצעות חומצות שומן נגזרות (FA) וחלבון פרווה (פריליפין 5) יכולים גם לתפקד כשחקנים קריטיים המעורבים בוויסות השעתוק של חמצון FA וביוגנזה מיטוכונדריאלית8. בגלל ההשלכות המכריעות שלהם בפיזיולוגיה ובפתופיזיולוגיה, יש הצדקה למחקרים מעמיקים על דינמיקה ותפקודים של LDs.
למרות שישנן מספר טכניקות לחקר IMCLs, לא כולן מתאימות לכימות מדויק של גודל LD, צפיפותו והתפלגותו באופן ספציפי לסיבים. לדוגמה, ההערכה של IMCLs על ידי ספקטרוסקופיית תהודה מגנטית, למרות היותה לא פולשנית, מציעה רמת רזולוציה שאינה מספיקה כדי לחקור את הגודל והמיקום המדויק של LDs בתוך הסיבים, והיא אינה ספציפית מסוג סיבים17,18. כמו כן, טכניקות ביוכימיות המבוצעות על הומוגנטים של שרירים שלמים19 אינן יכולות להעריך את מיקומם וגודלם של שומנים. כתוצאה מכך, השיטה המתאימה ביותר לניתוח המורפולוגיה והמיקום של LD היא מיקרוסקופיה אלקטרונית של שידור כמותי13, אך טכניקה זו יקרה וגוזלת זמן רב. לכן, הדמיה פלואורסצנטית קונפוקלית על תכשירים עם צבעים כגון שמן אדום O (ORO)20,21, monodansylpentane (MDH)22, או Bodipy 23,24,25, התגלתה ככלי הטוב ביותר למחקרים אלה.
כאן מתואר פרוטוקול שלם, הכולל דגימה ועיבוד של רקמות, צביעת Bodipy, ורכישה וניתוח של תמונה קונפוקלית כדי לכמת את הגודל, המספר והלוקליזציה של LD בקריואזות שרירי העכבר. מאחר ש-IMCLs אינם מחולקים באופן שווה בין סיבים חמצוניים וגליקוליטיים, וכל סוג סיבים מווסת את הדינמיקה של LD באופן שונה, המחקר של IMCLs חייב להיות ספציפי מסוג סיבים 16,25,26,27. לכן, פרוטוקול זה משתמש באימונופלואורסצנציה בחתכים סדרתיים כדי לזהות איזופורמים של שרשרת כבדת מיוזין (MyHC) המבוטאים על ידי כל סיב. יתרון נוסף של פרוטוקול זה הוא עיבוד סימולטני של שריר גליקוליטי (extensor digitorum longus, EDL) ושריר חמצוני (סולוס) המונחים זה לצד זה לפני הקפאה (איור 1). עיבוד סימולטני זה לא רק חוסך זמן אלא גם מונע השתנות עקב עיבוד נפרד של הדגימות.
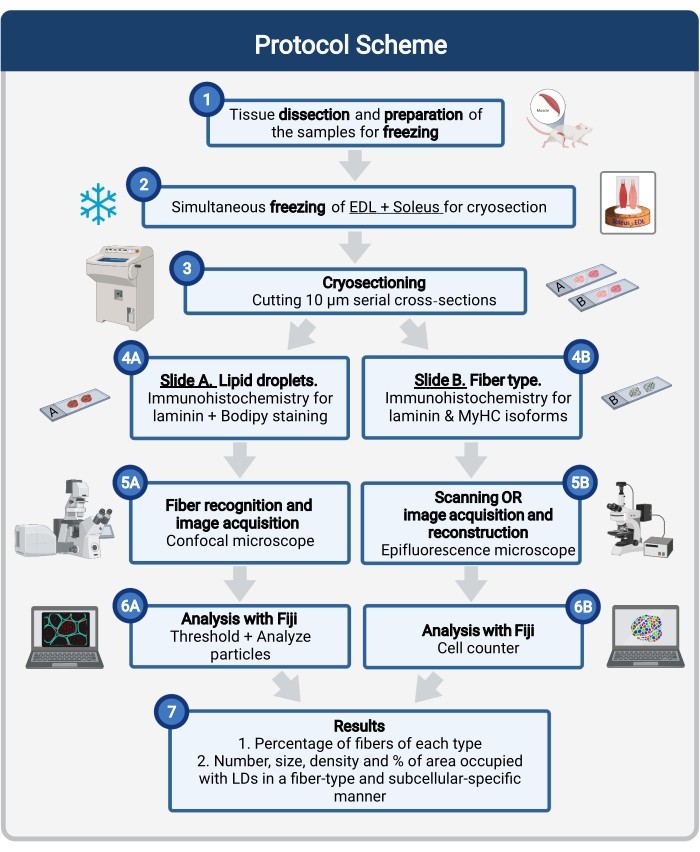
איור 1: סקירה סכמטית של ההליך. לאחר כריתת שרירים (1), השרירים שנבחרו בגודל דומה מוכנים ומקפואים יחד (2). מקטעים רוחביים טוריים של 10 מיקרומטר מתקבלים באמצעות קריוסטאט ומורכבים ישירות על שקופיות הידבקות (3). משתי שקופיות סדרתיות, הראשונה (4A) מסומנת באופן חיסוני ללאמינין ומוכתמת ב-Bodipy כדי לזהות LDs והשנייה (4B) מוכתמת בנוגדנים נגד MyHCs לזיהוי סוגי סיבי שריר. התמונות נרכשות באמצעות מיקרוסקופ קונפוקלי עבור Bodipy (5A) ומיקרוסקופ אפיפלואורסצנטי לסוגי סיבי שריר (5B). התמונות מנותחות בפיג’י על ידי החלת סף וכימות חלקיקים (6A) כדי לקבל את המספר, הגודל הממוצע, הצפיפות והאחוז של השטח הכולל שנכבש על ידי LDs (7) או ספירת תאים (6B) כדי לקבל את אחוז הסיבים מכל סוג בסעיף (7). קיצורים: LDs = טיפות שומנים; EDL = extensor digitorum longus; MyHCs = איזופורמים של שרשרת כבדה של מיוזין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
הפרוטוקול המפורט כאן מתאר שיטה יעילה לכימות LDs המתויגים עם Bodipy על בסיס ספציפי לסוג סיבים ותת-תאיים. בשנים האחרונות, צבעי שומנים קלאסיים, כגון ORO או סודן שחור B, הוחלפו במערך חדש של צבעים חדירים לתאים, ליפופיליים, פלואורסצנטיים הנקשרים לשומנים ניטרליים (למשל, Bodipy). Bodipy, הזמין כמצומדים שונים, הו…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מה-Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) ומ-Société Francophone du Diabète (טיפול בסוכרת SFD-Roche).C.M.S. הוא זוכה מלגת דוקטורט מטעם ה-FRIA (FNRS). M.A.D.-L.d.C. קיבל מלגה מתוכנית המצוינות הבינלאומית של וולוני-בריסל.
המחברים מודים לאליס מונייה על תרומתה לפיתוח פרוטוקול זה ולקרוליין בוזין על מומחיותה ועזרתה הטכנית בתהליך רכישת התמונה. אנו מודים גם לפלטפורמת ההדמיה 2IP-IREC על הגישה לקריוסטאט ולמיקרוסקופים (פלטפורמת הדמיה 2IP-IREC, המכון למחקר ניסויי וקליני, אוניברסיטת קתוליק דה לוביין, 1200 בריסל, בלגיה). לבסוף, המחברים מבקשים להודות לניקולס דובייסון, רומן ווסל ומישל אבו-סמרה על הביקורת הבונה על כתב היד. חלק מהדמויות של מאמרים אלה נוצרו עם BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

