İskelet Kasında Lipid Damlacık İçeriğinin Lif Tipi ve Subhücresel-Spesifik Analizi
Summary
Artan kanıtlar, iskelet kası içindeki lipitlerin aşırı infiltrasyonunun lipotoksisite ve diyabet ile sonuçlandığını göstermektedir. Burada, lipit damlacıklarının boyutunu, yoğunluğunu ve hücre altı dağılımını lif tipine özgü bir şekilde ölçmek için doku işleme, Bodipy ile boyama, görüntü elde etme ve analiz dahil olmak üzere eksiksiz bir protokol sunuyoruz.
Abstract
Miyosteatoz olarak bilinen iskelet kası lipid infiltrasyonu, obezite ve yaşlanma ile birlikte artar. Miyostoeatoz ayrıca son zamanlarda kardiyovasküler hastalık ve kanser gibi diğer birçok bozukluk için negatif bir prognostik faktör olarak keşfedilmiştir. Aşırı lipid infiltrasyonu kas kütlesini ve gücünü azaltır. Ayrıca total intramiyosellüler lipid içeriğine, lipid damlacık (LD) morfolojisine ve hücre altı dağılımına bağlı olarak lipotoksisite ve insülin direnci ile sonuçlanır. Lif tipi (oksidatif vs glikolitik) de önemlidir, çünkü oksidatif lifler lipitleri kullanmak için daha büyük bir kapasiteye sahiptir. Patofizyolojideki önemli etkileri nedeniyle, LD dinamiği ve fonksiyonu üzerine lif tipine özgü bir şekilde derinlemesine çalışmalar yapılması gerekmektedir.
Bu çalışmada, intramiyosellüler lipid içeriğinin ölçülmesi ve LD morfolojisinin ve hücre altı dağılımının lif tipine özgü bir şekilde analizi için eksiksiz bir protokol sunulmaktadır. Bu amaçla, seri kas kriyolitleri floresan boya Bodipy ve miyozin ağır zincir izoformlarına karşı antikorlar ile boyandı. Bu protokol, farklı kasların aynı anda işlenmesini, zamandan tasarruf edilmesini ve olası eserlerin önlenmesini sağlar ve Fiji’de oluşturulan kişiselleştirilmiş bir makro sayesinde LD analizinin otomatikleştirilmesi de mümkündür.
Introduction
Miyosteatoz olarak bilinen iskelet kası lipid infiltrasyonu, obezite ve yaşlanma ile birlikte artar. Miyostoeatoz kas kütlesi ve gücü ile insülin duyarlılığı ile negatif ilişkilidir1. Ayrıca, son zamanlarda yapılan çalışmalar, miyosteatoz derecesinin kardiyovasküler hastalık2, alkolsüz yağlı karaciğer hastalığı3 veya kanser4 gibi diğer durumlar için prognostik bir faktör olarak kullanılabileceğini göstermektedir. Lipitler, kas lifleri arasındaki iskelet kasında ekstramiyosellüler lipitler olarak veya lifler içinde, hücre içi lipitler (IMCL’ler) olarak birikebilir. IMCL’ler ağırlıklı olarak fiziksel egzersiz sırasında metabolik yakıt olarak kullanılan lipit damlacıklarında (LD’ler) trigliseritler olarak depolanır 5,6. Bununla birlikte, lipit arzı talebi aştığında veya mitokondri işlevsiz hale geldiğinde, IMCL’ler metabolik olarak sağlıksız, obez bireylerde ve tip 2 diyabet hastalarında görüldüğü gibi kas insülin direncine neden olacaktır7. İlginçtir ki, dayanıklılık sporcuları, yüksek insülin duyarlılığını korurken, tip 2 diabetes mellituslu obez hastalarda bulunanlara benzer, daha yüksek olmasa da, IMCL seviyelerine sahiptir. Bu fenomen “sporcunun paradoksu”8,9 olarak tanımlanır ve kas LD’lerinin boyutları, yoğunlukları, lokalizasyonları, dinamikleri ve lipit türleri kompozisyonları ile ilgili daha nüanslı bir değerlendirmesi ile açıklanmaktadır.
İlk olarak, LD boyutu insülin duyarlılığı ve fiziksel uygunluk10,11 ile ters orantılıdır. Aslında, daha küçük LD’ler lipaz etkisi için nispeten daha büyük bir yüzey alanı sergiler ve bu nedenle lipitleri mobilize etmek için potansiyel olarak daha büyük bir kapasiteye sahiptir12. İkincisi, LD yoğunluğu (sayı / yüzey) insülin eyleminde tartışmalı bir rol oynar 8,10; ancak sporcularda artmış gibi görünüyor. Üçüncüsü, LD’lerin hücre altı lokalizasyonu önemlidir, çünkü yüzey zarının hemen altında bulunan LD’ler (subsarkolemmal veya periferik), insülin duyarlılığı üzerinde merkezi olanlardan daha zararlı bir etki gösterir 8,9,13. İkincisi, daha büyük bir solunum aktivitesine sahip olan ve kasılma için gereken yüksek enerji talebini karşılamak için daha uzmanlaşmış olan merkezi mitokondriye yakıt sağlar14. Buna karşılık, periferik LD’ler, membranla ilişkili süreçlerde yer alan subsarkolemmal mitokondrisağlar 8. Son olarak, trigliseritlerin ötesinde, kas içindeki spesifik kompleks lipitler diğerlerinden daha zararlı olabilir. Örneğin, diasilgliserol, uzun zincirli açil-CoA ve seramidler, trigliserit devir hızı düşük olduğunda kaslarda birikebilir ve böylece insülin sinyalini 9,15 oranında bozabilir. “Sporcunun paradoksu” na geri dönersek, dayanıklılık sporcuları tip I (oksidatif) liflerde yüksek devir hızlarına sahip çok sayıda daha küçük merkezi LD’ye sahipken, obez ve diyabetik hastalar tip II (glikolitik) liflerde düşük devir oranlarına sahip daha büyük periferik LD’lere sahiptir 8,15,16. Enerji depolama ve salınımındaki rollerine ek olarak, türetilmiş yağ asitleri (FA) ve bir kaplama proteini (perilipin 5) yoluyla LD’ler, FA oksidasyonu ve mitokondriyal biyogenez8’in transkripsiyonel düzenlenmesinde rol oynayan kritik oyuncular olarak da işlev görebilir. Fizyoloji ve patofizyolojideki önemli etkileri nedeniyle, LD’lerin dinamikleri ve fonksiyonları üzerine derinlemesine çalışmalar yapılması gerekmektedir.
IMCL’leri incelemek için çeşitli teknikler olmasına rağmen, hepsi LD boyutunu, yoğunluğunu ve dağılımını liflere özgü bir şekilde doğru bir şekilde ölçmek için uygun değildir. Örneğin, IMCL’lerin manyetik rezonans spektroskopisi ile değerlendirilmesi, invaziv olmamakla birlikte, fiber içindeki LD’lerin boyutunu ve kesin konumunu incelemek için yeterli olmayan bir çözünürlük seviyesi sunar ve fiber tipine özgüdeğildir 17,18. Benzer şekilde, tüm kas homojenatları üzerinde uygulanan biyokimyasal teknikler19, lipitlerin yerini ve boyutunu değerlendiremez. Sonuç olarak, LD morfolojisini ve yerini analiz etmek için en uygun yöntem kantitatif iletim elektronik mikroskopisi13’tür, ancak bu teknik pahalı ve zaman alıcıdır. Bu nedenle, Oil Red O (ORO)20,21, monodansylpentane (MDH)22 veya Bodipy23,24,25 gibi boyalı preparatlarda konfokal floresan görüntüleme bu çalışmalar için en iyi araç olarak ortaya çıkmıştır.
Burada, doku örneklemesi ve işleme, Bodipy boyama ve fare kası kriyökesimlerinde LD boyutunu, sayısını ve lokalizasyonunu ölçmek için konfokal görüntü elde etme ve analiz dahil olmak üzere eksiksiz bir protokol açıklanmaktadır. IMCL’ler oksidatif ve glikolitik lifler arasında eşit olarak dağılmadığından ve her lif tipi LD dinamiklerini farklı şekilde düzenlediğinden, IMCL’lerin incelenmesi lif tipine özgü 16,25,26,27 olmalıdır. Bu nedenle, bu protokol, her bir lif tarafından eksprese edilen miyozin ağır zincir (MyHC) izoformlarını tanımlamak için seri kesitlerde immünofloresan kullanır. Bu protokolün bir diğer avantajı, donmadan önce yan yana yerleştirilmiş bir glikolitik (ekstansör digitorum longus, EDL) ve oksidatif (soleus) bir kasın eşzamanlı olarak işlenmesidir (Şekil 1). Bu eşzamanlı işleme sadece zaman kazandırmakla kalmaz, aynı zamanda numunelerin ayrı ayrı işlenmesi nedeniyle değişkenliği de önler.
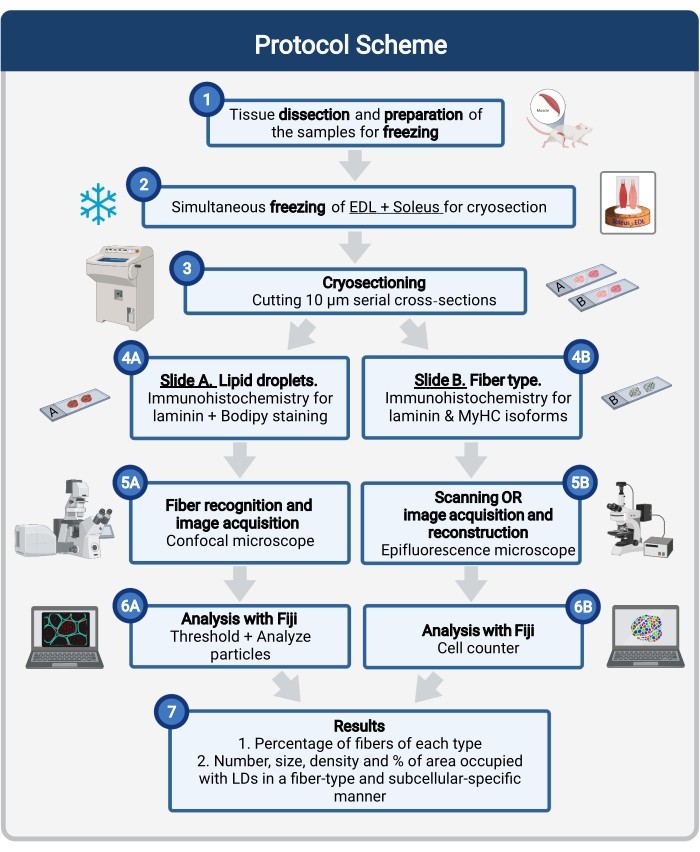
Şekil 1: Prosedüre şematik genel bakış. Kas diseksiyonundan sonra (1) benzer büyüklükte seçilmiş kaslar hazırlanır ve birlikte dondurulur (2). 10 μm’lik seri enine kesitler bir kriyostat kullanılarak elde edilir ve doğrudan yapışma kızaklarına monte edilir (3). İki seri slayttan, birincisi (4A) laminin için immüno-etiketlenir ve LD’leri tanımak için Bodipy ile boyanır ve ikincisi (4B) kas lifi tiplerinin tanınması için MyHC’lere karşı antikorlarla immünoboyalıdır. Görüntüler Bodipy (5A) için bir konfokal mikroskop ve kas lifi tipleri (5B) için bir epifloresan mikroskop kullanılarak elde edilir. Görüntüler, LD’lerin (7) kapladığı toplam alanın sayısını, ortalama boyutunu, yoğunluğunu ve yüzdesini elde etmek için bir eşik uygulanarak ve parçacıkları (6A) ölçerek veya bölümdeki (7) her bir tipteki liflerin yüzdesini elde etmek için hücreleri (6B) sayarak analiz edilir. Kısaltmalar: LD’ler = lipit damlacıkları; EDL = ekstansör digitorum longus; MyHC’ler = miyozin ağır zincir izoformları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Burada ayrıntılı olarak açıklanan protokol, Bodipy ile etiketlenmiş LD’leri fiber tipi ve hücre altı spesifik olarak ölçmek için etkili bir yöntemi açıklamaktadır. Son yıllarda, ORO veya Sudan Black B gibi klasik lipit boyaları, nötr lipitlere (örneğin, Bodipy) bağlanan yeni bir hücre geçirgen, lipofilik, floresan boya dizisi ile değiştirilmiştir. Farklı konjugatlar olarak mevcut olan Bodipy’nin, LD’leri morfolojilerini, dinamiklerini ve diğer organellerle etkileşimlerini incelemek için etik…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) ve Société Francophone du Diabète (SFD-Roche Diabetes Care) tarafından verilen hibelerle desteklenmiştir. M.A.D.-L.d.C., Wallonie-Bruxelles Uluslararası Mükemmellik Programı’ndan burs aldı.
Yazarlar, Alice Monnier’e bu protokolün geliştirilmesine katkılarından dolayı ve Caroline Bouzin’e görüntü edinme sürecindeki uzmanlığı ve teknik yardımı için teşekkür eder. Ayrıca kriyostat ve mikroskoplara erişim için 2IP-IREC görüntüleme platformuna teşekkür ederiz (2IP-IREC Görüntüleme Platformu, Deneysel ve Klinik Araştırma Enstitüsü, Université Catholique de Louvain, 1200 Brüksel, Belçika). Son olarak, yazarlar Nicolas Dubuisson, Romain Versele ve Michel Abou-Samra’ya el yazmasının yapıcı eleştirileri için teşekkür eder. Bu makalenin bazı figürleri BioRender.com oluşturulmuştur.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

