تقنيات الفحص المجهري لتفسير الاستعمار الفطري في أنسجة النباتات المتغايرة والإنبات التكافلي للبذور
Summary
يهدف هذا البروتوكول إلى توفير إجراءات مفصلة لجمع وتثبيت وصيانة عينات النباتات المتغايرة ، وتطبيق تقنيات الفحص المجهري المختلفة مثل المسح المجهري الإلكتروني ونقله ، والمجهر الضوئي ، والكونفوكال ، والمجهر الفلوري لدراسة الاستعمار الفطري في الأنسجة النباتية والبذور المنبتة بالفطريات الفطرية.
Abstract
علم النبات الهيكلي هو منظور لا غنى عنه لفهم كامل للبيئة وعلم وظائف الأعضاء والتنمية وتطور النباتات. عند البحث في النباتات المتغايرة (أي النباتات التي تحصل على الكربون من الفطريات) ، يمكن للجوانب الرائعة من تكيفاتها الهيكلية ، وأنماط استعمار الأنسجة بواسطة الفطريات ، والتشريح المورفوغرافي للأعضاء الجوفية أن تنير استراتيجياتها التنموية وعلاقاتها مع hyphae ، مصدر العناصر الغذائية. دور مهم آخر للفطريات التكافلية يرتبط بإنبات بذور السحلية. جميع أنواع Orchidaceae هي mycoheterotrophic أثناء مرحلة الإنبات والشتلات (المتفطرة الأولية) ، حتى تلك التي تقوم بعملية التمثيل الضوئي في مراحل البالغين. بسبب نقص الاحتياطيات الغذائية في بذور السحلية ، فإن التكافل الفطري ضروري لتوفير الركائز وتمكين الإنبات. يمكن أن يجيب تحليل مراحل الإنبات من خلال وجهات النظر الهيكلية أيضا على أسئلة مهمة تتعلق بتفاعل الفطريات مع البذور. يمكن تطبيق تقنيات تصوير مختلفة للكشف عن النباتات الداخلية للفطريات في الأنسجة النباتية ، كما هو مقترح في هذه المقالة. يمكن تلطيخ الأجزاء اليدوية والرقيقة من الأعضاء النباتية ثم ملاحظتها باستخدام المجهر الخفيف. يمكن تطبيق الفلوروكروم المترافق مع أجغلوتينين جنين القمح على الفطريات واحتضانه مع Calcofluor White لتسليط الضوء على جدران الخلايا النباتية في المجهر البؤري. بالإضافة إلى ذلك ، يتم تفصيل منهجيات المسح المجهري الإلكتروني ونقله لبساتين الفاكهة المتغايرة ، ويتم استكشاف إمكانيات تطبيق هذه البروتوكولات في النباتات ذات الصلة. يتم وصف الإنبات التكافلي لبذور السحلية (أي في وجود الفطريات الفطرية) في البروتوكول بالتفصيل ، إلى جانب إمكانيات إعداد الهياكل التي تم الحصول عليها من مراحل مختلفة من الإنبات للتحليل باستخدام المجهر الضوئي والمشبك والإلكتروني.
Introduction
البحوث الهيكلية في علم النبات ، والتي تغطي مورفولوجيا النبات والتشريح ، أساسية في فهم الكائن الحي بأكمله1،2 ، وتوفر وجهات نظر لا غنى عنها لدمج والمساهمة في المعرفة المتعلقة بالبيئة وعلم وظائف الأعضاء والتنمية وتطور النباتات3. تشمل الطرق في مورفولوجيا النبات والتشريح حاليا البروتوكولات والمعدات والمعرفة التي تم تطويرها مؤخرا وكذلك منذ أكثر من قرن من الزمان2. إن التنفيذ المستمر والتكيف مع الأساليب الكلاسيكية (مثل المجهر الضوئي) جنبا إلى جنب مع التقنيات الحديثة (مثل المجهر البؤري ، التصوير المقطعي المصغر بالأشعة السينية) لها نفس الأساس الأساسي: المعرفة النظرية التي تمكن من تطوير منهجية.
الأداة الرئيسية في تشريح النبات والمورفولوجيا هي الصورة. على الرغم من الاعتقاد الخاطئ بأن هذه التحليلات هي ملاحظات بسيطة ، مما يعطي مساحة للتفسيرات الذاتية2 ، فإن تحليل وفهم الصور في هذا المجال يتطلب معرفة الأساليب المطبقة (المعدات ، ونوع التحليل ، والإجراءات المنهجية) ، ومكونات الخلية ، والكيمياء النسيجية ، وجسم النبات (تنظيم الأنسجة ووظيفتها ، وعلم الوراثة ، والتكيفات المورفولوجية). يمكن أن يؤدي تفسير الصور التي تم الحصول عليها عبر مجموعة متنوعة من الطرق إلى ربط الشكل والوظيفة ، وفك رموز التركيب الكيميائي للبنية ، والتأييد في وصف الأصناف ، وفهم العدوى بمسببات الأمراض النباتية ، وغيرها من التقييمات المماثلة.
عند البحث في النباتات المتغايرة (MH) (أي النباتات غير الضوئية التي تحصل على الكربون من الفطريات الفطرية 4,5) ، يمكن للجوانب الرائعة من تكيفاتها الهيكلية ، وأنماط استعمار الأنسجة بواسطة الفطريات ، والتشريح المورفوغرافي للأعضاء الجوفية أن تنير استراتيجيات تنميتها وعلاقاتها مع hyphae ، والتي هي مصدر العناصر الغذائية. عادة ما تظهر الأعضاء الجوفية لنباتات MH تكيفات مهمة تتعلق بارتباطها بفطريات التربة ، وبالتالي من الضروري إجراء هذه التحقيقات التشريحية والمورفولوجية6. لا ينبغي تجاهل الأعضاء الهوائية لأنواع MH ، حيث يمكن أن تكون النباتات الداخلية موجودة أيضا في هذه الأنسجة ، حتى لو لم تكن فطريات فطرية (ملاحظات شخصية ، لم تنشر بعد).
إلى جانب الجوهرية الراسخة لارتباط الفطريات الفطرية بأنواع MH خلال دورة حياتها بأكملها7 ، فإن كل أنواع السحلية ، حتى الأنواع ذاتية التغذية ، لها مرحلة أولية ملزمة من التغذية الفطرية في البيئات الطبيعية. يحدث ذلك لأن جنين بساتين الفاكهة غير متمايز ويفتقر إلى السويداء أو النبتات ، وبالتالي فهو غير قادر على التطور وتأسيس نفسه في البيئات الطبيعية دون الدعم الغذائي من الشركاء الفطريين 4,8. وبالنظر إلى أنه يمكن تطبيق بروتوكولات الإنبات التكافلي ليس فقط على أنواع MH ولكن أيضا على بساتين الفاكهة الضوئية ، بهدف التحقيق في خصوصية فطريات السحلية في الإنبات وتطوير البروتوكروم ، وهي منهجية مطبقة على نطاق واسع في مبادرات الحفاظ على الأنواع المهددة بالانقراض9،10،11.
في تجميع الطرق هذا ، نصف الخطوات المهمة التي ينطوي عليها جمع وتثبيت وتخزين عينات نبات MH للدراسات التشريحية (القسم 1) ، وتحليل السطح واختيار العينات (القسم 2) ، وطرق التقسيم (اليدوي: القسم 3 ، الميكروتوميا: القسم 4 ، الاستئصال المجهري بالتبريد: القسم 5) ، التلطيخ والتركيب (القسم 6) ، التألق والمجهر البؤري للنباتات الداخلية الفطرية (القسم 7) ، المجهر الإلكتروني الماسح (القسم 8) ، والمجهر الإلكتروني الناقل (القسم 9). بالإضافة إلى ذلك ، نصف طريقة الإنبات التكافلي لبذور السحلية (MH و autotrophic ، القسم 10) ، حيث يمكن تطبيق طرق التصوير المذكورة سابقا بنجاح لتحليل الاستعمار الفطري للبذور والبروتوكورمات والشتلات في عملية الإنبات.
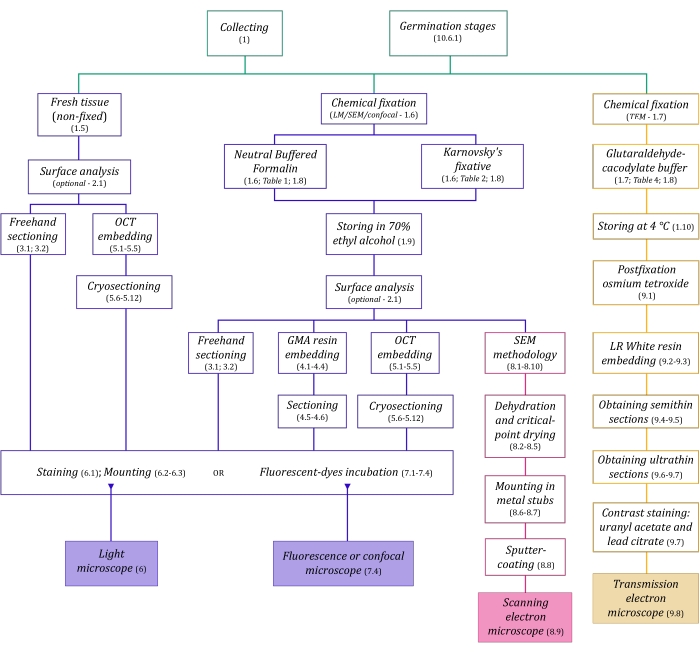
الشكل 1: التلخيص التخطيطي لطرق التصوير. توفر المخططات مؤشرات على خطوات البروتوكول التي يتم تفصيلها فيها. الاختصارات: GMA = ميثاكريلات غليكول ، OCT = مركب درجة حرارة القطع الأمثل ، SEM = المجهر الإلكتروني الماسح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يسبق تقنيات الفحص المجهري الموصوفة هنا بالتفصيل (الشكل 1) الخطوات الأساسية التالية: جمع العينات وإصلاحها وتجفيفها وتضمينها وتقسيمها. نظرا لأن الخطوات متغيرة (الشكل 1) اعتمادا على التقنية (التقنيات) المختارة ، فمن المهم التفكير في المستقبل ، مع مراعاة المثبتات التي سيتم إعدادها ونقلها إلى موقع التجميع ، وكيفية إعداد العينات قبل التثبيت ، وعمليات الجفاف التي سيتم استخدامها (القسم 1) ، وإمكانيات التضمين المختلفة وطرق التقسيم (الأقسام 4 ، 5 ، و 9). يلخص الشكل 1 بالتتابع جميع الخطوات المطلوبة لكل تقنية من تقنيات الفحص المجهري الموضحة بدقة أدناه.
Protocol
Representative Results
Discussion
تتمتع تحليلات الصور في تشريح النبات ومورفولوجيا بإمكانات مهمة لتحقيق الأهداف والمساعدة في فهم العلاقات بين النباتات المتغايرة والنباتات الداخلية الفطرية التي لا غنى عنها ، كما يتضح من دراسات الأعضاء الجوفية 6,40 ، والتحليلات الهيكلية للإنبات التكافلي للبذور3…
Disclosures
The authors have nothing to disclose.
Acknowledgements
يشكر المؤلفون التمويل المقدم من FAEPEX و FAPESP (2015/26479-6). يشكر MPP Capes على منحة درجة الماجستير (العملية 88887.600591/2021-00) و CNPq. JLSM يشكر CNPq على منح الإنتاجية (303664/2020-7). ويشكر المؤلفون أيضا الوصول إلى المعدات والمساعدة التي يقدمها مختبر المجهر الإلكتروني – IB/Unicamp)، والمعهد الوطني للعلوم والتكنولوجيا في مجال الضوئيات المطبقة على بيولوجيا الخلية – Unicamp)، ومختبر بيولوجيا الأوعية الدموية – DBEF/IB/Unicamp)؛ LAMEB (UFSC) وإليانا دي ميديروس أوليفيرا (UFSC) للمساهمات في بروتوكول الحماية من التبريد ؛ LME للمساهمات في بروتوكول TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

