Mikroskopische Techniken zur Interpretation der Pilzbesiedlung in mykoheterotrophen Pflanzengeweben und der symbiotischen Keimung von Samen
Summary
Dieses Protokoll zielt darauf ab, detaillierte Verfahren zum Sammeln, Fixieren und Pflegen mykoheterotropher Pflanzenproben bereitzustellen, wobei verschiedene Mikroskopietechniken wie Raster- und Transmissionselektronenmikroskopie, Licht-, Konfokal- und Fluoreszenzmikroskopie angewendet werden, um die Pilzbesiedlung in Pflanzengeweben und Samen zu untersuchen, die mit Mykorrhizapilzen gekeimt sind.
Abstract
Strukturelle Botanik ist eine unverzichtbare Perspektive, um die Ökologie, Physiologie, Entwicklung und Evolution von Pflanzen vollständig zu verstehen. Bei der Erforschung mykoheterotropher Pflanzen (d.h. Pflanzen, die Kohlenstoff aus Pilzen gewinnen) können bemerkenswerte Aspekte ihrer strukturellen Anpassungen, die Muster der Gewebebesiedlung durch Pilze und die Morphoanatomie unterirdischer Organe ihre Entwicklungsstrategien und ihre Beziehungen zu Hyphen, der Quelle von Nährstoffen, aufklären. Eine weitere wichtige Rolle symbiotischer Pilze hängt mit der Keimung von Orchideensamen zusammen; Alle Orchidaceae-Arten sind während der Keimung und des Keimlingsstadiums (anfängliche Mykoheterotrophie) mykoheterotroph, auch diejenigen, die in erwachsenen Stadien Photosynthese betreiben. Aufgrund des Mangels an Nahrungsreserven in Orchideensamen sind Pilzsymbionten unerlässlich, um Substrate bereitzustellen und die Keimung zu ermöglichen. Die Analyse der Keimungsstadien nach strukturellen Perspektiven kann auch wichtige Fragen zur Interaktion der Pilze mit den Samen beantworten. Verschiedene bildgebende Verfahren können angewendet werden, um Pilzendophyten in Pflanzengeweben zu enthüllen, wie in diesem Artikel vorgeschlagen. Freihändige und dünne Schnitte von Pflanzenorganen können gefärbt und anschließend lichtmikroskopisch beobachtet werden. Ein mit Weizenkeimagglutinin konjugiertes Fluorochrom kann auf die Pilze aufgetragen und mit Calcofluor White co-inkubiert werden, um Pflanzenzellwände in der konfokalen Mikroskopie hervorzuheben. Darüber hinaus werden die Methoden der Raster- und Transmissionselektronenmikroskopie für mykoheterotrophe Orchideen detailliert beschrieben und die Möglichkeiten der Anwendung solcher Protokolle in verwandten Pflanzen untersucht. Die symbiotische Keimung von Orchideensamen (d.h. in Gegenwart von Mykorrhizapilzen) wird im Protokoll ausführlich beschrieben, ebenso wie Möglichkeiten, die aus verschiedenen Keimungsstadien erhaltenen Strukturen für Analysen mit Licht-, Konfokal- und Elektronenmikroskopie vorzubereiten.
Introduction
Strukturforschung in der Botanik, die Pflanzenmorphologie und Anatomie abdeckt, ist grundlegend für das Verständnis des gesamten Organismus1,2 und bietet unverzichtbare Perspektiven, um Wissen über die Ökologie, Physiologie, Entwicklung und Evolution von Pflanzen zu integrieren und dazu beizutragen3. Methoden in der Pflanzenmorphologie und Anatomie umfassen derzeit Protokolle, Geräte und Kenntnisse, die in jüngster Zeit sowie vor mehr als einem Jahrhundert entwickelt wurden2. Die kontinuierliche Durchführung und Anpassung klassischer Methoden (z.B. Lichtmikroskopie) sowie neuerer Techniken (z.B. konfokale Mikroskopie, Röntgenmikrotomographie) haben die gleiche wesentliche Grundlage: theoretisches Wissen, das die Entwicklung einer Methodik ermöglicht.
Das Hauptwerkzeug in der Pflanzenanatomie und -morphologie ist das Bild. Trotz des Missverständnisses, dass es sich bei solchen Analysen um einfache Beobachtungen handelt, die subjektiven Interpretationen Raum geben2, erfordert die Analyse und das Verständnis von Bildern in diesem Bereich Kenntnisse der angewandten Methoden (Ausrüstung, Art der Analyse, methodische Verfahren), der Zellbestandteile, der Histochemie und des Pflanzenkörpers (Gewebeorganisation und -funktion, Ontogenese, morphologische Anpassungen). Die Interpretation der mit einer Vielzahl von Methoden erhaltenen Bilder kann dazu führen, Form und Funktion zu korrelieren, die chemische Zusammensetzung einer Struktur zu entschlüsseln, die Beschreibung von Taxa zu bestätigen, Infektionen durch Phytopathogene zu verstehen und andere solche Bewertungen.
Bei der Erforschung mykoheterotropher (MH) Pflanzen (d.h. nicht-photosynthetischer Pflanzen, die Kohlenstoff aus Mykorrhizapilzen gewinnen4,5), können bemerkenswerte Aspekte ihrer strukturellen Anpassungen, die Muster der Gewebebesiedlung durch Pilze und die Morphoanatomie unterirdischer Organe ihre Entwicklungsstrategien und Beziehungen zu Hyphen, die die Quelle von Nährstoffen sind, aufklären. Die unterirdischen Organe von MH-Pflanzen zeigen in der Regel wichtige Anpassungen im Zusammenhang mit ihrer Assoziation mit Bodenpilzen, daher ist es wichtig, diese anatomischen und morphologischen Untersuchungen durchzuführen6. Die Luftorgane von MH-Arten sollten nicht ignoriert werden, da in diesen Geweben auch Endophyten vorhanden sein können, auch wenn es sich nicht um Mykorrhizapilze handelt (persönliche Beobachtungen, noch nicht veröffentlicht).
Neben der gut etablierten Wesentlichkeit der Assoziation von Mykorrhizapilzen mit MH-Arten während ihres gesamten Lebenszyklus7 hat jede Orchideenart, auch die autotrophen, ein initiales obligates mykoheterotrophes Stadium in natürlichen Umgebungen. Es tritt auf, weil der Embryo der Orchideen undifferenziert ist und kein Endosperm oder Keimblätter aufweist, so dass er ohne die Ernährungsunterstützung von Pilzpartnern nicht in der Lage ist, sich in natürlichen Umgebungen zu entwickeln und zu etablieren 4,8. In Anbetracht dessen können symbiotische Keimungsprotokolle nicht nur auf MH-Arten, sondern auch auf photosynthetisierende Orchideen angewendet werden, um die Spezifität von Orchideen und Pilzen bei der Keimung und Protocormentwicklung zu untersuchen, eine weitgehend angewandte Methodik in Initiativen zur Erhaltung bedrohter Arten 9,10,11.
In dieser Methodenmontage beschreiben wir wichtige Schritte zur Entnahme, Fixierung und Lagerung von MH-Pflanzenproben für anatomische Studien (Abschnitt 1), Oberflächenanalyse und Probenauswahl (Abschnitt 2), Schnittmethoden (Freihand: Abschnitt 3, Mikrotomie: Abschnitt 4, Kryomikrotomie: Abschnitt 5), Färbung und Montage (Abschnitt 6), Fluoreszenz- und Konfokalmikroskopie von Pilzendophyten (Abschnitt 7), Rasterelektronenmikroskopie (Abschnitt 8), und Transmissionselektronenmikroskopie (Abschnitt 9). Darüber hinaus beschreiben wir eine symbiotische Keimungsmethode für Orchideensamen (MH und autotroph, Abschnitt 10), da die zuvor genannten bildgebenden Verfahren erfolgreich angewendet werden können, um die Pilzbesiedlung von Samen, Protocormen und Keimlingen im Keimprozess zu analysieren.
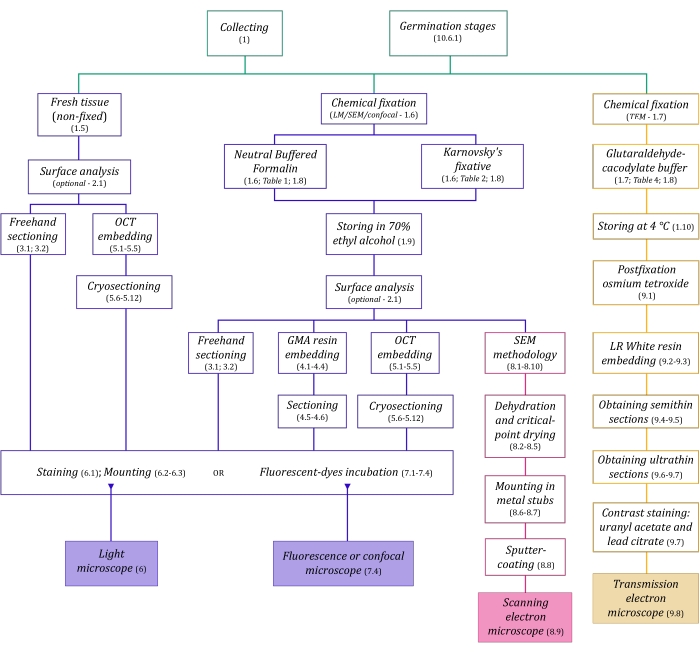
Abbildung 1: Schematische Zusammenfassung bildgebender Verfahren. Die Schaltpläne geben Hinweise auf Protokollschritte, in denen sie detailliert sind. Abkürzungen: GMA = Glykolmethacrylat, OCT = optimale Schnitttemperaturverbindung, REM = Rasterelektronenmikroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Den hier im Detail beschriebenen Mikroskopietechniken (Abbildung 1) gehen folgende wesentliche Schritte voraus: Sammeln, Fixieren, Dehydrieren, Einbetten und Schneiden von Proben. Da die Schritte je nach gewählter Technik(en) unterschiedlich sind (Abbildung 1), ist es wichtig, vorausschauend zu denken und zu berücksichtigen, welche Fixiermittel vorbereitet und zur Sammelstelle transportiert werden sollen, wie die Proben vor der Fixierung vorbereitet werden müssen, welche Dehydratisierungsverfahren anzuwenden sind (Abschnitt 1) und welche Möglichkeiten und Schnittmethoden es gibt (Abschnitte 4, 5, und 9). Abbildung 1 fasst nacheinander alle Schritte zusammen, die für jede unten beschriebene Mikroskopietechnik erforderlich sind.
Protocol
Representative Results
Discussion
Bildanalysen in der Pflanzenanatomie und -morphologie haben ein wichtiges Potenzial, Ziele zu erreichen und zum Verständnis der Beziehungen zwischen mykoheterotrophen Pflanzen und ihren unverzichtbaren Pilzendophyten beizutragen, wie Untersuchungen unterirdischer Organe6,40, Strukturanalysen der symbiotischen Keimung von Samen39 sowie Luft- und Fortpflanzungsstrukturen 41 zeigen. . Obwohl die strukturelle Botanik i…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken der Finanzierung durch FAEPEX und FAPESP (2015/26479-6). MPP dankt Capes für sein Masterstipendium (Prozess 88887.600591/2021-00) und CNPq. JLSM dankt CNPq für Produktivitätszuschüsse (303664/2020-7). Die Autoren danken auch dem Zugang zu Ausrüstung und Unterstützung durch LME (Laboratory of Electron Microscopy – IB / Unicamp), INFABiC (National Institute of Science and Technology on Photonics Applied to Cell Biology – Unicamp) und LaBiVasc (Laboratory of Vascular Biology – DBEF / IB / Unicamp); LAMEB (UFSC) und Eliana de Medeiros Oliveira (UFSC) für Beiträge zum Kryoprotektionsprotokoll; LME für Beiträge zum TEM-Protokoll.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

