माइकोहेटरोट्रॉफिक पौधों के ऊतकों और बीजों के सहजीवी अंकुरण में फंगल उपनिवेशीकरण की व्याख्या के लिए माइक्रोस्कोपी तकनीक
Summary
इस प्रोटोकॉल का उद्देश्य माइकोहेटरोट्रॉफिक पौधों के नमूनों को इकट्ठा करने, ठीक करने और बनाए रखने के लिए विस्तृत प्रक्रियाएं प्रदान करना है, विभिन्न माइक्रोस्कोपी तकनीकों जैसे स्कैनिंग और ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी, प्रकाश, कंफोकल और प्रतिदीप्ति माइक्रोस्कोपी को लागू करना ताकि माइकोराइजल कवक के साथ अंकुरित पौधों के ऊतकों और बीजों में कवक उपनिवेशीकरण का अध्ययन किया जा सके।
Abstract
संरचनात्मक वनस्पति विज्ञान पौधों की पारिस्थितिकी, शरीर विज्ञान, विकास और विकास को पूरी तरह से समझने के लिए एक अनिवार्य परिप्रेक्ष्य है। माइकोहेटरोट्रॉफिक पौधों (यानी, पौधे जो कवक से कार्बन प्राप्त करते हैं) पर शोध करते समय, उनके संरचनात्मक अनुकूलन के उल्लेखनीय पहलू, कवक द्वारा ऊतक उपनिवेशीकरण के पैटर्न, और भूमिगत अंगों की मॉर्फोनाटॉमी उनकी विकास रणनीतियों और पोषक तत्वों के स्रोत हाइप के साथ उनके संबंधों को प्रबुद्ध कर सकती है। सहजीवी कवक की एक और महत्वपूर्ण भूमिका ऑर्किड बीज के अंकुरण से संबंधित है; सभी ऑर्किडेसी प्रजातियां अंकुरण और अंकुरण चरण (प्रारंभिक माइकोहेटेरोट्रॉफी) के दौरान माइकोहेटरोट्रॉफिक हैं, यहां तक कि वे भी जो वयस्क चरणों में प्रकाश संश्लेषण करते हैं। ऑर्किड बीजों में पोषण भंडार की कमी के कारण, सब्सट्रेट प्रदान करने और अंकुरण को सक्षम करने के लिए फंगल सहजीवन आवश्यक हैं। संरचनात्मक दृष्टिकोण से अंकुरण चरणों का विश्लेषण भी बीज के साथ कवक बातचीत के बारे में महत्वपूर्ण सवालों के जवाब दे सकता है। पौधे के ऊतकों में कवक एंडोफाइट्स का अनावरण करने के लिए विभिन्न इमेजिंग तकनीकों को लागू किया जा सकता है, जैसा कि इस लेख में प्रस्तावित है। पौधे के अंगों के फ्रीहैंड और पतले वर्गों को दाग दिया जा सकता है और फिर प्रकाश माइक्रोस्कोपी का उपयोग करके देखा जा सकता है। गेहूं के रोगाणु एग्लूटिनिन के लिए संयुग्मित एक फ्लोरोक्रोम को कवक पर लागू किया जा सकता है और कॉन्फोकल माइक्रोस्कोपी में पौधे की कोशिका की दीवारों को उजागर करने के लिए कैल्कोफ्लोर व्हाइट के साथ सह-ऊष्मायन किया जा सकता है। इसके अलावा, स्कैनिंग और ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी की पद्धतियों को माइकोहेटरोट्रॉफिक ऑर्किड के लिए विस्तृत किया गया है, और संबंधित पौधों में इस तरह के प्रोटोकॉल को लागू करने की संभावनाओं का पता लगाया गया है। आर्किड बीजों के सहजीवी अंकुरण (यानी, माइकोराइजल कवक की उपस्थिति में) को प्रोटोकॉल में विस्तार से वर्णित किया गया है, साथ ही प्रकाश, कॉन्फोकल और इलेक्ट्रॉन माइक्रोस्कोपी के साथ विश्लेषण के लिए अंकुरण के विभिन्न चरणों से प्राप्त संरचनाओं को तैयार करने की संभावनाओं के साथ।
Introduction
वनस्पति विज्ञान में संरचनात्मक अनुसंधान, पौधे की आकृति विज्ञान और शरीर रचना विज्ञान को कवर करते हुए, पूरे जीव 1,2 को समझने में बुनियादी है, और पौधों के पारिस्थितिकी, शरीर विज्ञान, विकास और विकास के बारे में ज्ञान को एकीकृत करने और योगदान करने के लिए अपरिहार्य दृष्टिकोण प्रदान करताहै 3. पौधे की आकृति विज्ञान और शरीर रचना विज्ञान में विधियों में वर्तमान में प्रोटोकॉल, उपकरण और ज्ञान शामिल हैं जो हाल ही में विकसित हुए हैं और साथ ही एक सदी से अधिक समय पहले2. शास्त्रीय तरीकों (जैसे, प्रकाश माइक्रोस्कोपी) के निरंतर निष्पादन और अनुकूलन के साथ-साथ हाल की तकनीकों (जैसे, कॉन्फोकल माइक्रोस्कोपी, एक्स-रे माइक्रोटोमोग्राफी) का एक ही आवश्यक आधार है: सैद्धांतिक ज्ञान एक पद्धति के विकास को सक्षम करता है।
पौधे शरीर रचना विज्ञान और आकृति विज्ञान में मुख्य उपकरण छवि है। गलत धारणा के बावजूद कि इस तरह के विश्लेषण सरल टिप्पणियां हैं, व्यक्तिपरक व्याख्याओंको जगह देते हैं 2, इस क्षेत्र में छवियों का विश्लेषण और समझने के लिए लागू विधियों (उपकरण, विश्लेषण के प्रकार, पद्धतिगत प्रक्रियाओं), सेल घटकों, हिस्टोकेमिस्ट्री और पौधे के शरीर (ऊतक संगठन और कार्य, ऑन्टोजेनी, रूपात्मक अनुकूलन) के ज्ञान की आवश्यकता होती है। विभिन्न तरीकों से प्राप्त छवियों की व्याख्या करने से रूप और कार्य को सहसंबंधित किया जा सकता है, एक संरचना की रासायनिक संरचना को समझना, कर का वर्णन करने में पुष्टि करना, फाइटोपैथोजेन द्वारा संक्रमण को समझना और इस तरह के अन्य आकलन।
माइकोहेटरोट्रॉफिक (एमएच) पौधों (यानी, गैर-प्रकाश संश्लेषक पौधे जो माइकोराइजल कवक 4,5 से कार्बन प्राप्त करते हैं) पर शोध करते समय, उनके संरचनात्मक अनुकूलन के उल्लेखनीय पहलू, कवक द्वारा ऊतक उपनिवेशीकरण के पैटर्न, और भूमिगत अंगों की मॉर्फोएनाटॉमी उनकी विकास रणनीतियों और हाइप के साथ संबंधों को प्रबुद्ध कर सकती है, जो पोषक तत्वों का स्रोत हैं। एमएच पौधों के भूमिगत अंग आमतौर पर मिट्टी के कवक के साथ उनके सहयोग से संबंधित महत्वपूर्ण अनुकूलन दिखाते हैं, इसलिए इन शारीरिक और रूपात्मक जांच करना आवश्यक है6. एमएच प्रजातियों के हवाई अंगों को नजरअंदाज नहीं किया जाना चाहिए, क्योंकि एंडोफाइट्स इन ऊतकों में भी मौजूद हो सकते हैं, भले ही वे माइकोराइजल कवक (व्यक्तिगत टिप्पणियां, अभी तक प्रकाशित नहीं हुई हैं)।
अपने पूरे जीवन चक्र 7 के दौरान एमएच प्रजातियों के साथ माइकोराइजल कवक सहयोग की अच्छी तरह से स्थापित अनिवार्यताके अलावा, प्रत्येक ऑर्किड प्रजातियों, यहां तक कि ऑटोट्रॉफिक वाले, प्राकृतिक वातावरण में एक प्रारंभिक बाध्यकारी माइकोहेटेरोट्रोफिक चरण है। ऐसा इसलिए होता है क्योंकि ऑर्किड का भ्रूण उदासीन होता है और इसमें एंडोस्पर्म या कोटिलेडोन की कमी होती है, इस प्रकार फंगल भागीदारों 4,8 के पोषण संबंधी समर्थन के बिना प्राकृतिक वातावरण में खुद को विकसित करने और स्थापित करने में असमर्थ होता है। यह देखते हुए कि, सहजीवी अंकुरण प्रोटोकॉल को न केवल एमएच प्रजातियों पर लागू किया जा सकता है, बल्कि प्रकाश संश्लेषण ऑर्किड के लिए भी लागू किया जा सकता है, जिसका उद्देश्य अंकुरण और प्रोटोकॉर्म विकास में ऑर्किड-कवक विशिष्टता की जांच करना है, खतरे वाली प्रजातियों 9,10,11 के संरक्षण के लिए पहल में एक बेहद लागू पद्धति।
इस विधि असेंबली में, हम शारीरिक अध्ययन (धारा 1), सतह विश्लेषण और नमूना चयन (धारा 2), सेक्शनिंग विधियों (फ्रीहैंड: अनुभाग 3, माइक्रोटॉमी: धारा 4, क्रायोमाइक्रोटॉमी: धारा 5), धुंधला और बढ़ते (धारा 6), प्रतिदीप्ति और फंगल एंडोफाइट्स (धारा 7) के कंफोकल माइक्रोस्कोपी, स्कैनिंग इलेक्ट्रॉन माइक्रोस्कोपी (धारा 8) के लिए एमएच पौधे के नमूनों को इकट्ठा करने, ठीक करने और संग्रहीत करने में शामिल महत्वपूर्ण चरणों का वर्णन करते हैं और ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी (धारा 9)। इसके अतिरिक्त, हम ऑर्किड बीज (एमएच और ऑटोट्रॉफिक, धारा 10) के लिए एक सहजीवी अंकुरण विधि का वर्णन करते हैं, क्योंकि पहले उल्लिखित इमेजिंग विधियों को अंकुरण प्रक्रिया में बीज, प्रोटोकॉर्म और रोपाई के कवक उपनिवेशीकरण का विश्लेषण करने के लिए सफलतापूर्वक लागू किया जा सकता है।
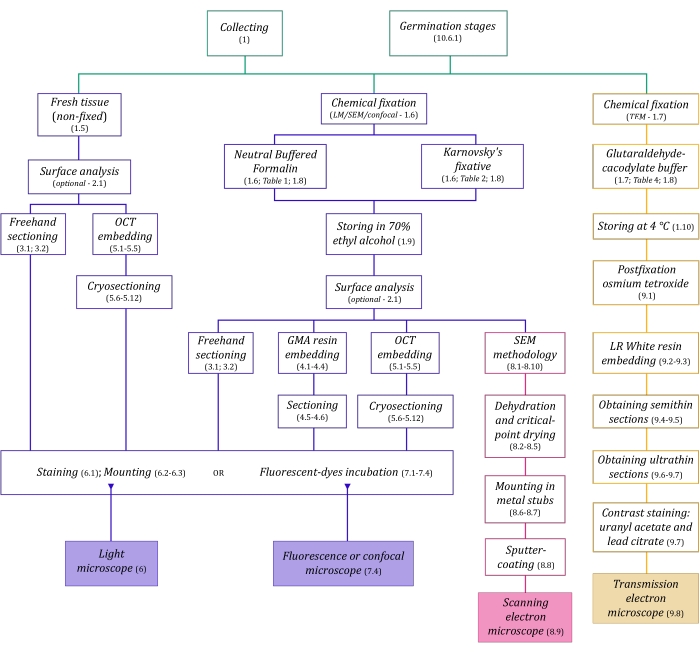
चित्रा 1: इमेजिंग विधियों का योजनाबद्ध सारांश। योजनाबद्ध प्रोटोकॉल चरणों के संकेत प्रदान करते हैं जिसमें वे विस्तृत हैं। संक्षिप्त नाम: जीएमए = ग्लाइकोल मेथैक्रिलेट, ओसीटी = इष्टतम काटने का तापमान यौगिक, एसईएम = स्कैनिंग इलेक्ट्रॉन माइक्रोस्कोपी। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
विस्तार से यहां वर्णित माइक्रोस्कोपी तकनीक (चित्रा 1) निम्नलिखित आवश्यक चरणों से पहले हैं: नमूने एकत्र करना, फिक्सिंग, निर्जलीकरण, एम्बेडिंग और सेक्शनिंग नमूने। चूंकि चरण चुने हुए तकनीक (ओं) के आधार पर चर (चित्रा 1) हैं, इसलिए आगे सोचना महत्वपूर्ण है, फिक्सेटिव तैयार करने और संग्रह साइट पर ले जाने के लिए, फिक्सिंग से पहले नमूने कैसे तैयार किए जाने चाहिए, निर्जलीकरण प्रक्रियाओं का उपयोग किया जाना चाहिए (अनुभाग 1), और विभिन्न एम्बेडिंग संभावनाएं और सेक्शनिंग विधियां (अनुभाग 4, 5, और 9)। चित्रा 1 नीचे वर्णित प्रत्येक माइक्रोस्कोपी तकनीक के लिए आवश्यक सभी चरणों को क्रमिक रूप से सारांशित करता है।
Protocol
Representative Results
Discussion
पादप शरीर रचना विज्ञान और आकृति विज्ञान में छवि विश्लेषण में उद्देश्यों को पूरा करने और माइकोहेटेरोट्रोफिक पौधों और उनके अपरिहार्य कवक एंडोफाइट्स के बीच संबंधों को समझने में मदद करने की एक महत्वपूर?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
लेखक एफएईपीईएक्स और एफएपीईएसपी (2015/26479-6) से धन का धन्यवाद करते हैं। एमपीपी ने अपनी मास्टर डिग्री छात्रवृत्ति (प्रक्रिया 88887.600591/2021-00) और सीएनपीक्यू जीएलएसएम उत्पादकता अनुदान (303664 / 2020-7) के लिए सीएनपीक्यू धन्यवाद के लिए कैप्स को धन्यवाद दिया। लेखक एलएमई (इलेक्ट्रॉन माइक्रोस्कोपी की प्रयोगशाला – आईबी / यूनिकैम्प), आईएनएफएबीआईसी (नेशनल इंस्टीट्यूट ऑफ साइंस एंड टेक्नोलॉजी ऑन फोटोनिक्स एप्लाइड टू सेल बायोलॉजी – यूनिकैम्प), और लाबीवास्क (संवहनी जीवविज्ञान की प्रयोगशाला – डीबीईएफ / आईबी / यूनिकैम्प) द्वारा प्रदान किए गए उपकरणों और सहायता तक पहुंच का भी धन्यवाद करते हैं; क्रायोप्रोटेक्शन प्रोटोकॉल में योगदान के लिए एलएएमईबी (यूएफएससी) और एलियाना डी मेडिरोस ओलिवेरा (यूएफएससी); टीईएम प्रोटोकॉल में योगदान के लिए एलएमई।
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

