Tecniche di microscopia per l'interpretazione della colonizzazione fungina nei tessuti delle piante micoeterotrofiche e della germinazione simbiotica dei semi
Summary
Questo protocollo mira a fornire procedure dettagliate per la raccolta, la fissazione e il mantenimento di campioni di piante micoeterotrofiche, applicando diverse tecniche di microscopia come la microscopia elettronica a scansione e trasmissione, la microscopia ottica, confocale e a fluorescenza per studiare la colonizzazione fungina nei tessuti delle piante e nei semi germinati con funghi micorrizici.
Abstract
La botanica strutturale è una prospettiva indispensabile per comprendere appieno l’ecologia, la fisiologia, lo sviluppo e l’evoluzione delle piante. Quando si studiano piante micoeterotrofiche (cioè piante che ottengono carbonio dai funghi), aspetti notevoli dei loro adattamenti strutturali, i modelli di colonizzazione dei tessuti da parte dei funghi e la morfoanatomia degli organi sotterranei possono illuminare le loro strategie di sviluppo e le loro relazioni con le ife, la fonte di nutrienti. Un altro ruolo importante dei funghi simbionti è legato alla germinazione dei semi di orchidea; tutte le specie di Orchidaceae sono micoeterotrofiche durante la germinazione e la fase di semina (micoeterotrofia iniziale), anche quelle che fotosintetizzano negli stadi adulti. A causa della mancanza di riserve nutrizionali nei semi di orchidee, i simbionti fungini sono essenziali per fornire substrati e consentire la germinazione. L’analisi delle fasi di germinazione da prospettive strutturali può anche rispondere a domande importanti riguardanti l’interazione dei funghi con i semi. Diverse tecniche di imaging possono essere applicate per svelare gli endofiti dei funghi nei tessuti vegetali, come proposto in questo articolo. Le sezioni a mano libera e sottili degli organi vegetali possono essere colorate e quindi osservate con microscopia ottica. Un fluorocromo coniugato all’agglutinina del germe di grano può essere applicato ai funghi e co-incubato con Calcofluor White per evidenziare le pareti cellulari delle piante in microscopia confocale. Inoltre, le metodologie di scansione e microscopia elettronica a trasmissione sono dettagliate per orchidee micoeterotrofe e vengono esplorate le possibilità di applicare tali protocolli in piante correlate. La germinazione simbiotica dei semi di orchidea (cioè in presenza di funghi micorrizici) è descritta nel protocollo in dettaglio, insieme alle possibilità di preparare le strutture ottenute da diversi stadi di germinazione per analisi con microscopia ottica, confocale ed elettronica.
Introduction
La ricerca strutturale in botanica, che copre la morfologia e l’anatomia delle piante, è fondamentale per comprendere l’intero organismo1,2 e fornisce prospettive indispensabili per integrare e contribuire alla conoscenza riguardante l’ecologia, la fisiologia, lo sviluppo e l’evoluzione delle piante3. I metodi in morfologia e anatomia vegetale comprendono attualmente protocolli, attrezzature e conoscenze sviluppate di recente e più di un secolo fa2. L’esecuzione e l’adattamento continui di metodi classici (ad esempio, microscopia ottica) insieme a tecniche più recenti (ad esempio, microscopia confocale, microtomografia a raggi X) hanno la stessa base essenziale: conoscenze teoriche che consentono lo sviluppo di una metodologia.
Lo strumento principale nell’anatomia e nella morfologia delle piante è l’immagine. Nonostante l’idea errata che tali analisi siano semplici osservazioni, dando spazio a interpretazioni soggettive2, l’analisi e la comprensione delle immagini in quest’area richiede la conoscenza dei metodi applicati (l’attrezzatura, il tipo di analisi, le procedure metodologiche), i componenti cellulari, l’istochimica e il corpo vegetale (organizzazione e funzione dei tessuti, ontogenesi, adattamenti morfologici). L’interpretazione delle immagini ottenute attraverso una varietà di metodi può portare a correlare forma e funzione, decifrare la composizione chimica di una struttura, corroborare nella descrizione dei taxa, comprendere le infezioni da fitopatogeni e altre valutazioni simili.
Quando si studiano piante micoeterotrofe (MH) (cioè piante non fotosintetiche che ottengono carbonio dai funghi micorrizici4,5), aspetti notevoli dei loro adattamenti strutturali, i modelli di colonizzazione dei tessuti da parte dei funghi e la morfoanatomia degli organi sotterranei possono illuminare le loro strategie di sviluppo e le relazioni con le ife, che sono la fonte di nutrienti. Gli organi sotterranei delle piante MH di solito mostrano importanti adattamenti legati alla loro associazione con i funghi del suolo, quindi è essenziale eseguire queste indagini anatomiche e morfologiche6. Gli organi aerei delle specie MH non devono essere ignorati, poiché gli endofiti possono essere presenti anche in questi tessuti, anche se non sono funghi micorrizici (osservazioni personali, non ancora pubblicate).
Oltre alla consolidata essenzialità dell’associazione dei funghi micorrizici con le specie MH durante il loro intero ciclo vitale7, ogni specie di orchidea, anche quelle autotrofe, ha un primo stadio micoeterotrofico obbligato in ambienti naturali. Si verifica perché l’embrione delle orchidee è indifferenziato e manca di un endosperma o di cotiledoni, essendo quindi incapace di svilupparsi e stabilirsi in ambienti naturali senza il supporto nutrizionale di partner fungini 4,8. Considerando che, i protocolli di germinazione simbiotica possono essere applicati non solo alle specie MH ma anche alle orchidee fotosintetizzanti, con l’obiettivo di indagare la specificità orchidea-fungo nella germinazione e nello sviluppo del protocormo, una metodologia ampiamente applicata nelle iniziative per la conservazione delle specie minacciate 9,10,11.
In questo assemblaggio di metodi, descriviamo importanti passaggi coinvolti nella raccolta, fissazione e conservazione di campioni di piante MH per studi anatomici (sezione 1), analisi superficiale e selezione dei campioni (sezione 2), metodi di sezionamento (mano libera: sezione 3, microtomia: sezione 4, criomicrotomia: sezione 5), colorazione e montaggio (sezione 6), fluorescenza e microscopia confocale di endofiti fungini (sezione 7), microscopia elettronica a scansione (sezione 8), e microscopia elettronica a trasmissione (sezione 9). Inoltre, descriviamo un metodo di germinazione simbiotica per i semi di orchidea (MH e autotrofico, sezione 10), poiché i metodi di imaging precedentemente menzionati possono essere applicati con successo per analizzare la colonizzazione fungina di semi, protocormi e piantine nel processo di germinazione.
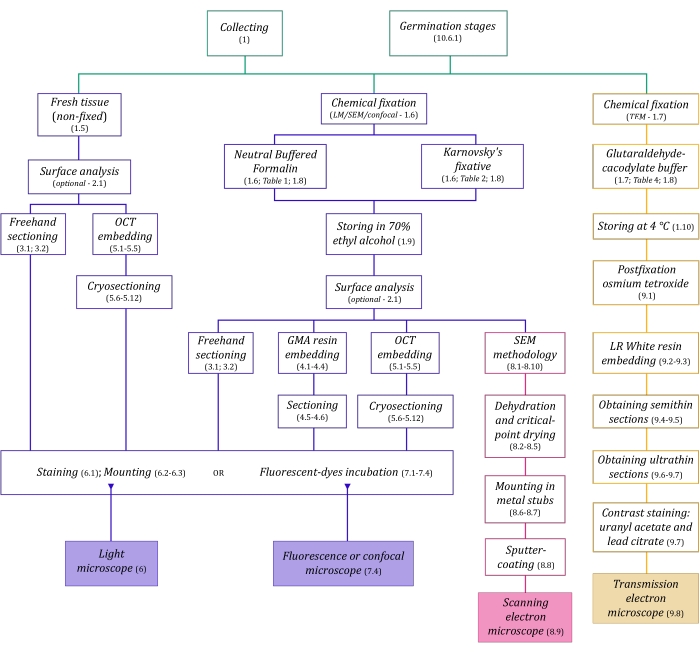
Figura 1: Riepilogo schematico dei metodi di imaging. Gli schemi forniscono indicazioni sui passaggi del protocollo in cui sono dettagliati. Abbreviazioni: GMA = glicole metacrilato, OCT = composto con temperatura di taglio ottimale, SEM = microscopia elettronica a scansione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Le tecniche di microscopia qui descritte in dettaglio (Figura 1) sono precedute dalle seguenti fasi essenziali: raccolta, fissaggio, disidratazione, incorporamento e sezionamento dei campioni. Poiché le fasi sono variabili (Figura 1) a seconda della tecnica o delle tecniche scelte, è importante pensare in anticipo, considerando i fissativi da preparare e trasportare al sito di raccolta, come i campioni devono essere preparati prima del fissaggio, i processi di disidratazione da utilizzare (sezione 1) e le diverse possibilità di incorporamento e metodi di sezionamento (sezioni 4, 5, e 9). La Figura 1 riassume sequenzialmente tutti i passaggi necessari per ciascuna tecnica di microscopia descritti dettagliatamente di seguito.
Protocol
Representative Results
Discussion
Le analisi delle immagini nell’anatomia e morfologia delle piante hanno un importante potenziale per raggiungere gli obiettivi e aiutare a comprendere le relazioni tra le piante micoeterotrofe e i loro indispensabili endofiti fungini, come dimostrato dagli studi sugli organi sotterranei6,40, dalle analisi strutturali della germinazione simbiotica dei semi39 e dalle strutture aeree e riproduttive 41 . La botanica str…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori ringraziano i finanziamenti di FAEPEX e FAPESP (2015/26479-6). MPP ringrazia Capes per la sua borsa di studio di master (processo 88887.600591/2021-00) e CNPq. JLSM ringrazia CNPq per le sovvenzioni di produttività (303664/2020-7). Gli autori ringraziano anche l’accesso alle attrezzature e all’assistenza fornita da LME (Laboratorio di Microscopia Elettronica – IB/Unicamp), INFABiC (Istituto Nazionale di Scienza e Tecnologia sulla Fotonica Applicata alla Biologia Cellulare – Unicamp), e LaBiVasc (Laboratorio di Biologia Vascolare – DBEF/IB/Unicamp); LAMEB (UFSC) e Eliana de Medeiros Oliveira (UFSC) per i contributi al protocollo di crioprotezione; LME per contributi al protocollo TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

