균종속영양 식물 조직의 곰팡이 집락화 및 종자의 공생 발아를 해석하기 위한 현미경 기술
Summary
이 프로토콜은 균근 진균으로 발아된 식물 조직 및 종자에서 진균 집락을 연구하기 위해 주사 및 투과 전자 현미경, 빛, 공초점 및 형광 현미경과 같은 다양한 현미경 기술을 적용하여 진균종속영양 식물 샘플을 수집, 고정 및 유지하기 위한 자세한 절차를 제공하는 것을 목표로 합니다.
Abstract
구조 식물학은 식물의 생태, 생리학, 발달 및 진화를 완전히 이해하는 데 없어서는 안될 관점입니다. 진균 종속 영양 식물 (즉, 곰팡이에서 탄소를 얻는 식물)을 연구 할 때 구조적 적응의 놀라운 측면, 곰팡이에 의한 조직 식민지화 패턴 및 지하 기관의 형태 해부학은 발달 전략과 영양소 공급원 인 균사와의 관계를 계몽 할 수 있습니다. 공생 균류의 또 다른 중요한 역할은 난초 씨앗의 발아와 관련이 있습니다. 모든 난초과과 종은 발아 및 묘목 단계(초기 진균이영양)에서 진균종속영양성이며 심지어 성체기에서 광합성을 하는 종도 있습니다. 난초 씨앗에 영양 매장량이 부족하기 때문에 곰팡이 공생체는 기질을 제공하고 발아를 가능하게하는 데 필수적입니다. 구조적 관점에서 발아 단계를 분석하면 곰팡이와 씨앗의 상호 작용에 관한 중요한 질문에 답할 수 있습니다. 이 기사에서 제안한 것처럼 식물 조직에서 곰팡이 내생식물을 밝히기 위해 다양한 이미징 기술을 적용할 수 있습니다. 식물 장기의 자유형 및 얇은 부분을 염색 한 다음 광학 현미경을 사용하여 관찰 할 수 있습니다. 밀 배아 응집소에 접합 된 형광 색소를 곰팡이에 적용하고 Calcofluor White와 함께 배양하여 컨포칼 현미경에서 식물 세포벽을 강조 표시 할 수 있습니다. 또한, 주사 및 투과 전자 현미경의 방법론은 mycoheterotrophic 난초에 대해 자세히 설명되어 있으며, 관련 식물에 이러한 프로토콜을 적용 할 가능성을 탐구합니다. 난초 종자의 공생 발아 (즉, 균근 진균이있는 경우)는 빛, 공초점 및 전자 현미경으로 분석하기 위해 발아의 여러 단계에서 얻은 구조를 준비 할 수있는 가능성과 함께 프로토콜에 자세히 설명되어 있습니다.
Introduction
식물 형태학 및 해부학을 다루는 식물학의 구조 연구는 전체 유기체를 이해하는 데 기본이며1,2, 식물의 생태, 생리학, 발달 및 진화에 관한 지식을 통합하고 기여하는 데 필수적인 관점을 제공합니다3. 식물 형태학 및 해부학의 방법은 현재 최근에 개발 된 프로토콜, 장비 및 지식뿐만 아니라 100 년 이상 전에 개발 된 것으로 구성됩니다2. 보다 최근의 기술(예: 컨포칼 현미경, X선 마이크로단층 촬영)과 함께 고전적인 방법(예: 광학 현미경)의 지속적인 실행 및 적응은 방법론 개발을 가능하게 하는 이론적 지식이라는 동일한 필수 기반을 가지고 있습니다.
식물 해부학 및 형태학의 주요 도구는 이미지입니다. 이러한 분석이 주관적인 해석에 공간을 제공하는 단순한 관찰이라는 오해에도불구하고2,이 영역의 이미지를 분석하고 이해하려면 적용된 방법 (장비, 분석 유형, 방법 론적 절차), 세포 구성 요소, 조직 화학 및 식물체 (조직 조직 및 기능, 개체 발생, 형태 학적 적응). 다양한 방법을 통해 얻은 이미지를 해석하면 형태와 기능을 상호 연관시키고, 구조의 화학적 구성을 해독하고, 분류군을 설명하고, 식물 병원체에 의한 감염을 이해하고, 기타 그러한 평가를 수행 할 수 있습니다.
균사 종속 영양 (MH) 식물 (즉, 균근 균류 4,5에서 탄소를 얻는 비 광합성 식물)을 연구 할 때 구조적 적응의 현저한 측면, 곰팡이에 의한 조직 식민지화 패턴 및 지하 기관의 형태 해부학은 개발 전략과 영양소의 원천 인균사와의 관계를 계몽 할 수 있습니다. MH 식물의 지하 기관은 일반적으로 토양 곰팡이와의 연관성과 관련된 중요한 적응을 보여 주므로 이러한 해부학 적 및 형태 학적 조사를 수행하는 것이 필수적입니다6. MH 종의 공중 기관은 균근 진균이 아니더라도 내생 식물이 이러한 조직에 존재할 수 있으므로 무시해서는 안됩니다 (개인 관찰, 아직 발표되지 않음).
전체 수명주기 동안 MH 종과 균근 진균 결합의 잘 확립 된 필수 성 외에도7, 모든 난초 종, 심지어 독립 영양 종조차도 자연 환경에서 초기 의무 진균 종속 영양 단계를 가지고 있습니다. 난초의 배아가 미분화되고 배젖이나 자엽이 없기 때문에 곰팡이 파트너 4,8의 영양 지원 없이는 자연 환경에서 발달하고 확립 할 수 없기 때문에 발생합니다. 이를 고려할 때, 공생 발아 프로토콜은 MH 종뿐만 아니라 광합성 난초에도 적용될 수 있으며, 발아 및 프로토 코름 발달에서 난초-곰팡이 특이성을 조사하는 것을 목표로하며, 멸종 위기 종 보존을위한 이니셔티브에 광범위하게 적용되는 방법론 9,10,11.
이 방법 어셈블리에서는 해부학 적 연구 (섹션 1), 표면 분석 및 샘플 선택 (섹션 2), 절편 방법 (자유형 : 섹션 3, 미세 절제술 : 섹션 4, 저온 미세 절제술 : 섹션 5), 염색 및 장착 (섹션 6), 곰팡이 내생 식물의 형광 및 공초점 현미경 (섹션 7), 주사 전자 현미경 (섹션 8), 및 투과 전자 현미경 (섹션 9). 또한 앞서 언급한 이미징 방법을 발아 과정에서 종자, 원생 및 묘목의 곰팡이 집락을 분석하는 데 성공적으로 적용할 수 있기 때문에 난초 종자(MH 및 독립 영양, 섹션 10)에 대한 공생 발아 방법을 설명합니다.
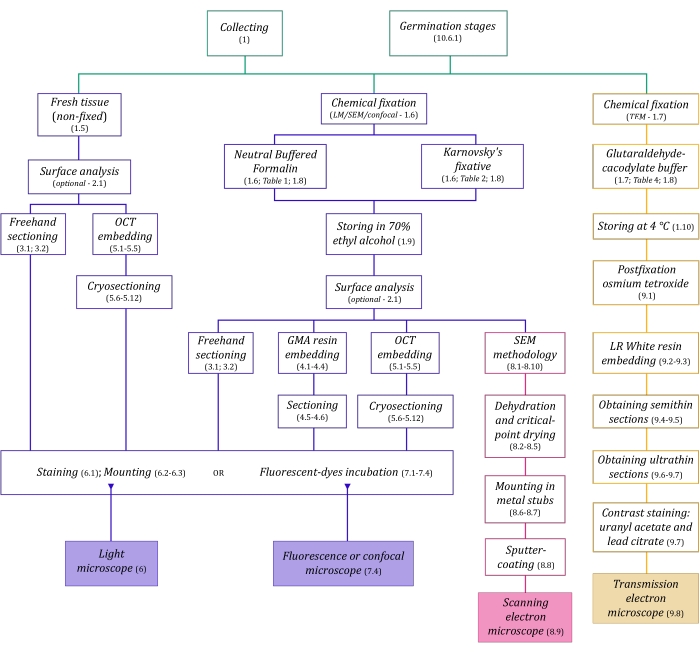
그림 1: 이미징 방법의 개략적 요약. 회로도는 자세히 설명된 프로토콜 단계의 표시를 제공합니다. 약어 : GMA = 글리콜 메타 크릴 레이트, OCT = 최적 절단 온도 화합물, SEM = 주사 전자 현미경. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기에 자세히 설명된 현미경 기술(그림 1)은 샘플 수집, 고정, 탈수, 매립 및 절편과 같은 필수 단계가 선행됩니다. 선택한 기술에 따라 단계가 다양하기 때문에(그림 1), 준비 및 수집 장소로 운송할 고정제, 고정 전에 샘플을 준비하는 방법, 사용할 탈수 공정(섹션 1), 다양한 매립 가능성 및 절단 방법(섹션 4, 5, 및 9). 그림 1 은 아래에 자세히 설명된 각 현미경 기술에 필요한 모든 단계를 순차적으로 요약한 것입니다.
Protocol
Representative Results
Discussion
식물 해부학 및 형태학의 이미지 분석은지하 기관6,40, 종자의 공생 발아에 대한 구조 분석39, 공중 및 생식 구조41에 의해 입증된 바와 같이 목표를 달성하고 진균종속영양 식물과 필수 진균 내생 식물 간의 관계를 이해하는 데 도움이 되는 중요한 잠재력을 가지고 있습니다. . 구조 식물학은 지난 10년 동안 식물 과학?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는 FAEPEX 및 FAPESP (2015/26479-6)의 자금 지원에 감사드립니다. MPP는 석사 학위 장학금(프로세스 88887.600591/2021-00)에 대해 Capes에게 감사를 표하고 CNPq. JLSM은 생산성 보조금(303664/2020-7)에 대해 CNPq에 감사드립니다. 저자는 또한 LME (전자 현미경 실험실 – IB / Unicamp), INFABiC (세포 생물학에 적용된 포토닉스에 관한 국립 과학 기술 연구소 – Unicamp) 및 LaBiVasc (혈관 생물학 실험실 – DBEF / IB / Unicamp); LAMEB (UFSC) 및 엘리아나 데 메데이로스 올리베이라 (UFSC) 냉동 보호 프로토콜에 대한 기여; TEM 프로토콜에 대한 기여에 대한 LME.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

