Mikroskopi teknikker for tolkning av soppkolonisering i mykoheterotrofe plantevev og symbiotisk spiring av frø
Summary
Denne protokollen tar sikte på å gi detaljerte prosedyrer for innsamling, fiksering og vedlikehold av mykoheterotrofe planteprøver, ved å bruke forskjellige mikroskopiteknikker som skanning og transmisjonselektronmikroskopi, lys, konfokal og fluorescensmikroskopi for å studere soppkolonisering i plantevev og frø spiret med mykorrhizal sopp.
Abstract
Strukturell botanikk er et uunnværlig perspektiv for å forstå økologi, fysiologi, utvikling og evolusjon av planter fullt ut. Når man forsker på mykoheterotrofe planter (dvs. planter som får karbon fra sopp), kan bemerkelsesverdige aspekter av deres strukturelle tilpasninger, mønstrene for vevkolonisering av sopp og morfoanatomien til underjordiske organer opplyse deres utviklingsstrategier og deres forhold til hyfer, kilden til næringsstoffer. En annen viktig rolle for symbiotiske sopp er relatert til spiring av orkidéfrø; alle Orchidaceae-arter er mykoheterotrofe under spiring og frøplantestadium (innledende mykoheterotrofi), selv de som fotosyntetiserer i voksne stadier. På grunn av mangel på næringsreserver i orkidéfrø, er soppsymbionter avgjørende for å gi substrater og muliggjøre spiring. Å analysere spiringsstadier ved strukturelle perspektiver kan også svare på viktige spørsmål angående soppens interaksjon med frøene. Ulike bildebehandlingsteknikker kan brukes til å avdekke soppendofytter i plantevev, som foreslått i denne artikkelen. Frihånd og tynne deler av planteorganer kan farges og deretter observeres ved hjelp av lysmikroskopi. En fluorokrom konjugert til hvetekimagglutinin kan påføres sopp og inkuberes med Calcofluor White for å markere plantecellevegger i konfokalmikroskopi. I tillegg er metodene for skanning og transmisjonselektronmikroskopi detaljert for mykoheterotrofe orkideer, og mulighetene for å anvende slike protokoller i relaterte planter blir utforsket. Symbiotisk spiring av orkidéfrø (dvs. i nærvær av mykorrhizal sopp) er beskrevet i protokollen i detalj, sammen med muligheter for å forberede strukturer oppnådd fra forskjellige stadier av spiring for analyser med lys, konfokal og elektronmikroskopi.
Introduction
Strukturforskning i botanikk, som dekker plantemorfologi og anatomi, er grunnleggende for å forstå hele organismen1,2, og gir uunnværlige perspektiver for å integrere og bidra til kunnskap om økologi, fysiologi, utvikling og evolusjon av planter3. Metoder i plantemorfologi og anatomi omfatter i dag protokoller, utstyr og kunnskap utviklet nylig så vel som for mer enn et århundre siden2. Den kontinuerlige utførelsen og tilpasningen av klassiske metoder (f.eks. Lysmikroskopi) sammen med nyere teknikker (f.eks. Konfokalmikroskopi, røntgenmikrotomografi) har samme viktige grunnlag: teoretisk kunnskap som muliggjør utvikling av en metodikk.
Hovedverktøyet i planteanatomi og morfologi er bildet. Til tross for misforståelsen om at slike analyser er enkle observasjoner, gir plass til subjektive tolkninger2, krever analyse og forståelse av bilder på dette området kunnskap om metodene som brukes (utstyret, type analyse, metodologiske prosedyrer), cellekomponenter, histokjemi og plantekroppen (vevsorganisasjon og funksjon, ontogeni, morfologiske tilpasninger). Tolkning av bildene oppnådd ved hjelp av en rekke metoder kan føre til korrelerende form og funksjon, dechiffrere den kjemiske sammensetningen av en struktur, bekrefte i å beskrive taxa, forstå infeksjoner av fytopatogener og andre slike vurderinger.
Når man forsker på mykoheterotrofe (MH) planter (dvs. ikke-fotosyntetiske planter som får karbon fra mykorrhizal sopp4,5), kan bemerkelsesverdige aspekter av deres strukturelle tilpasninger, mønstrene for vevkolonisering av sopp og morfoanatomi av underjordiske organer opplyse deres utviklingsstrategier og forhold til hyfer, som er kilden til næringsstoffer. De underjordiske organene til MH-planter viser vanligvis viktige tilpasninger knyttet til deres tilknytning til jordsvamp, derfor er det viktig å utføre disse anatomiske og morfologiske undersøkelsene6. MH-arters luftorganer bør ikke ignoreres, da endofytter også kan være tilstede i disse vevene, selv om de ikke er mykorrhizale sopp (personlige observasjoner, ikke publisert ennå).
I tillegg til den veletablerte essensen av mykorrhizal soppforening med MH-arter i løpet av hele livssyklusen7, har hver orkidéart, selv de autotrofe, et innledende obligatorisk mykoheterotrofisk stadium i naturlige miljøer. Det oppstår fordi orkideenes embryo er utifferentiert og mangler endosperm eller cotyledoner, og dermed ikke er i stand til å utvikle og etablere seg i naturlige miljøer uten næringsstøtte fra sopppartnere 4,8. Tatt i betraktning at symbiotiske spiringsprotokoller kan brukes ikke bare på MH-arter, men også på fotosyntetiserende orkideer, med sikte på å undersøke orkidé-soppspesifisitet i spiring og protocormutvikling, en enormt anvendt metodikk i initiativer for bevaring av truede arter 9,10,11.
I denne metodesamlingen beskriver vi viktige trinn involvert i innsamling, fiksering og lagring av MH-planteprøver for anatomiske studier (seksjon 1), overflateanalyse og prøvevalg (seksjon 2), seksjoneringsmetoder (frihånd: seksjon 3, mikrotomi: seksjon 4, kryomikrotomi: seksjon 5), farging og montering (seksjon 6), fluorescens og konfokal mikroskopi av soppendofytter (seksjon 7), skanning elektronmikroskopi (seksjon 8), og transmisjonselektronmikroskopi (pkt. 9). I tillegg beskriver vi en symbiotisk spiringsmetode for orkidéfrø (MH og autotrofisk, seksjon 10), da de tidligere nevnte avbildningsmetodene med hell kan brukes til å analysere soppkolonisering av frø, protokormer og frøplanter i spiringsprosessen.
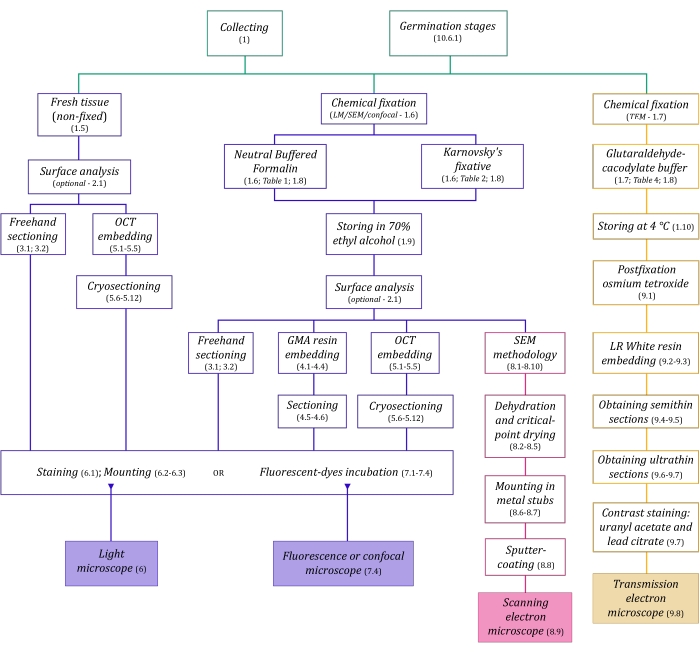
Figur 1: Skjematisk oppsummering av bildemetoder. Skjemaene gir indikasjoner på protokolltrinn der de er detaljerte. Forkortelser: GMA = glykolmetakrylat, OCT = optimal skjæretemperaturforbindelse, SEM = skanningelektronmikroskopi. Klikk her for å se en større versjon av dette tallet.
Mikroskopiteknikkene beskrevet her i detalj (figur 1) innledes av følgende viktige trinn: innsamling, festing, dehydrering, innebygging og seksjonering av prøver. Siden trinnene er variable (figur 1) avhengig av valgt(e) teknikk(er), er det viktig å tenke fremover, med tanke på fikseringsmidlene som skal klargjøres og transporteres til innsamlingsstedet, hvordan prøvene må klargjøres før fiksering, dehydreringsprosessene som skal brukes (avsnitt 1), og ulike innbyggingsmuligheter og snittingsmetoder (§§ 4, 5, og 9). Figur 1 oppsummerer sekvensielt alle trinnene som kreves for hver mikroskopiteknikk grundig beskrevet nedenfor.
Protocol
Representative Results
Discussion
Bildeanalyser i planteanatomi og morfologi har et viktig potensial for å oppfylle mål og bidra til å forstå forholdet mellom mykoheterotrofe planter og deres uunnværlige soppendofytter, som demonstrert ved studier av underjordiske organer 6,40, strukturelle analyser av symbiotisk spiring av frø39, og luft- og reproduktive strukturer 41 . Strukturell botanikk, til tross for å ha mistet sin prestisje og plass t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker finansiering fra FAEPEX og FAPESP (2015/26479-6). MPP takker Capes for hans mastergradsstipend (prosess 88887.600591/2021-00) og CNPq. JLSM takker CNPq for produktivitetstilskudd (303664/2020-7). Forfatterne takker også tilgangen til utstyr og assistanse fra LME (Laboratory of Electron Microscopy – IB / Unicamp), INFABiC (National Institute of Science and Technology on Photonics Applied to Cell Biology – Unicamp) og LaBiVasc (Laboratory of Vascular Biology – DBEF / IB / Unicamp); LAMEB (UFSC) og Eliana de Medeiros Oliveira (UFSC) for bidrag til kryobeskyttelsesprotokollen; LME for bidrag til TEM-protokollen.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

