Técnicas de microscopía para interpretar la colonización fúngica en tejidos de plantas micoheterótrofas y germinación simbiótica de semillas
Summary
Este protocolo tiene como objetivo proporcionar procedimientos detallados para recolectar, fijar y mantener muestras de plantas micoheterótrofas, aplicando diferentes técnicas de microscopía como microscopía electrónica de barrido y transmisión, microscopía de luz, confocal y fluorescencia para estudiar la colonización fúngica en tejidos vegetales y semillas germinadas con hongos micorrícicos.
Abstract
La botánica estructural es una perspectiva indispensable para comprender completamente la ecología, la fisiología, el desarrollo y la evolución de las plantas. Al investigar plantas micoheterótrofas (es decir, plantas que obtienen carbono de hongos), aspectos notables de sus adaptaciones estructurales, los patrones de colonización tisular por hongos y la morfoanatomía de los órganos subterráneos pueden iluminar sus estrategias de desarrollo y sus relaciones con las hifas, la fuente de nutrientes. Otro papel importante de los hongos simbióticos está relacionado con la germinación de las semillas de orquídeas; todas las especies de Orchidaceae son micoheterótrofas durante la germinación y la etapa de plántula (micoheterotrofia inicial), incluso las que fotosintetizan en etapas adultas. Debido a la falta de reservas nutricionales en las semillas de orquídeas, los simbiontes fúngicos son esenciales para proporcionar sustratos y permitir la germinación. El análisis de las etapas de germinación desde perspectivas estructurales también puede responder preguntas importantes sobre la interacción de los hongos con las semillas. Se pueden aplicar diferentes técnicas de imagen para revelar hongos endófitos en tejidos vegetales, como se propone en este artículo. Las secciones a mano alzada y delgadas de los órganos de la planta se pueden teñir y luego observar mediante microscopía óptica. Un fluorocromo conjugado con aglutinina de germen de trigo se puede aplicar a los hongos y co-incubar con Calcofluor White para resaltar las paredes celulares de las plantas en microscopía confocal. Además, se detallan las metodologías de microscopía electrónica de barrido y transmisión para orquídeas micoheterótrofas, y se exploran las posibilidades de aplicar dichos protocolos en plantas relacionadas. La germinación simbiótica de semillas de orquídeas (es decir, en presencia de hongos micorrícicos) se describe en detalle en el protocolo, junto con las posibilidades de preparar las estructuras obtenidas de diferentes etapas de germinación para análisis con microscopía óptica, confocal y electrónica.
Introduction
La investigación estructural en botánica, que abarca la morfología y anatomía de las plantas, es básica para comprender todo el organismo1,2, y proporciona perspectivas indispensables para integrar y contribuir al conocimiento sobre la ecología, fisiología, desarrollo y evolución de las plantas3. Los métodos en morfología y anatomía vegetal actualmente comprenden protocolos, equipos y conocimientos desarrollados recientemente, así como hace más de un siglo2. La ejecución continua y la adaptación de métodos clásicos (por ejemplo, microscopía óptica) junto con técnicas más recientes (por ejemplo, microscopía confocal, microtomografía de rayos X) tienen la misma base esencial: conocimientos teóricos que permiten el desarrollo de una metodología.
La herramienta principal en anatomía y morfología vegetal es la imagen. A pesar de la idea errónea de que tales análisis son simples observaciones, dando espacio a interpretaciones subjetivas2, el análisis y la comprensión de las imágenes en esta área requieren el conocimiento de los métodos aplicados (el equipo, el tipo de análisis, los procedimientos metodológicos), los componentes celulares, la histoquímica y el cuerpo de la planta (organización y función del tejido, ontogenia, adaptaciones morfológicas). La interpretación de las imágenes obtenidas a través de una variedad de métodos puede conducir a correlacionar forma y función, descifrar la composición química de una estructura, corroborar la descripción de taxones, comprender las infecciones por fitopatógenos y otras evaluaciones similares.
Al investigar plantas micoheterótrofas (MH) (es decir, plantas no fotosintéticas que obtienen carbono de hongos micorrícicos4,5), aspectos notables de sus adaptaciones estructurales, los patrones de colonización tisular por hongos y la morfoanatomía de los órganos subterráneos pueden iluminar sus estrategias de desarrollo y relaciones con las hifas, que son la fuente de nutrientes. Los órganos subterráneos de las plantas MH suelen mostrar importantes adaptaciones relacionadas a su asociación con hongos del suelo, por lo que es esencial realizar estas investigaciones anatómicas y morfológicas6. Los órganos aéreos de las especies MH no deben ser ignorados, ya que los endófitos también pueden estar presentes en estos tejidos, incluso si no son hongos micorrícicos (observaciones personales, aún no publicadas).
Además de la esencialidad bien establecida de la asociación de hongos micorrícicos con especies MH durante todo su ciclo de vida7, todas las especies de orquídeas, incluso las autótrofas, tienen una etapa micoheterotrófica obligada inicial en ambientes naturales. Ocurre porque el embrión de las orquídeas es indiferenciado y carece de endospermo o cotiledones, siendo así incapaz de desarrollarse y establecerse en ambientes naturales sin el apoyo nutricional de socios fúngicos 4,8. Considerando eso, los protocolos de germinación simbiótica pueden ser aplicados no sólo a especies MH sino también a orquídeas fotosintéticas, con el objetivo de investigar la especificidad orquídea-hongo en germinación y desarrollo protocormo, una metodología ampliamente aplicada en iniciativas para la conservación de especies amenazadas 9,10,11.
En este ensamblaje de métodos, describimos pasos importantes involucrados en la recolección, fijación y almacenamiento de muestras de plantas MH para estudios anatómicos (sección 1), análisis de superficie y selección de muestras (sección 2), métodos de seccionamiento (a mano alzada: sección 3, microtomía: sección 4, criomicrotomía: sección 5), tinción y montaje (sección 6), fluorescencia y microscopía confocal de endófitos fúngicos (sección 7), microscopía electrónica de barrido (sección 8), y microscopía electrónica de transmisión (sección 9). Además, describimos un método de germinación simbiótica para semillas de orquídeas (MH y autótrofa, sección 10), ya que los métodos de imagen mencionados anteriormente se pueden aplicar con éxito para analizar la colonización fúngica de semillas, protocormos y plántulas en el proceso de germinación.
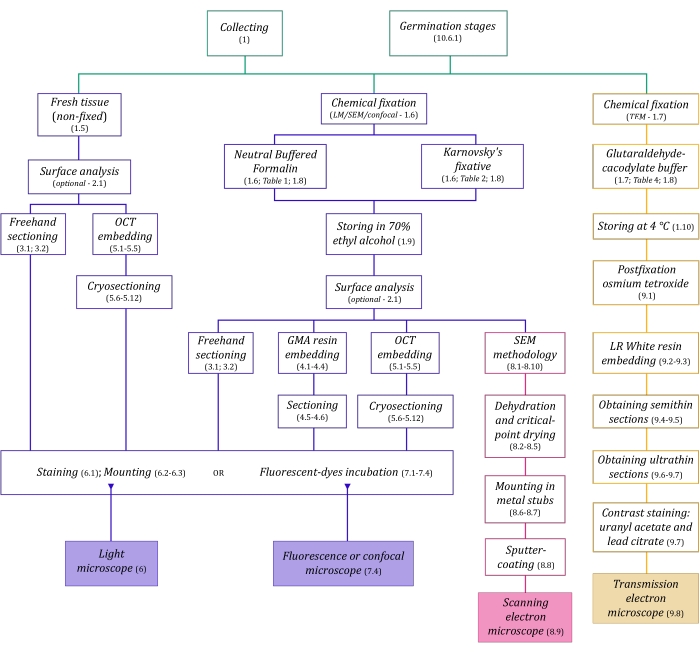
Figura 1: Resumen esquemático de los métodos de imagen. Los esquemas proporcionan indicaciones de los pasos del protocolo en los que se detallan. Abreviaturas: GMA = metacrilato de glicol, OCT = compuesto de temperatura de corte óptima, SEM = microscopía electrónica de barrido. Haga clic aquí para ver una versión más grande de esta figura.
Las técnicas de microscopía descritas aquí en detalle (Figura 1) están precedidas por los siguientes pasos esenciales: recolectar, fijar, deshidratar, incrustar y seccionar muestras. Como los pasos son variables (Figura 1) dependiendo de la(s) técnica(s) elegida(s), es importante pensar en el futuro, considerando los fijadores que se prepararán y transportarán al sitio de recolección, cómo se deben preparar las muestras antes de la fijación, los procesos de deshidratación que se utilizarán (sección 1) y las diferentes posibilidades de incrustación y métodos de seccionamiento (secciones 4, 5, y 9). La Figura 1 resume secuencialmente todos los pasos requeridos para cada técnica de microscopía que se describen a continuación.
Protocol
Representative Results
Discussion
Los análisis de imagen en anatomía y morfología vegetal tienen un potencial importante para cumplir objetivos y ayudar a comprender las relaciones entre las plantas micoheterótrofas y sus endófitos fúngicos indispensables, como lo demuestran los estudios de órganos subterráneos6,40, análisis estructurales de germinación simbiótica de semillas39 y estructuras aéreas y reproductivas 41 . La botánica estru…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores agradecen el financiamiento de FAEPEX y FAPESP (2015/26479-6). MPP agradece a Capes por su beca de maestría (proceso 88887.600591/2021-00) y CNPq. JLSM agradece al CNPq por las becas de productividad (303664/2020-7). Los autores también agradecen el acceso a equipos y asistencia proporcionados por LME (Laboratorio de Microscopía Electrónica – IB/Unicamp), INFABiC (Instituto Nacional de Ciencia y Tecnología sobre Fotónica Aplicada a la Biología Celular – Unicamp) y LaBiVasc (Laboratorio de Biología Vascular – DBEF/IB/Unicamp); LAMEB (UFSC) y Eliana de Medeiros Oliveira (UFSC) por contribuciones al protocolo de crioprotección; LME para contribuciones al protocolo TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

