Mikroskopitekniker för tolkning av svampkolonisering i mykoheterotrofa växtvävnader och symbiotisk spiring av frön
Summary
Detta protokoll syftar till att tillhandahålla detaljerade procedurer för insamling, fixering och underhåll av mykoheterotrofa växtprover, med tillämpning av olika mikroskopitekniker som skannings- och överföringselektronmikroskopi, ljus-, konfokal- och fluorescensmikroskopi för att studera svampkolonisering i växtvävnader och frön groddar med mykorrhizasvampar.
Abstract
Strukturell botanik är ett oumbärligt perspektiv för att fullt ut förstå växternas ekologi, fysiologi, utveckling och utveckling. När man undersöker mykoheterotrofa växter (dvs växter som får kol från svampar) kan anmärkningsvärda aspekter av deras strukturella anpassningar, mönstren för vävnadskolonisering av svampar och morfoanatomin hos underjordiska organ upplysa deras utvecklingsstrategier och deras relationer med hyfer, källan till näringsämnen. En annan viktig roll av symbiotiska svampar är relaterad till spiring av orkidéfrön; alla Orchidaceae-arter är mykoheterotrofa under groning och plantor (initial mykoheterotrofi), även de som fotosyntetiserar i vuxna stadier. På grund av bristen på näringsreserver i orkidéfrön är svampsymbionter viktiga för att ge substrat och möjliggöra spiring. Att analysera grobarhetsstadier med strukturella perspektiv kan också svara på viktiga frågor om svamparnas interaktion med fröna. Olika avbildningstekniker kan tillämpas för att avslöja svampendofyter i växtvävnader, som föreslås i denna artikel. Frihand och tunna delar av växtorgan kan färgas och sedan observeras med hjälp av ljusmikroskopi. En fluorokrom konjugerad till vetegroddar agglutinin kan appliceras på svamparna och inkuberas tillsammans med Calcofluor White för att markera växtcellväggar i konfokalmikroskopi. Dessutom beskrivs metoderna för skanning och överföringselektronmikroskopi för mykoheterotrofa orkidéer, och möjligheterna att tillämpa sådana protokoll i besläktade växter undersöks. Symbiotisk spiring av orkidéfrön (dvs i närvaro av mykorrhizasvampar) beskrivs i protokollet i detalj, tillsammans med möjligheter att förbereda strukturerna erhållna från olika stadier av spiring för analyser med ljus-, konfokal- och elektronmikroskopi.
Introduction
Strukturforskning inom botanik, som omfattar växtmorfologi och anatomi, är grundläggande för att förstå hela organismen1,2 och ger oumbärliga perspektiv för att integrera och bidra till kunskap om växters ekologi, fysiologi, utveckling och utveckling3. Metoder inom växtmorfologi och anatomi omfattar för närvarande protokoll, utrustning och kunskap som utvecklats nyligen såväl som för mer än ett sekel sedan2. Det kontinuerliga utförandet och anpassningen av klassiska metoder (t.ex. ljusmikroskopi) tillsammans med nyare tekniker (t.ex. konfokalmikroskopi, röntgenmikrotomografi) har samma väsentliga grund: teoretisk kunskap som möjliggör utveckling av en metod.
Huvudverktyget i växtanatomi och morfologi är bilden. Trots missuppfattningen att sådana analyser är enkla observationer, vilket ger utrymme för subjektiva tolkningar2, kräver analys och förståelse av bilder inom detta område kunskap om de metoder som tillämpas (utrustning, typ av analys, metodologiska förfaranden), cellkomponenter, histokemi och växtkroppen (vävnadsorganisation och funktion, ontogeni, morfologiska anpassningar). Tolkning av de bilder som erhållits via en mängd olika metoder kan leda till korrelerande form och funktion, dechiffrera den kemiska sammansättningen av en struktur, bekräfta i beskrivningen av taxa, förstå infektioner av fytopatogener och andra sådana bedömningar.
När man undersöker mykoheterotrofa (MH) växter (dvs. icke-fotosyntetiska växter som erhåller kol från mykorrhizasvampar4,5), kan anmärkningsvärda aspekter av deras strukturella anpassningar, mönstren för vävnadskolonisering av svampar och morfoanatomin hos underjordiska organ upplysa deras utvecklingsstrategier och relationer med hyfer, som är källan till näringsämnen. De underjordiska organen hos MH-växter visar vanligtvis viktiga anpassningar relaterade till deras förening med marksvampar, därför är det viktigt att utföra dessa anatomiska och morfologiska undersökningar6. MH-arters luftorgan bör inte ignoreras, eftersom endofyter också kan finnas i dessa vävnader, även om de inte är mykorrhizasvampar (personliga observationer, inte publicerade ännu).
Förutom den väletablerade väsentligheten hos mykorrhizasvampar som associeras med MH-arter under hela deras livscykel7, har varje orkidéart, även de autotrofa, ett initialt obligatoriskt mykoheterotrofiskt stadium i naturliga miljöer. Det uppstår eftersom orkidéernas embryo är odifferentierat och saknar endosperm eller kotyledoner, vilket är oförmöget att utveckla och etablera sig i naturliga miljöer utan näringsstöd från svamppartners 4,8. Med tanke på detta kan symbiotiska grobarhetsprotokoll tillämpas inte bara på MH-arter utan också på fotosyntetiserande orkidéer, som syftar till att undersöka orkidé-svampspecificitet vid grobarhet och protocormutveckling, en mycket tillämpad metod i initiativ för bevarande av hotade arter 9,10,11.
I denna metodsammansättning beskriver vi viktiga steg som är involverade i insamling, fixering och lagring av MH-växtprover för anatomiska studier (avsnitt 1), ytanalys och provval (avsnitt 2), sektionsmetoder (frihand: avsnitt 3, mikrotomi: avsnitt 4, kryomikrotomi: avsnitt 5), färgning och montering (avsnitt 6), fluorescens och konfokalmikroskopi av svampendofyter (avsnitt 7), svepelektronmikroskopi (avsnitt 8), och transmissionselektronmikroskopi (avsnitt 9). Dessutom beskriver vi en symbiotisk grobarhetsmetod för orkidéfrön (MH och autotrofisk, avsnitt 10), eftersom de tidigare nämnda avbildningsmetoderna framgångsrikt kan tillämpas för att analysera svampkolonisering av frön, protokormer och plantor i groningsprocessen.
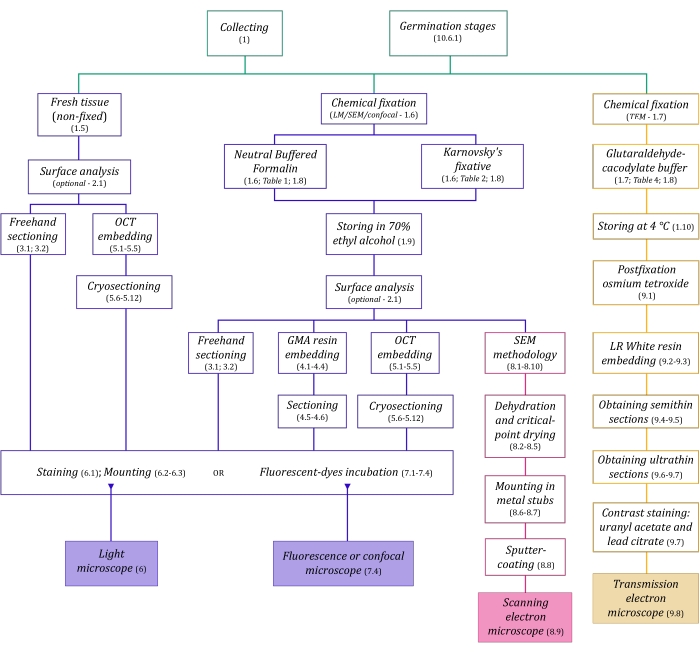
Figur 1: Schematisk sammanfattning av avbildningsmetoder. Scheman ger indikationer på protokollsteg där de är detaljerade. Förkortningar: GMA = glykolmetakrylat, OCT = optimal skärtemperaturförening, SEM = svepelektronmikroskopi. Klicka här för att se en större version av denna siffra.
De mikroskopitekniker som beskrivs här i detalj (figur 1) föregås av följande viktiga steg: insamling, fixering, uttorkning, inbäddning och sektionering av prover. Eftersom stegen är variabla (figur 1) beroende på den eller de valda teknikerna är det viktigt att tänka framåt, med tanke på de fixeringsmedel som ska beredas och transporteras till uppsamlingsplatsen, hur proverna måste beredas innan de fixeras, de uttorkningsprocesser som ska användas (avsnitt 1) och olika inbäddningsmöjligheter och sektioneringsmetoder (avsnitt 4, 5). och 9). Figur 1 sammanfattar sekventiellt alla steg som krävs för varje mikroskopiteknik som beskrivs noggrant nedan.
Protocol
Representative Results
Discussion
Bildanalyser inom växtanatomi och morfologi har en viktig potential att uppfylla mål och hjälpa till att förstå sambanden mellan mykoheterotrofa växter och deras oumbärliga svampendofyter, vilket framgår av studier av underjordiska organ6,40, strukturella analyser av symbiotisk spiring av frön39 och luft- och reproduktionsstrukturer 41 . Strukturell botanik, trots att den har förlorat sin prestige och sitt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Författarna tackar finansiering från FAEPEX och FAPESP (2015/26479-6). MPP tackar Capes för hans magisterexamen stipendium (process 88887.600591/2021-00) och CNPq. JLSM tackar CNPq för produktivitetsbidrag (303664/2020-7). Författarna tackar också tillgången till utrustning och hjälp från LME (Laboratory of Electron Microscopy – IB / Unicamp), INFABiC (National Institute of Science and Technology on Photonics Applied to Cell Biology – Unicamp) och LaBiVasc (Laboratory of Vascular Biology – DBEF / IB / Unicamp); LAMEB (UFSC) och Eliana de Medeiros Oliveira (UFSC) för bidrag till kryoskyddsprotokollet; LME för bidrag till TEM-protokollet.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

