Mikoheterotrofik Bitki Dokularında Mantar Kolonizasyonunu Yorumlamak ve Tohumların Simbiyotik Çimlenmesi için Mikroskopi Teknikleri
Summary
Bu protokol, mikoheterotrofik bitki örneklerinin toplanması, sabitlenmesi ve sürdürülmesi için ayrıntılı prosedürler sağlamayı, mikorizal mantarlarla çimlenmiş bitki dokularında ve tohumlarda mantar kolonizasyonunu incelemek için tarama ve iletim elektron mikroskobu, ışık, konfokal ve floresan mikroskobu gibi farklı mikroskopi tekniklerini uygulamayı amaçlamaktadır.
Abstract
Yapısal botanik, bitkilerin ekolojisini, fizyolojisini, gelişimini ve evrimini tam olarak anlamak için vazgeçilmez bir bakış açısıdır. Mikoheterotrofik bitkileri (yani, mantarlardan karbon elde eden bitkileri) araştırırken, yapısal adaptasyonlarının dikkat çekici yönleri, mantarlar tarafından doku kolonizasyonu kalıpları ve yeraltı organlarının morfoanatomisi, gelişim stratejilerini ve besin kaynağı olan hiflerle ilişkilerini aydınlatabilir. Simbiyotik mantarların bir diğer önemli rolü orkide tohumlarının çimlenmesi ile ilgilidir; Tüm Orchidaceae türleri, çimlenme ve fide aşamasında (ilk mikoheterotrofi), hatta yetişkin aşamalarında fotosentez yapanlar bile mikoheterotrofiktir. Orkide tohumlarında besin rezervlerinin bulunmaması nedeniyle, mantar simbiyontları substratlar sağlamak ve çimlenmeyi sağlamak için gereklidir. Çimlenme aşamalarını yapısal perspektiflerle analiz etmek, mantarların tohumlarla etkileşimi ile ilgili önemli soruları da cevaplayabilir. Bu makalede önerildiği gibi, bitki dokularındaki mantar endofitlerini ortaya çıkarmak için farklı görüntüleme teknikleri uygulanabilir. Bitki organlarının serbest ve ince bölümleri boyanabilir ve daha sonra ışık mikroskobu kullanılarak gözlemlenebilir. Buğday tohumu aglutininine konjuge edilmiş bir florokrom, mantarlara uygulanabilir ve konfokal mikroskopide bitki hücre duvarlarını vurgulamak için Calcofluor White ile birlikte inkübe edilebilir. Ek olarak, tarama ve iletim elektron mikroskobu metodolojileri mikoheterotrofik orkideler için detaylandırılmıştır ve bu protokollerin ilgili bitkilerde uygulanması olanakları araştırılmaktadır. Orkide tohumlarının simbiyotik çimlenmesi (yani, mikorizal mantarların varlığında), protokolde, çimlenmenin farklı aşamalarından elde edilen yapıların ışık, konfokal ve elektron mikroskobu ile analizler için hazırlanması olanakları ile birlikte ayrıntılı olarak açıklanmaktadır.
Introduction
Bitki morfolojisi ve anatomisini kapsayan botanik alanındaki yapısal araştırmalar, tüm organizmayı anlamada temeldir1,2 ve bitkilerin ekolojisi, fizyolojisi, gelişimi ve evrimi ile ilgili bilgileri bütünleştirmek ve katkıda bulunmak için vazgeçilmez perspektifler sağlar3. Bitki morfolojisi ve anatomisindeki yöntemler şu anda yakın zamanda ve bir asırdan fazla bir süre önce geliştirilen protokolleri, ekipmanları ve bilgileri içermektedir2. Klasik yöntemlerin (örneğin, ışık mikroskobu) ve daha yeni tekniklerin (örneğin, konfokal mikroskopi, X-ışını mikrotomografisi) sürekli olarak uygulanması ve uyarlanması aynı temel temele sahiptir: bir metodolojinin geliştirilmesini sağlayan teorik bilgi.
Bitki anatomisi ve morfolojisinde ana araç görüntüdür. Bu tür analizlerin basit gözlemler olduğu yanılgısına rağmen, öznel yorumlara yer vermek2, bu alandaki görüntüleri analiz etmek ve anlamak, uygulanan yöntemler (ekipman, analiz türü, metodolojik prosedürler), hücre bileşenleri, histokimya ve bitki gövdesi (doku organizasyonu ve fonksiyonu, ontojeni, morfolojik adaptasyonlar) hakkında bilgi gerektirir. Çeşitli yöntemlerle elde edilen görüntülerin yorumlanması, form ve fonksiyonun ilişkilendirilmesine, bir yapının kimyasal bileşiminin deşifre edilmesine, taksonların tanımlanmasında doğrulanmasına, fitopatojenlerin enfeksiyonlarının anlaşılmasına ve diğer bu tür değerlendirmelere yol açabilir.
Mikoheterotrofik (MH) bitkileri (yani, mikorizal mantarlardan karbon elde eden fotosentetik olmayan bitkiler4,5) araştırırken, yapısal adaptasyonlarının dikkat çekici yönleri, mantarlar tarafından doku kolonizasyonu kalıpları ve yeraltı organlarının morfoanatomisi, gelişim stratejilerini ve besin kaynağı olan hiflerle ilişkilerini aydınlatabilir. MH bitkilerinin yeraltı organları genellikle toprak mantarları ile olan ilişkileriyle ilgili önemli adaptasyonlar gösterir, bu nedenle bu anatomik ve morfolojik araştırmaların yapılması esastır6. MH türlerinin hava organları göz ardı edilmemelidir, çünkü endofitler mikorizal mantar olmasalar bile bu dokularda da bulunabilir (kişisel gözlemler, henüz yayınlanmamıştır).
Mikorizal mantarların MH türleri ile tüm yaşam döngüleriboyunca 7 olan ilişkisinin köklü özünün yanı sıra, her orkide türü, ototrofik olanlar bile, doğal ortamlarda başlangıçta zorunlu bir mikoheterotrofik aşamaya sahiptir. Orkidelerin embriyosunun farklılaşmamış olması ve endosperm veya kotiledonlardan yoksun olması, dolayısıyla mantar ortaklarının beslenme desteği olmadan doğal ortamlarda kendini geliştirememesi ve kuramamasıdır 4,8. Simbiyotik çimlenme protokollerinin sadece MH türlerine değil, aynı zamanda fotosentez yapan orkidelere de uygulanabileceği göz önüne alındığında, çimlenme ve protocorm gelişiminde orkide-mantar özgüllüğünü araştırmayı amaçlayan, tehdit altındaki türlerin korunmasına yönelik girişimlerde çok uygulanan bir metodoloji 9,10,11.
Bu yöntem derlemesinde, anatomik çalışmalar için MH bitki örneklerinin toplanması, sabitlenmesi ve depolanması (bölüm 1), yüzey analizi ve numune seçimi (bölüm 2), bölümleme yöntemleri (serbest: bölüm 3, mikrotomi: bölüm 4, kriyomikrotomi: bölüm 5), boyama ve montaj (bölüm 6), mantar endofitlerinin floresan ve konfokal mikroskopisi (bölüm 7), taramalı elektron mikroskobu (bölüm 8), ve transmisyon elektron mikroskobu (bölüm 9). Ek olarak, orkide tohumları için simbiyotik çimlenme yöntemini (MH ve ototrofik, bölüm 10) tanımlamaktayız, çünkü daha önce bahsedilen görüntüleme yöntemleri, çimlenme sürecinde tohumların, protokormların ve fidelerin mantar kolonizasyonunu analiz etmek için başarıyla uygulanabilir.
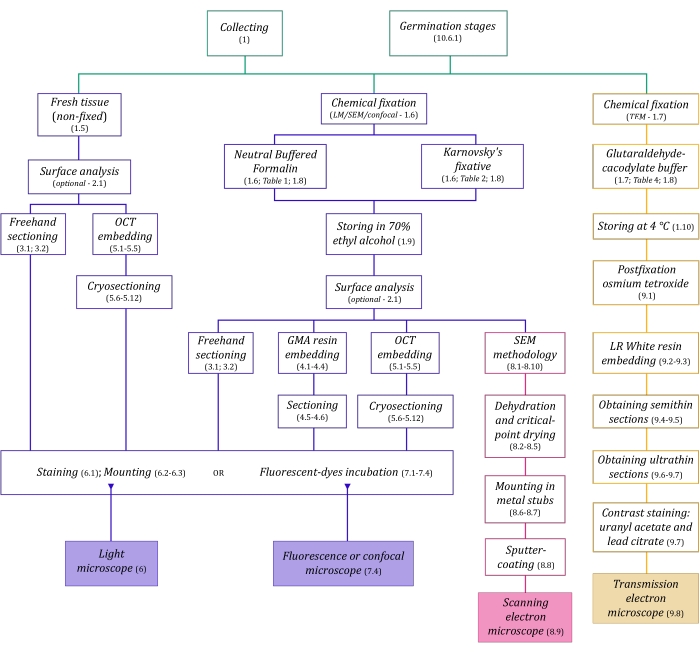
Şekil 1: Görüntüleme yöntemlerinin şematik özeti. Şemalar, ayrıntılı olarak açıklandığı protokol adımlarının göstergelerini sağlar. Kısaltmalar: GMA = glikol metakrilat, OCT = optimal kesme sıcaklığı bileşiği, SEM = taramalı elektron mikroskobu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada ayrıntılı olarak açıklanan mikroskopi teknikleri (Şekil 1) aşağıdaki temel adımlardan önce gelir: numunelerin toplanması, sabitlenmesi, dehidrasyonu, gömülmesi ve bölümlenmesi. Seçilen teknik(ler)e bağlı olarak adımlar değişken olduğundan (Şekil 1), hazırlanacak ve toplama alanına taşınacak fiksatörleri, numunelerin sabitlemeden önce nasıl hazırlanması gerektiğini, kullanılacak dehidrasyon işlemlerini (bölüm 1) ve farklı gömme olanakları ve kesitleme yöntemlerini (bölüm 4, 5, ve 9). Şekil 1 , aşağıda ayrıntılı olarak açıklanan her mikroskopi tekniği için gerekli tüm adımları sırayla özetlemektedir.
Protocol
Representative Results
Discussion
Bitki anatomisi ve morfolojisindeki görüntü analizleri, yeraltı organları6,40, tohumların simbiyotik çimlenmesinin yapısal analizleri39 ve hava ve üreme yapıları 41 ile gösterildiği gibi, amaçları yerine getirmek ve mikoheterotrofik bitkiler ile vazgeçilmez mantar endofitleri arasındaki ilişkileri anlamaya yardımcı olmak için önemli bir potansiyele sahiptir. . Yapısal botanik, son on yılda bi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar FAEPEX ve FAPESP’in (2015/26479-6) finansmanına teşekkür ediyor. MPP, yüksek lisans bursu için Capes’e teşekkür eder (süreç 88887.600591/2021-00) ve CNPq. JLSM, verimlilik hibeleri için CNPq’ya teşekkür eder (303664/2020-7). Yazarlar ayrıca LME (Elektron Mikroskobu Laboratuvarı – IB / Unicamp), INFABiC (Hücre Biyolojisine Uygulanan Fotonik Ulusal Bilim ve Teknoloji Enstitüsü – Unicamp) ve LaBiVasc (Vasküler Biyoloji Laboratuvarı – DBEF / IB / Unicamp) tarafından sağlanan ekipman ve yardıma erişime teşekkür eder; LAMEB (UFSC) ve Eliana de Medeiros Oliveira (UFSC) kriyoproteksiyon protokolüne katkılarından dolayı; TEM protokolüne katkılarından dolayı LME.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

