הקרנה בתפוקה גבוהה של מבודדים מיקרוביאליים עם השפעה על בריאות Caenorhabditis elegans
Summary
חיידקי מעיים עשויים להשפיע באופן חיובי או שלילי על בריאות המארח שלהם באמצעות מנגנונים ספציפיים או שמורים. Caenorhabditis elegans היא פלטפורמה נוחה לסינון עבור חיידקים כאלה. הפרוטוקול הנוכחי מתאר סינון בתפוקה גבוהה של 48 חיידקים מבודדים להשפעה על עמידות לעקה של נמטודה, המשמשים כפרוקסי לבריאות התולעים.
Abstract
עם גודלו הקטן, תוחלת החיים הקצרה והגנטיקה הקלה שלו, Caenorhabditis elegans מציע פלטפורמה נוחה לחקר ההשפעה של מבודדים מיקרוביאליים על הפיזיולוגיה של המארח. הוא גם פלואורסצנטי בכחול בעת המוות, ומספק אמצעי נוח לאיתור מוות. נכס זה נוצל לפיתוח מבחני הישרדות C. elegans ללא תוויות בתפוקה גבוהה (LFASS). אלה כוללים רישום פלואורסצנטי בהילוך מהיר של אוכלוסיות תולעים הקבועות בלוחות מרובי בתים, שמהם ניתן לגזור את זמן המוות החציוני של האוכלוסייה. המחקר הנוכחי מאמץ את גישת LFASS לסינון מבודדים מיקרוביאליים מרובים בו-זמנית עבור ההשפעות על הרגישות של C. elegans לחום חמור ולעקות חמצוניות. כאן מדווח על צינור סינון מיקרוביאלי כזה, שניתן להשתמש בו בעיקר כדי לסנן מראש פרוביוטיקה, תוך שימוש בעמידות קשה ללחץ כפרוקסי לבריאות המארח. הפרוטוקול מתאר כיצד לגדל הן את אוספי המיקרוביוטה המבודדת של המעיים C. elegans והן אוכלוסיות תולעים סינכרוניות במערכים מרובי תאים לפני שילובם למבחנים. הדוגמה שסופקה מכסה בדיקה של 47 חיידקים מבודדים וזן בקרה אחד על שני זני תולעים, בשני מבחני עקה במקביל. עם זאת, צינור הגישה ניתן להרחבה בקלות וישים לסינון של שיטות רבות אחרות. לפיכך, הוא מספק מערך רב-תכליתי לסקירה מהירה של נוף רב-פרמטרי של תנאים ביולוגיים וביוכימיים המשפיעים על בריאות C. elegans.
Introduction
בגוף האדם חיים כ-10-100 טריליון תאים מיקרוביאליים חיים (חיידקים, פטריות ארכאיות), המצויים בעיקר בסביבות המעיים, העור והרירית1. במצב בריא, אלה מספקים יתרונות למארח שלהם, כולל ייצור ויטמינים, התבגרות של מערכת החיסון, גירוי של תגובות חיסוניות מולדות ונרכשות לפתוגנים, ויסות חילוף החומרים של השומן, ויסות תגובות ללחץ ועוד, עם השפעה על גדילה והתפתחות, התפרצות מחלות והזדקנות 2,3,4,5 . גם המיקרוביוטה של המעיים מתפתחת במידה ניכרת במהלך החיים. האבולוציה הדרסטית ביותר מתרחשת במהלך הינקות והילדות המוקדמת6, אך שינויים משמעותיים מתרחשים גם עם הגיל, כולל ירידה בשפע ביפידובקטריום ועלייה במינים קלוסטרידיום, לקטובצילוס, אנטרובקטריה ואנטרוקוקוס 7. אורח חיים יכול לשנות עוד יותר את ההרכב המיקרוביאלי של המעיים ולהוביל לדיסביוזיס (אובדן חיידקים מועילים, צמיחת יתר של חיידקים אופורטוניסטיים), וכתוצאה מכך פתולוגיות שונות כגון מחלות מעי דלקתיות, סוכרת והשמנת יתר5, אך גם לתרום למחלות אלצהיימר ופרקינסון 8,9,10,11.
הבנה זו תרמה תרומה קריטית לעידון הרעיון של ציר המעי-מוח (GBA), שבו אינטראקציות בין הפיזיולוגיה של המעיים (כיום כולל המיקרובים שבתוכה) לבין מערכת העצבים נחשבות לווסת העיקרי של חילוף החומרים של בעלי החיים ולתפקודים פיזיולוגיים12. עם זאת, התפקיד המדויק של המיקרוביוטה באיתות בין המעי למוח ומנגנוני הפעולה הקשורים אליו רחוקים מלהיות מובנים במלואם13. מאחר שמיקרוביוטה של המעיים היא גורם מפתח להזדקנות בריאה, האופן שבו חיידקים מווסתים את תהליך ההזדקנות הפך לנושא למחקר אינטנסיבי ולמחלוקת 6,14,15.
עם ההדגמה שהתולעת העגולה Caenorhabditis elegans מארחת מיקרוביוטה של המעי בונפיד הנשלטת – כמו במינים אחרים – על ידי Bacteroidetes, Firmicutes ו- Actinobacteria 16,17,18,19,20, עלייתה המהירה כפלטפורמה ניסיונית לחקר אינטראקציות בין המעי המארח למעיים 21,22,23,24 ,25,26 הרחיב משמעותית את ארסנל החקירות שלנו26,27,28,29. בפרט, ניתן להתאים גישות ניסיוניות בעלות תפוקה גבוהה הזמינות עבור C. elegans לחקר תזונה גנטית, גנים-תרופות, גנים-פתוגנים וכו’, כדי לחקור במהירות כיצד חיידקים מבודדים וקוקטיילים משפיעים על הבריאות וההזדקנות של C. elegans.
הפרוטוקול הנוכחי מתאר צינור ניסיוני לסינון בבת אחת של מערכים של חיידקים מבודדים או תערובות שנקבעו בלוחות מרובי בתים להשפעות על עמידות ללחץ C. elegans כפרוקסי לבריאות, אשר ניתן להשתמש בהם כדי לזהות פרוביוטיקה. הוא מפרט כיצד לגדל אוכלוסיות תולעים גדולות ולטפל במערכי חיידקים בתבניות של לוחות 96 ו-384 בארות לפני עיבוד תולעים לניתוח אוטומטי של עמידות בפני עקה באמצעות קורא לוחות פלואורסצנטיים (איור 1). הגישה מבוססת על מבחני הישרדות אוטומטיים ללא תוויות (LFASS)30 המנצלים את תופעת פלואורסצנציית המוות31, לפיה תולעים גוססות מייצרות פרץ של פלואורסצנציה כחולה שניתן להשתמש בה כדי לאתר את זמן המוות. פלואורסצנציה כחולה נפלטת על ידי אסטרים של גלוקוזיל של חומצה אנתרנילית המאוחסנים בגרגרי מעיים של C. elegans (סוג של אברונים הקשורים לליזוזום), אשר מתפוצצים כאשר מפל נמק מופעל במעי התולעת עם המוות31.
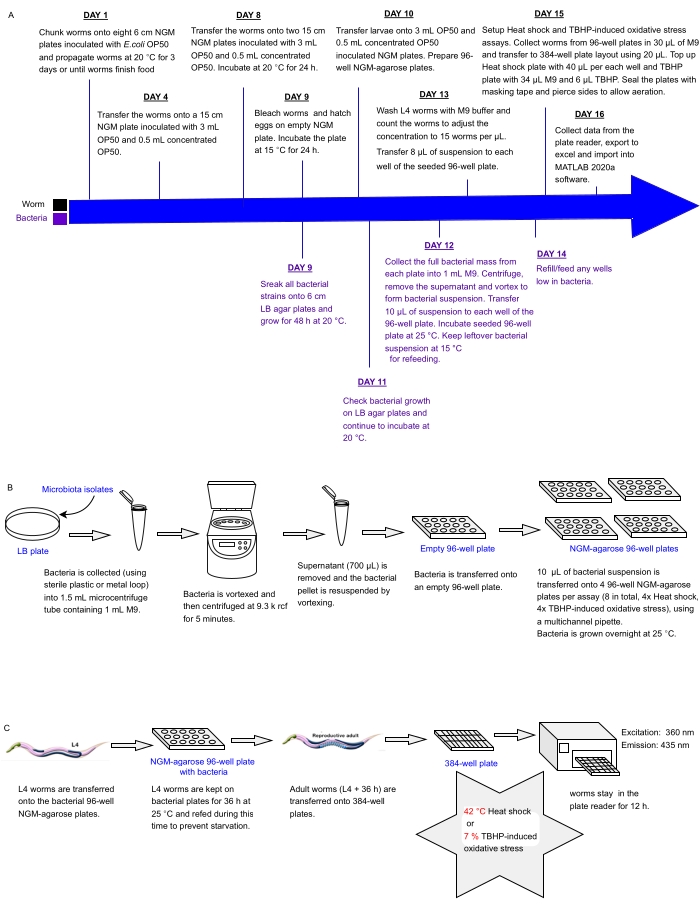
איור 1: זרימת עבודה ניסיונית לסינון בתפוקה גבוהה של חיידקים מבודדים עם השפעה על עמידות C. elegans ללחץ . (A) ציר זמן לתחזוקה והגדרת בדיקה של תולעים וחיידקים. (B) מערך לוחות חיידקים 96 באר התקנה וטיפול. (C) 384-באר צלחת תולעת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
C. elegans מציעה יתרונות רבים לסינון מהיר של מספר פרמטרים ניסיוניים בו זמנית, בשל גודלה הקטן, השקיפות, הפיתוח המהיר, תוחלת החיים הקצרה, הזולות וקלות הטיפול. הגנום, תוכנית הגוף, מערכת העצבים, המעיים והמיקרוביום הפשוטים הרבה יותר, אך מורכבים ודומים מספיק לבני אדם, הופכים אותו למודל פרה-קליני ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים ל- CGC מינסוטה (מדיסון, ארה”ב, NIH – P40 OD010440) על אספקת זני תולעים ו- OP50 ו- Pr. Hinrich Schulenburg (CAU, קיל, גרמניה) על אספקת כל המבודדים המיקרוביאליים הסביבתיים המתוארים כאן. עבודה זו מומנה על ידי מענק UKRI-BBSRC ל-AB (BB/S017127/1). JM ממומן על ידי מלגת דוקטורט FHM של אוניברסיטת לנקסטר.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
References
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

