Bioimpressão Cerâmica Omnidirecional em Suspensões Carregadas de Células para a Geração de Análogos Ósseos
Summary
Este protocolo descreve uma técnica de impressão 3D para fabricar estruturas semelhantes a ossos, depositando uma tinta de fosfato de cálcio em um suporte granular à base de gelatina. Os análogos ósseos impressos são depositados em forma livre, com flexibilidade para a colheita direta da impressão ou reticulação dentro de uma matriz celular viva para construções multifásicas.
Abstract
Estruturalmente, o tecido ósseo é um composto inorgânico-orgânico contendo células metabolicamente ativas embutidas dentro de uma matriz hierárquica e altamente mineralizada. Essa organização é difícil de replicar devido ao ambiente heterogêneo do osso. A bioimpressão omnidirecional cerâmica em suspensões celulares (COBICS) é uma técnica de bioimpressão baseada em microgel que replica exclusivamente a estrutura mineral e celular do osso. A COBICS imprime construções complexas e biologicamente relevantes sem a necessidade de materiais de suporte sacrificiais ou etapas severas de pós-processamento (por exemplo, radiação e sinterização a alta temperatura), que são dois dos maiores desafios na fabricação aditiva de construções miméticas ósseas. Esta técnica é habilitada através da extrusão de forma livre de uma nova tinta à base de fosfato de cálcio dentro de uma suspensão de microgel à base de gelatina. As propriedades de rendimento-tensão da suspensão permitem a deposição e suportam a estrutura óssea impressa. A reticulação UV e a nanoprecipitação então a “bloqueiam” no lugar. A capacidade de imprimir cerâmicas miméticas ósseas nanoestruturadas em biomateriais carregados de células fornece controle espaço-temporal sobre macro e microarquitetura e facilita a fabricação em tempo real de construções ósseas complexas em ambientes clínicos.
Introduction
O osso tem notáveis habilidades de regeneração como uma das poucas estruturas do corpo que podem cicatrizar recriando sua composição celular normal, orientação e força mecânica até um tamanho de defeito crítico, quando a capacidade de cicatrização endógena é comprometida1. O osso, juntamente com a cartilagem e o ligamento, suporta e facilita o movimento do corpo, além de armazenar minerais e gorduras e produzir células sanguíneas. Como um tecido conjuntivo duro e denso, o osso é composto principalmente de uma fase inorgânica, água e material orgânico composto principalmente de fibras colágenas2. As células estão embutidas dentro dessa matriz altamente mineralizada de fibras colágenas I e cristais de hidroxiapatita (HA), formando uma estrutura hierárquica3.
A complexa organização desse tecido torna a fabricação de alternativas sintéticas para replicar os heterogêneos micro e nanoambientes ósseos excepcionalmente desafiadores3. Para este propósito, uma variedade de materiais, incluindo biocerâmica, hidrogéis carregados de células e materiais sintéticos foram propostos como soluções para criar matrizes ósseas. Entre as técnicas de fabricação de andaimes, as técnicas baseadas em impressão 3D surgiram recentemente e receberam muita atenção da comunidade de engenharia de tecidos devido à sua notável capacidade de permitir a fabricação de estruturas altamente sofisticadas e precisas com grande promessa de tratamento específico do paciente 4,5,6 . Os hidrogéis têm sido a escolha mais popular de mímicos de matriz e biotintas, uma vez que podem ser impressos em conjunto com células e moléculas bioativas, gerando construtos funcionais6. No entanto, os hidrogéis não possuem as propriedades funcionais do osso, como resistência mecânica e uma fase inorgânica altamente calcificada contendo células metabolicamente ativas.
Os andaimes cerâmicos impressos em 3D normalmente requerem etapas de pós-processamento, incluindo sinterização, tratamentos a alta temperatura ou o uso de produtos químicos agressivos que devem ser cuidadosamente lavados antes de aplicações in vitro ou in vivo 5. Para abordar essas limitações, Lode et al.7 desenvolveram recentemente uma pasta à base de fosfato α-tricálcico formada por hidroxiapatita, que pode ser impressa e ajustada em condições fisiológicas. No entanto, este material ainda não pode ser impresso em conjunto com células vivas, pois requer pós-tratamento em um ambiente úmido e subsequente imersão em solução aquosa por um longo período.
Alternativamente, hidrogéis carregados de células com partículas inorgânicas incorporadas têm sido propostos como substitutos da matriz óssea 3D 8,9. Apesar de sua grande capacidade de suportar a viabilidade celular, eles não são capazes de recapitular o ambiente de tecido ósseo densamente mineralizado. Thrivikarman et al.10 adotaram uma abordagem biomimética na qual um meio supersaturado de cálcio e fosfato foi utilizado com um análogo proteico não colagenoso para melhor mimetizar a deposição de apatita em nanoescala. No entanto, suas construções ainda não podem gerar construções 3D rígidas com arquitetura de micro e macroescala semelhante a ossos.
O presente estudo aborda essas deficiências por meio do desenvolvimento de uma estratégia de impressão para fabricar construtos que imitam ossos, em fases inorgânica e orgânica, que sejam capazes de integrar tanto células quanto fatores de crescimento11. O COBICS recapitula exclusivamente a estrutura mineral e celular do osso usando uma técnica de bioimpressão baseada em microgel. O protocolo aqui descrito descreve o processo de síntese dos microgéis cerâmicos à base de tinta óssea e gelatina e, em seguida, a combinação de células que permitem o COBICS. O processo começa com a síntese do principal material precursor da tinta óssea. O hidrogel reticulável é então sintetizado e formado em microgéis. Por fim, a tinta óssea é depositada omnidirecionalmente em um banho de suporte dos microgéis carregados de células (Figura 1).
A tinta óssea pode ser impressa em qualquer suspensão de microgéis que tenham as características apropriadas de tensão de rendimento, ou seja, a capacidade de fluidizar a uma taxa de cisalhamento específica e, posteriormente, apoiar a estrutura depositada. Foram demonstradas duas abordagens flexíveis: uma suspensão constituída por microgéis de gelatina e uma suspensão constituída por microgéis de metacrilato de gelatina (GelMA). A primeira suspensão dissolve-se quando a temperatura é elevada para 37 °C, a forma livre de incorporação reversível de hidrogéis suspensos (FRESH) técnica12, enquanto a última pode ser fotoreticulada após a impressão, efetivamente “costurando” os microgéis juntos e travando a tinta óssea impressa no lugar. O presente estudo se concentra no uso de GelMA como matriz, pois fornece a vantagem única de ser capaz de suportar o crescimento celular com impressão in situ de estruturas miméticas ósseas complexas. Em última análise, essa abordagem permite a geração de modelos de tecidos complexos com altos níveis de biomimética e amplas implicações para a modelagem de doenças, descoberta de medicamentos e engenharia regenerativa.
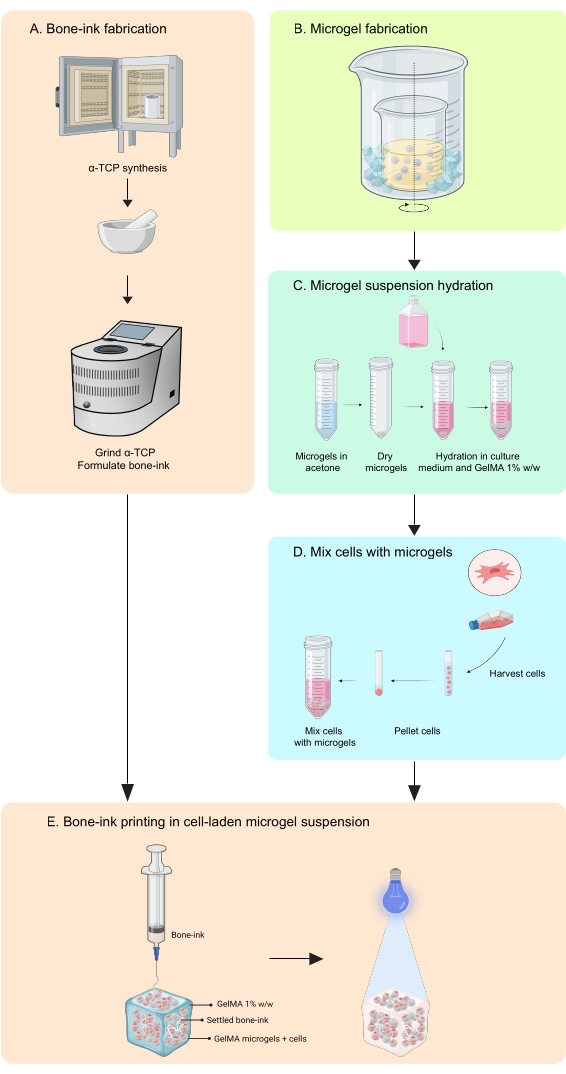
Figura 1: Esquema do fluxo de trabalho . (A) A tinta óssea é sintetizada a partir da síntese de fosfato α-tricálcico e sua subsequente combinação com glicerol, polissorbato 80 e fosfato de amônio dibásico. (B) Os microgéis GelMA são fabricados pelo método de emulsão de água em óleo. Os microgéis obtidos são então (C) hidratados e (D) combinados com células. Os compósitos de célula-microgel são então usados como um banho granular no qual a tinta óssea é depositada. (E) Toda a construção é então reticulada por UV e transferida para a incubadora para cultura. Abreviaturas: α-TCP = fosfato α-tricálcico; GelMA = metacrilato de gelatina. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A técnica de impressão 3D COBICS foi desenvolvida para permitir a fabricação de estruturas mineralizadas semelhantes a ossos por extrusão em uma suspensão de microgel reticulável contendo células vivas. A técnica tem sido aplicada a uma suspensão de microgel degradável, e as células apresentam boa viabilidade, disseminação e capacidade de diferenciação osteogênica dentro do sistema11. Um determinante chave do sucesso de construções criadas usando essa técnica é a síntese adeq…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer ao Conselho Nacional de Saúde e Pesquisa Médica (Grant no. GNT1111694 e GNT1141602) e ao Australian Research Council (Grant no. FT180100417, FL150100060 e CE14100036). Os autores gostariam de agradecer o Biomedical Imaging Facility da Universidade de Nova Gales do Sul. As figuras foram criadas com Biorender.com, Adobe Photoshop e Adobe Illustrator e foram exportadas sob uma assinatura paga.
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
References
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

