Biobank für translationale Medizin: Standardarbeitsanweisungen für optimales Probenmanagement
Summary
Biobanken sind wichtige Ressourcen für die biomedizinische Forschung und die Biobank for Translational and Digital Medicine Unit am European Institute of Oncology ist ein Modell auf diesem Gebiet. Hier bieten wir eine detaillierte Beschreibung der Standardarbeitsanweisungen von Biobanken für das Management verschiedener Arten von humanbiologischen Proben.
Abstract
Biobanken sind wichtige Forschungsinfrastrukturen, die auf die Sammlung, Lagerung, Verarbeitung und gemeinsame Nutzung hochwertiger humanbiologischer Proben und zugehöriger Daten für Forschung, Diagnose und personalisierte Medizin abzielen. Die Biobank for Translational and Digital Medicine Unit am European Institute of Oncology (IEO) ist ein Meilenstein auf diesem Gebiet. Biobanken arbeiten mit klinischen Abteilungen, internen und externen Forschungsgruppen und der Industrie zusammen und unterstützen die Behandlung und den wissenschaftlichen Fortschritt von Patienten, einschließlich innovativer Diagnostik, Biomarkerentdeckung und klinischem Studiendesign. Angesichts der zentralen Rolle von Biobanken in der modernen Forschung sollten Biobanking-Standardarbeitsanweisungen (SOPs) äußerst präzise sein. SOPs und Kontrollen durch zertifizierte Spezialisten gewährleisten höchste Probenqualität für die Umsetzung wissenschaftlich fundierter, diagnostischer, prognostischer und therapeutischer personalisierter Strategien. Trotz zahlreicher Bemühungen zur Standardisierung und Harmonisierung von Biobanken sind diese Protokolle, die strengen Regeln, Qualitätskontrollen und Richtlinien folgen, die auf ethischen und rechtlichen Grundsätzen basieren, jedoch nicht leicht zugänglich. Dieses Papier stellt die Standardarbeitsanweisungen der Biobank eines großen Krebszentrums vor.
Introduction
Biobanken sind Biorepositorien, die auf die Sammlung, Lagerung, Verarbeitung und gemeinsame Nutzung menschlicher biologischer Proben und zugehöriger Daten für Forschung und Diagnose abzielen. Ihre Rolle ist nicht nur für die Entdeckung und Validierung von Biomarkern von entscheidender Bedeutung, sondern auch für die Entwicklung neuer Medikamente1. Daher ist die überwiegende Mehrheit der translationalen und klinischen Forschungsprogramme auf den Zugang zu qualitativ hochwertigen Bioproben angewiesen. In dieser Hinsicht gelten Biobanken als Brücke zwischen akademischer Forschung und der pharmazeutischen/biotechnologischen Industrie 2,3,4,5. Aufgrund der beispiellosen Möglichkeiten, die Big Data Collecting und künstliche Intelligenz bieten, entwickelt sich die Rolle von Biobanken in der Krebsforschung kontinuierlich weiter6.
Das breite Spektrum an Biomaterialien, die von Biobanken verarbeitet werden, ist mit klinisch-opathologischen Informationen gekoppelt, einschließlich demographischer und Umweltdaten, Tumortyp, histologischer Grad, Stadium, Vorhandensein einer lymphovaskulären Invasion und Biomarkerstatus 7,8. Je mehr qualitativ hochwertige Proben und Daten verfügbar sind, desto schneller wird die Forschung voranschreiten und sich auf die Gesundheitsversorgung auswirken9. Es gibt einen strengen regulatorischen Rahmen, der auf ethischen und rechtlichen Grundsätzen basiert und weit verbreiteten SOPs, Qualitätskontrollen und Richtlinien folgen sollte (z. B. das U.S. National Cancer Institute, die U.K. Confederation of Cancer Biobanks und die E.U. International Society for Biological and Environmental Repositories)10,11.
Die Entwicklung von SOPs für alle wichtigen Aspekte von Biobanken bringt mehrere Vorteile in Bezug auf Qualität, Rückverfolgbarkeit, Konsistenz, Reproduzierbarkeit und Durchlaufzeiten12,13. Ein weiterer wichtiger Aspekt der SOP-Implementierung ist die Optimierung des Biobankmanagements, die bessere Problemlösungen und alternative Verfahren für Biobankmitarbeiter und Forscher ermöglicht14. All diese Facetten sind Teil des Biobank-Workflows (Abbildung 1).
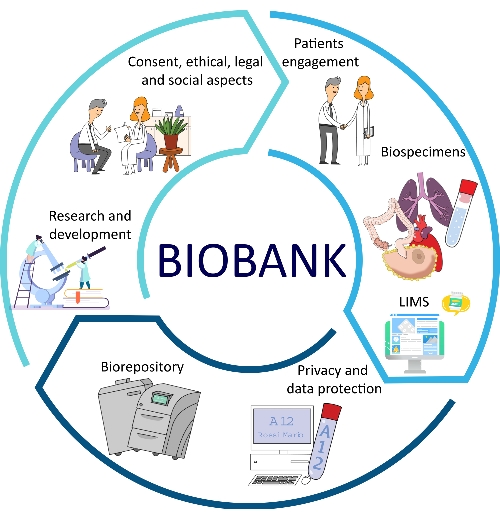
Abbildung 1: Verschiedene Faktoren, die zur Optimierung des Biobankings beitragen. Abkürzung: LIMS = Labor-Informations-Management-System. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diese hochspezifischen und sensiblen Daten erfordern strenge Management-Standardverfahren im Biobanking. Ein detailliertes und validiertes Projektformular sollte allen Forschern zur Verfügung gestellt werden, die Zugang zu den Biobankproben und -daten benötigen. Die in der Anfrage bereitgestellten Informationen sollten die Studienmethodik und das Studiendesign, die Ziele, die Ziele und das Budget umfassen. Es sollte ein technisch-wissenschaftlicher Ausschuss für Biobank eingerichtet werden, dessen Hauptaufgabe die Bewertung von Anträgen für Forschungsprojekte ist. Dieses Gremium sollte Mitglieder der Biobank-Einheit, der klinischen Abteilungen, der Forschungsgruppen, des Datenschutzes, der Rechtsabteilung und der Technologietransferstelle umfassen.
Die Biobank for Translational and Digital Medicine Unit des European Institute of Oncology (IEO) ist eine weltweite Referenz für Biobanken in Bezug auf Qualität und Quantität der erbrachten Dienstleistungen sowie Innovation. Diese vollständig zertifizierte Einrichtung (UNI EN ISO 9001:2015-Certiquality) ist ein integraler Bestandteil des italienischen BBMRI-ERIC-Knotens (d.h. Biobanking and BioMolecular Resources Research Infrastructure) und interagiert sowohl mit klinischen Einheiten als auch mit der Forschungsinfrastruktur.
Es gibt eine große Heterogenität in den Arten von Bioproben, die von Biobanken gelagert werden. Dazu gehören Gewebeproben – entweder frisch gefrorene oder paraffinkonservierte – Bioflüssigkeiten (z. B. Plasma, Serum, Blut, Urin, Stuhl), Zellkulturen und periphere mononukleäre Blutzellen (PBMCs). Unsere Biobank arbeitet synergetisch mit der europäischen Forschungsinfrastruktur für Biobanking (BBMRI-ERIC), die eines der größten Biobanknetzwerke in Europa ist und ein Portal für den Zugang zu Biobanken und biomolekularen Ressourcen bietet, die von nationalen Knoten koordiniertwerden 15. Neben BBMRI-ERIC hat auch die International Society for Biological and Environmental Repositories (ISBER) eine wichtige Rolle bei der Standardisierung von Betriebsverfahren für Biobankinggespielt 16.
Die Biobank-Einheit, die Teil der Abteilung für Pathologie ist, engagiert sich für die Zentralität des Patienten, die Unterstützung der Entwicklung der klinischen Forschung, die kontinuierliche Verbesserung, die Verbesserung der Humanressourcen, die internationale Zusammenarbeit, die Unterstützung von Schulungsveranstaltungen, die Sicherheit am Arbeitsplatz und das wissenschaftliche und technologische Wachstum. Die gemeinsame Vision ist es, die nationalen und europäischen Meilensteine für Biobanken in Bezug auf Qualität und Quantität von Dienstleistungen und Innovation zu schaffen. Die gesammelten biologischen Proben werden verwendet, um neue Biomarker und neue Medikamente zu identifizieren (z. B. um zunehmend personalisierte Therapien zu entwickeln) und um die beste verfügbare Behandlung für Patienten durch Exzellenz in der Forschung zu gewährleisten.
Jede biologische Probe wird nach vorheriger Überprüfung auf das Vorhandensein der vom Patienten ausgedrückten Vereinbarung über die Teilnahme an der wissenschaftlichen Forschung gesammelt und behandelt15. Biologisch gesammelte Proben werden zur Durchführung von Forschungsprojekten oder klinischen Studien verwendet und umfassen überschüssige (dh nicht für diagnostische Zwecke benötigte) pathologische und nicht-pathologische chirurgische Proben, flüssige Biopsien (z. B. Blut, Serum, Plasma und Urin) und andere biologische Proben. Diese Biomaterialien werden nach speziellen Kryokonservierungsprotokollen gelagert. Dieses Papier enthält die Biobankprotokolle eines großen Krebszentrums.
Protocol
Representative Results
Discussion
Obwohl die Onkologie enorme Fortschritte gemacht hat, bleibt Krebs weltweit eine der Hauptursachen für Morbidität und Mortalität20. Das Verständnis der Tumorheterogenität, ihrer zeitlichen Entwicklung im Laufe der Zeit und der Ergebnisse einer gezielten Behandlung hängt strikt von einer genauen Datenerhebung im Rahmen der klinischen Routineversorgung ab21. In dieser Hinsicht gewinnt der “Multi-Omics”-Ansatz in der onkologischen prädiktiven Pathologiean Dynamik 22. Die traditionelle gewebebasierte Biomarkerbewertung wird mit mehreren neuen Bioanalyten wie Blut, Plasma, Urin, Speichel und Stuhl integriert 23,24,25,26. Daher sind Biobanken heute als zentrale Infrastrukturen zur Verbesserung der klinischen Praxis anerkannt. Wenn wir auf die Geschichte der Krebsforschung zurückblicken, stellen wir fest, dass die beeindruckendsten und bahnbrechendsten Entdeckungen ohne direkte Untersuchung von Krebsgewebe oder Flüssigbiopsien niemals möglich gewesen wären. Im Laufe der Zeit hat sich die Quelle von Krebsgewebe und die Art der zu untersuchenden Flüssigbiopsie von groben Sektionen, zufälligen “Zufallsbegegnungen” und in einigen Fällen illegalem Handel zu organisierten Krebssammlungen und strategischen modernen Onkologiebanken entwickelt. Die Berücksichtigung vieler ethischer Fragen hat sich sowohl in der Praxis als auch in den wesentlichen Faktoren, die moderne Onkologiebanken von den onkologischen Sammlungen der Vergangenheit unterscheiden, erheblich verändert.
Aufgrund der Fortschritte in der Krebsforschung und der großen Menge an molekularen Informationen, die heute von modernen Technologien bereitgestellt werden, wird es immer offensichtlicher, dass Biobanken, insbesondere in Krebszentren, mit verschiedenen Arten von methodischen Problemen konfrontiert sein können. Unter diesen ist die Technologie zu einer universellen Herausforderung geworden, die eine SOP-Standardisierung und -Harmonisierung immer noch verhindert. Ein weiterer kritischer Aspekt für die Aufrechterhaltung der Kernaktivitäten der Biobank ist eine integrierte LIMS-Software, die in der Lage ist, alle Krankenhaus-IDs und alle kodifizierten klinischen Daten aus der Software des Krankenhauses zu empfangen und automatisch zu verwalten. Es ist bemerkenswert, dass andere wertvolle Software zur Verwaltung von Biobanken und einige Freeware für die Biobankverwaltung 27,28,29,30,31 erworben werden kann. Ein weiterer kritischer Schritt in Biobanken ist die Umsetzung des Beteiligungspaktes für alle Patienten und der rechtlichen und ethischen Vereinbarung, die für die Speicherung klinischer Daten und Bioproben erforderlich ist10,32.
In dieser Hinsicht enthält dieses Protokoll klar definierte Richtlinien, die die Sammlung und Lagerung von Bioproben ohne Zustimmung nicht zulassen. Dies ist auch ein kritischer Punkt, da Patienten ihre Teilnahme auch nach der Lagerung ihrer Proben zurückziehen können. Daher wurden Methoden implementiert, um solche Proben schnell aus dem Biobankensystem zu entnehmen. Bioproben, die von Patienten stammen, die von unserer Biobank rekrutiert werden, folgen strengen Protokollen für die Sammlung und Lagerung. In diesem Zusammenhang wurden einige wichtige Aspekte zur Überwachung dieses Prozesses bewertet und kontinuierlich verbessert. Insbesondere erfordert die ISO9001-Zertifizierung mehrere Leistungsindikatoren, wie z. B. die warme ischämische Zeit, die je nach Gewebequelle für weniger als 30 Minuten oder 60 Minuten aufrechterhalten werden muss. Darüber hinaus werden Flüssigbiopsien und biologische Flüssigkeiten nach standardisierten Protokollen nach strengen Zeitverfahren 15,33,34,35,36 gesammelt.
Spezifische Merkmale sind in den Arbeitsabläufen von Biobanken von großer Bedeutung. Dazu gehören die Anwesenheit eines zertifizierten Pathologen, der die Probenahme des Gewebes aus diagnostischen Gründen garantiert, und die Entnahme von Gewebe für Biobanking in einem Zeitrahmen, der mit einer hohen Qualität der Proben vereinbar ist (ischämische Zeit ist eine wichtige Indikation für einige Arten von Forschung, wie RNA-abhängige Assays, die weniger warme ischämische Zeit erfordern). Darüber hinaus ist die Verwaltung des Platzbedarfs für die Probenlagerung in Biobanken von großer Bedeutung. Die Anzahl der gesammelten Flüssigbiopsien könnte durch das Studiendesign beeinflusst werden. Flüssigbiopsien können häufig sowohl während der präoperativen als auch der Nachbeobachtungsphase entnommen werden, wie in jedem Studiendesign definiert.
Aufgrund von Screening-Kampagnen zur Krebsprävention und der Früherkennung von Tumoren, d.h. kleinen Brusttumoren in frühen Entwicklungsstadien, sowie der Verfügbarkeit minimalinvasiver Operationstechniken hat sich die Anzahl der für die Forschung verfügbaren Gewebeproben reduziert (da die meisten Gewebeproben immer für diagnostische Zwecke verwendet werden). Die Kapazitäten zur Sammlung und Lagerung biologischer Proben haben sich in den letzten Jahren erheblich verbessert. Dies konnte für biologische Flüssigkeiten beobachtet werden, was die erhöhte Kapazität dieser Biobank widerspiegelt, die Forschungsgruppen dieses Instituts bei der wachsenden Nachfrage nach patientenbasiertem annotiertem Material zu unterstützen. Trotz dieser Verbesserungen haben wir einige Einschränkungen für multizentrische Studien erlebt, die eine Koordination zwischen Biobanken aus verschiedenen Teilen der Welt erfordern, die nur durch die Implementierung ähnlicher Verfahren integriert werden können.
Nachdem die meisten ethischen und technischen Fragen im Zusammenhang mit Biobanking, einschließlich der Sammlung aller klinischen und demografischen Informationen, ausgeschlossen wurden, besteht das nächste Ziel darin, die Digitalisierung aller histologischen Präparate und Färbungen für Diagnose- und Forschungszwecke umzusetzen. Dies ist von grundlegender Bedeutung für die nächste Generation von Studien, die von einer vollständig integrierten digitalen Pathologie und Biobank profitieren werden, die zum Standard für die Zukunft werden wird. Nur eine große Reihe von Patienten mit integrierten Daten und digitalen Bildern kann multizentrische, große Studien zur künstlichen Intelligenz (KI) zur Verbesserung der Krebspatientenversorgung vorantreiben. Zusammenfassend glauben wir, dass eine gute Gesundheitsversorgung nicht mit Diagnose und Behandlung endet. Best Practices umfassen die Suche nach Wegen zur kontinuierlichen Diagnose und Verbesserung der Behandlung für jede Krankheit, insbesondere für solche, die die Lebenserwartung oder -qualität stark beeinträchtigen.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken allen Patienten, die sich in den letzten zehn Jahren durch die Spende ihrer Bioproben aktiv an unseren Forschungsprogrammen beteiligt haben. Ohne sie wäre diese Forschung nicht möglich. Wir danken auch allen Mitarbeitern des IEO, Krankenschwestern, Technikern, Biologen, Ärzten und den Direktoren aller klinischen und Forschungseinheiten. Die Autoren danken Prof. Pier Paolo Di Fiore und Prof. Giancarlo Pruneri für ihre Anleitung. Schließlich widmen wir diese Arbeit Prof. Umberto Veronesi, dem Gründer des IEO, und seinem bahnbrechenden Ansatz zur Integration von Krebsforschung und Patientenversorgung.
Materials
| Blue Max Con Tubes 15 mL | Falcon B.D | 352096 | |
| Blue Max Con Tubes 50 mL | Euroclone Spa | FLC352070 | |
| Box with 81 position for tissue storage | Ettore Pasquali Srl. | 06.0945.00 | |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek | 63950 | Preservation and isolation of both cf-DNA and cf-RNA from a single tube and in particular preserve cf-DNA/ct-DNA for 30 days at ambient temperature and for up to 8 days at 37 °C |
| Cryomold Standard (25 X 20 X 5 mm) | Olympus Italia S.r.l. | 4557 | Disposable plastic Cryomold molds create a uniformly shaped, flat-surface specimen block when used with O.C.T |
| Dimethyl Sulfoxide Plastic Bottle – 1 L | Vwr International S.R.L. | MFCD00002089 | It acts to preserve the reconstitution of the medium for the storage of frozen cells |
| Dpbs 1x W/o Ca And Mg – 500 mL | Microtech Srl | TL1006-500ML | Washing Buffer cell |
| Dualfilter T.I.P.S 1,000 µL | Euroclone Spa | 4809 | |
| Dualfilter T.I.P.S 200 µL | Euroclone Spa | 4823 | |
| Easytrack Barcode Reader for single tube datamatrix | Twin Helix Srl | TH-ETR4400 | 2D barcode tubes reader with USB connection |
| Fetal Bovine Serum Origin Brazileu S/fil | Microtech S.R.L | RM10532-500ML | Defrost at +4 °C, usually for two days, and once melted, start decomplementation at 56 °C for 45 min Let it cool down to room temperature, and aliquot it. Refroze them to -20 °C, and remember to defrost them every time the aliquots are needed |
| Ficoll Paque Plus (ge) 6 x 500 mL | Euroclone Spa | GEH17144003 | Ficoll is a medium for density gradient, It is sterile and ready for use. It alloes to get peripheral blood mononuclear cells, bone marrow and umbilical cord blood |
| Fixing solution Killik of 100 mL (OCT) | Bio-optica Milano S.p.a. | 05-9801 | Gel inclusion medium that solidifies at cold the water-soluble tissue (e.g., biopsies, frustules) |
| FLASH-FREEZE | Milestone | n.a. | Freezing appliance |
| Forma 8600 Series Chest Freezers (Temperature Range: -50 °C to -86 °C) 85 liters | Thermo Fisher Scientific Srl | 803CV | Orizzontal freezer |
| Isopentane 500 mL | Vwr International S.R.L. | 24872260 | Liquid included in theFLASH-FREEZE camera for freezing |
| Nautilus Lims Software | Thermo Scientific™ | n.a. | The software implementation is able to track all patients’ biological samples. Receives Personal and Clinical information automatically during registration due to the integration with IEO operating systems. Nautilus is integrated with the web service through three IEO operative systems: BAC – IEO central registry with personal information, wHospital – medical record |
| Pasteur pipette 10 mL | Euroclone Spa | CC4488 | |
| Pasteur pipette 3 mL | Euroclone Spa | APT1502 | |
| PATHOX | Dedalus ItaliTesi Elettronica e Sistemi Informativi S.p.A.a S.p.A. | n.a. | PATHOX – management system for the Pathology unit where several factors are registered for the Biobank, such as the histological samples, the related diagnoses, and biomarkers |
| Petri dishes, polystyrene – size 100 mm x 20 mm, slippable | Euroclone Spa | FLC353003 | |
| Set of 4 adapters 19 x 5/7 mL vac | Thermo Fisher Scientific Srl | 75003680 | |
| Set of 4 adapters 4 x 50 conical | Thermo Fisher Scientific Srl | 75003683 | |
| Set of 4 adapters 9 x 15 mL conical | Thermo Fisher Scientific Srl | 75003682 | |
| Single-use slide for counting cell | Biosigma S.P.A. | 347143/001 | Specifically used for individual cell count |
| Stamps Freezerbondz for tissue boxes, nitrogen-liquid proof , H 9,53 mm x L 25,40 mm | Twin Helix Srl | THT-152-492-3 | |
| Thermo Scientific TSX Series Ultra-Low Freezers (-50 °C to -86 °C) 949 liters | Thermo Fisher Scientific Srl | TSX70086V | Vertical freezer |
| Thermo Scientific Refrigerated Centrifuge SL16R | Thermo Fisher Scientific Srl | 75004030 | |
| Tissue box labels in Permanent | Twin Helix Srl | THT-199-482-3 | |
| Tuerks Solution | Merck Life Science S.R.L. | 1092770100 | In light microscopy, it is specifically used as stain for leukocyte |
| TX-400 Rotor TX-400 swinging bucket hol | Thermo Fisher Scientific Srl | 75003181 | |
| White box for storage | Bio Optica | 07-7300 | |
| wHospital Software | wHealth Lutech Group | n.a. | wHospital – medical record management system with personal information, administrative cases, and the informed consent of the patients |
References
- Pagni, F., et al. Targeting immune-related biological processes in solid tumors: We do need biomarkers. International Journal of Molecular Sciences. 20 (21), 5452 (2019).
- Braun, K. L., et al. Cancer patient perceptions about biobanking and preferred timing of consent. Biopreservation and Biobanking. 12 (2), 106-112 (2014).
- Bycroft, C., et al. The UK Biobank resource with deep phenotyping and genomic data. Nature. 562 (7726), 203-209 (2018).
- Saifuddin, S. R., et al. King’s Health Partners’ Prostate Cancer Biobank (KHP PCaBB). BMC Cancer. 17 (1), 784 (2017).
- Lopez, G., et al. Molecular insights into the classification of luminal breast cancers: The genomic heterogeneity of progesterone-negative tumors. International Journal of Molecular Sciences. 20 (3), 510 (2019).
- Kinkorová, J. Biobanks in the era of personalized medicine: Objectives, challenges, and innovation: Overview. The EPMA Journal. 7 (1), 4 (2015).
- Luo, J., et al. Intravital biobank and personalized cancer therapy: The correlation with omics. International Journal of Cancer. 135 (7), 1511-1516 (2014).
- Invernizzi, M., et al. Quality of life interventions in breast cancer survivors: State of the art in targeted rehabilitation strategies. Anticancer Agents in Medicinal Chemistry. 22 (4), 801-810 (2021).
- Roux, J., Zeghidi, M., Villar, S., Kozlakidis, Z. Biosafety and biobanking: Current understanding and knowledge gaps. Biosafety and Health. 3 (5), 244-248 (2021).
- Sanchini, V., et al. A trust-based pact in research biobanks. From theory to practice. Bioethics. 30 (4), 260-271 (2016).
- Vaught, J., Kelly, A., Hewitt, R. A review of international biobanks and networks: Success factors and key benchmarks. Biopreservation and Biobanking. 7 (3), 143-150 (2009).
- Ferrin, I., et al. Isolation, culture, and expansion of mesenchymal stem cells. Methods in Molecular Biology. 1590, 177-190 (2017).
- Hermansen, J. U., et al. The Norwegian childhood cancer biobank. Cancer Reports. , 1555 (2021).
- Schmelz, M., et al. A plan for emergency shutdown and reopening for a consortium of biobanks. Biopreservation and Biobanking. 19 (5), 394-398 (2021).
- Salvaterra, E., Corfield, J. . Advances in Biobanking Practice Through Public and Private Collaborations. , (2017).
- Snapes, E., Simeon-Dubach, D. ISBER best practices for repositories, moving toward the fifth edition. Biopreservation and Biobanking. 20 (1), 107-108 (2022).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harbour Protocols. (8), 4991 (2008).
- Staining methods in frozen section: Best lab practices. Laboratory Best Practice Blog. UC Davis Health Available from: https://health.ucdavis.edu/blog/lab-best-practice/staining-methods-in-frozen-section-best-lab-practices/2020/03 (2020)
- Craciun, L., et al. Tumor banks: A quality control scheme proposal. Frontiers in Medicine. 6, 225 (2019).
- Ma, X., Yu, H. Global burden of cancer. The Yale Journal of Biology and Medicine. 79 (3-4), 85-94 (2006).
- Angerilli, V., et al. The role of the pathologist in the next-generation era of tumor molecular characterization. Diagnostics. 11 (2), 339 (2021).
- Correa-Aguila, R., Alonso-Pupo, N., Hernández-Rodríguez, E. W. Multi-omics data integration approaches for precision oncology. Molecular Omics. , (2022).
- Salati, M., et al. ctDNA analysis in the personalized clinical management of gastroesophageal adenocarcinoma: Turning hope into reality. Future Oncology. 17 (33), 4607-4618 (2021).
- Mirzayi, C., et al. Reporting guidelines for human microbiome research: The STORMS checklist. Nature Medicine. 27 (11), 1885-1892 (2021).
- Cortvrindt, C., Speeckaert, R., Delanghe, J. R., Speeckaert, M. M. Urinary epidermal growth factor: A promising "next generation" biomarker in kidney disease. American Journal of Nephrology. , (2022).
- Fusco, N., Fumagalli, C., Guerini-Rocco, E. Looking for sputum biomarkers in lung cancer secondary prevention: Where are we now. Journal of Thoracic Disease. 9 (11), 4277-4279 (2017).
- Im, K., Gui, D., Yong, W. H. An introduction to hardware, software, and other information technology needs of biomedical biobanks. Methods in Molecular Biology. 1897, 17-29 (2019).
- Paul, S., Gade, A., Mallipeddi, S. The state of cloud-based biospecimen and biobank data management tools. Biopreservation and Biobanking. 15 (2), 169-172 (2017).
- Fthenou, E., et al. implementation, and integration of heterogenous information technology infrastructures in the Qatar biobank. Biopreservation and Biobanking. 17 (6), 494-505 (2019).
- Tukacs, E., et al. Model requirements for Biobank Software Systems. Bioinformation. 8 (6), 290-292 (2012).
- Willers, C., et al. A versatile, secure, and sustainable all-in-one biobank-registry data solution: The A3BC REDCap model. Biopreservation and Biobanking. , (2021).
- D’Abramo, F., Schildmann, J., Vollmann, J. Research participants’ perceptions and views on consent for biobank research: A review of empirical data and ethical analysis. BMC Medical Ethics. 16, 60 (2015).
- Policiuc, L., et al. The foundation of personalized medicine is the establishment of biobanks and their standardization. Journal of BUON. 23 (3), 550-560 (2018).
- Lygirou, V., Makridakis, M., Vlahou, A. Biological sample collection for clinical proteomics: Existing SOPs. Methods in Molecular Biology. 1243, 3-27 (2015).
- Pisapia, P., Malapelle, U., Troncone, G. Liquid biopsy and lung cancer. Acta Cytologica. 63 (6), 489-496 (2019).
- Spruessel, A., et al. Tissue ischemia time affects gene and protein expression patterns within minutes following surgical tumor excision. Biotechniques. 36 (6), 1030-1037 (2004).

