وسيط الفوسفوليبيد الناجم عن التحول في الثقافات ثلاثية الأبعاد
Summary
يصف البروتوكول الحالي إنشاء ثقافات ثلاثية الأبعاد “على القمة “ لخط الخلايا الظهارية غير المتحولة للثدي ، MCF10A ، الذي تم تعديله لدراسة التحول الناجم عن عامل تنشيط الصفائح الدموية (PAF). تم استخدام التألق المناعي لتقييم التحول ويتم مناقشته بالتفصيل.
Abstract
تم تطوير العديد من النماذج لدراسة السرطان ، مثل نماذج القوارض وخطوط الخلايا الثابتة. تم توفير رؤى قيمة حول التسرطن من خلال الدراسات التي تستخدم هذه النماذج. وقد وفرت خطوط الخلايا فهما لإزالة القيود التنظيمية من الإشارات الجزيئية المرتبطة بتكوين أورام الثدي، في حين تستخدم نماذج القوارض على نطاق واسع لدراسة الخصائص الخلوية والجزيئية لسرطان الثدي في الجسم الحي. إنشاء ثقافات 3D من الخلايا الظهارية والسرطانية الثدي يساعد في سد الفجوة بين في الجسم الحي والنماذج في المختبر من خلال محاكاة الظروف في الجسم الحي في المختبر. يمكن استخدام هذا النموذج لفهم تحرير أحداث الإشارات الجزيئية المعقدة والخصائص الخلوية أثناء تسرطن الثدي. هنا ، يتم تعديل نظام ثقافة 3D لدراسة التحول الناجم عن وسيط الدهون الفوسفاتية (عامل تنشيط الصفائح الدموية ، PAF). تلعب أجهزة المناعة والجزيئات المفرزة الأخرى دورا رئيسيا في بدء الورم وتقدمه في الثدي. في هذه الدراسة ، تتعرض ثقافات 3D acinar للخلايا الظهارية للثدي لخصائص التحول PAF المعروضة مثل فقدان القطبية والخصائص الخلوية المتغيرة. سيساعد نظام زراعة 3D هذا في إلقاء الضوء على الاضطرابات الجينية و / أو اللاجينية التي تسببها مختلف كيانات الجزيئات الصغيرة في البيئة الدقيقة للورم. بالإضافة إلى ذلك ، سيوفر هذا النظام أيضا منصة لتحديد الجينات الجديدة والمعروفة التي قد تشارك في عملية التحول.
Introduction
يتوفر عدد لا يحصى من النماذج لدراسة تطور السرطان ، كل منها فريد من نوعه ويمثل نوعا فرعيا من هذا المرض المعقد. يوفر كل نموذج رؤى فريدة وقيمة في بيولوجيا السرطان وقد حسن الوسائل لمحاكاة حالة المرض الفعلية. قدمت خطوط الخلايا الراسخة التي نمت كطبقة أحادية رؤى قيمة في العمليات الحيوية في المختبر ، مثل الانتشار والغزو والهجرة وموت الخلايا المبرمج1. على الرغم من أن زراعة الخلايا ثنائية الأبعاد (2D) كانت الأداة التقليدية للتحقيق في استجابة خلايا الثدييات للعديد من الاضطرابات البيئية ، إلا أن استقراء هذه النتائج للتنبؤ بالاستجابات على مستوى الأنسجة لا يبدو مقنعا بما فيه الكفاية. القيد الرئيسي للثقافات ثنائية الأبعاد هو أن البيئة الدقيقة التي تم إنشاؤها تختلف إلى حد كبير عن تلك الموجودة في أنسجة الثدي نفسها2. تفتقر ثقافة 2D إلى تفاعل الخلايا مع المصفوفة خارج الخلية ، وهو أمر حيوي لنمو أي أنسجة. أيضا ، فإن قوى الشد التي تعاني منها الخلية في مزارع الطبقة الأحادية تعيق قطبية هذه الخلايا ، وبالتالي تغير إشارات الخلية وسلوكها3،4،5. فتحت أنظمة الاستزراع ثلاثية الأبعاد (3D) طريقا جديدا في مجال أبحاث السرطان مع قدرتها على محاكاة الظروف في الجسم الحي في المختبر. يمكن إعادة إنشاء العديد من الإشارات البيئية الدقيقة الحاسمة التي تضيع في زراعة الخلايا ثنائية الأبعاد باستخدام ثقافات ثلاثية الأبعاد من المصفوفة خارج الخلية الغنية باللامينين (lrECM)6.
حددت دراسات مختلفة أهمية البيئة الدقيقة للورم في التسرطن 7,8. العوامل المرتبطة بالالتهاب هي جزء رئيسي من البيئة الدقيقة. عامل تنشيط الصفائح الدموية (PAF) هو وسيط فوسفوليبيد تفرزه خلايا مناعية مختلفة تتوسط استجابات مناعية متعددة 9,10. يتم إفراز مستويات عالية من PAF بواسطة خطوط خلايا سرطان الثدي المختلفة وترتبط بالانتشار المعزز11. أظهرت الدراسات التي أجريت في مختبرنا أن الوجود المطول ل PAF في الثقافات الأسينارية يؤدي إلى تحول الخلايا الظهارية للثدي12. يقوم PAF بتنشيط مستقبل PAF (PAFR) ، وتنشيط محور الإشارة PI3K / Akt13. وتفيد التقارير أيضا أن PAFR مرتبط ب EMT والغزو والانبثاث14.
يوضح هذا البروتوكول نظاما نموذجيا لدراسة التحول الناجم عن PAF ، باستخدام ثقافات ثلاثية الأبعاد للخلايا الظهارية للثدي ، كما وصفها سابقا Chakravarty et al.12. تميل الخلايا الظهارية للثدي التي تنمو على المصفوفة خارج الخلية (ثقافات 3D) إلى تشكيل كرويات مستقطبة توقف النمو. وتسمى هذه الأسيني وتشبه إلى حد كبير الأسيني من أنسجة الثدي ، أصغر وحدة وظيفية في الغدة الثديية ، في الجسم الحي15. تتكون هذه الكرويات (الشكل 1A ، B) من طبقة واحدة من الخلايا الظهارية المستقطبة المعبأة بشكل وثيق حول تجويف مجوف ومتصلة بالغشاء السفلي (الشكل 1C). تم وصف عملية التشكل هذه بشكل جيد في الأدب16. عند زرعها على lrECM ، تخضع الخلايا للانقسام والتمايز لتشكيل مجموعة من الخلايا ، والتي تستقطب بعد ذلك من اليوم 4 فصاعدا. بحلول اليوم 8 ، يتكون الأسيني من مجموعة من الخلايا المستقطبة التي تكون على اتصال مباشر مع المصفوفة خارج الخلية ومجموعة من الخلايا غير المستقطبة المغلقة داخل الخلايا المستقطبة الخارجية ، مع عدم وجود اتصال بالمصفوفة . من المعروف أن هذه الخلايا غير المستقطبة تخضع لموت الخلايا المبرمج بحلول اليوم 12 من الثقافة ، مما يشكل تجويفا مجوفا. بحلول اليوم 16 ، يتم تشكيل الهياكل المتوقفة عن النمو16.
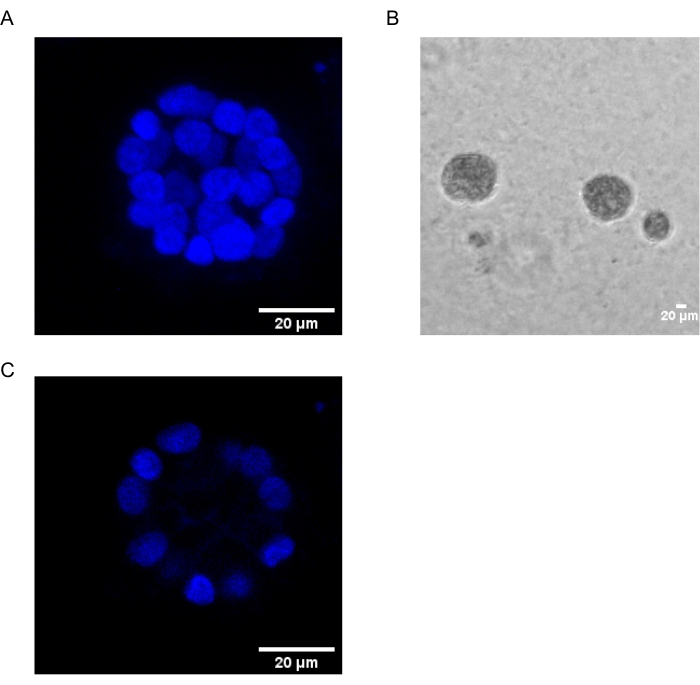
الشكل 1: نوى الخلايا في الأسيني الملطخة ببقعة نووية . (A) بناء 3D من الأسيني. (ب) صورة تباين الطور ل MCF10A acini المزروعة في Matrigel لمدة 20 يوما. (ج) يظهر القسم الأوسط وجود تجويف مجوف. شريط المقياس = 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
على عكس ثقافات 2D ، تساعد ثقافات acinar في تمييز الخلايا الطبيعية والمحولة من خلال التغيرات المورفولوجية الواضحة. تشكل الخلايا الظهارية غير المتحولة في الثدي الأسيني مع تجويف مجوف ، يحاكي أسيني الثدي البشري الطبيعي. تظهر هذه الكرويات ، عند التحول ، مورفولوجيا معطلة تتميز بفقدان كبير للقطبية (واحدة من السمات المميزة للسرطان) ، أو عدم وجود تجويف ، أو اضطراب في التجويف المجوف (بسبب التهرب من موت الخلايا المبرمج) الذي قد يحدث بسبب تحرير الجينات المختلفة17،18،19،20 . يمكن دراسة هذه التحولات باستخدام تقنيات شائعة الاستخدام مثل التألق المناعي. وبالتالي ، يمكن أن يعمل نموذج زراعة الخلايا 3D كطريقة بسيطة للتحقيق في عملية تكوين الثدي وسرطان الثدي. إن إنشاء نظام ثقافة 3D لفهم تأثير وسيط الدهون الفوسفاتية ، PAF ، سيساعد في فحص الأدوية قبل السريرية عالي الإنتاجية.
قام هذا العمل بتكييف بروتوكول الثقافة ثلاثية الأبعاد “على القمة”16,21 لدراسة التحول الناجم عن PAF 22. تمت دراسة التغيرات المظهرية الناجمة عن تعرض الأسيني لوسيط الدهون الفوسفاتية باستخدام التألق المناعي. تم استخدام العديد من علامات القطبية والظهارية إلى الانتقال الوسيط (EMT) 12,16 في الدراسة. ويذكر الجدول 1 توطينها الطبيعي ونمطها الظاهري المتوقع عند التحول.
| الاجسام المضاده | علامات | التوطين العادي | النمط الظاهري المحول |
| α6-إنتيغرين | القاعدية | القاعدية مع وصمة عار جانبية ضعيفة | وصمة عار جانبية / قمية قوية |
| β كاتينين | تقاطع الخلية والخلية | القاعدية | توطين غير طبيعي / نووي أو سيتوبلازمي |
| فيمنتين | EMT | غياب / ضعف الحضور | التنظيم المرتفع |
الجدول 1: العلامات المستخدمة في الدراسة. علامات مختلفة تستخدم مع توطينها في وجود وغياب علاج PAF.
يمكن استخدام هذه الطريقة بشكل أفضل لدراسة / فحص الأدوية المعقولة والجينات المستهدفة لمختلف الأنواع الفرعية لسرطان الثدي. وهذا يمكن أن يوفر بيانات استجابة للأدوية أقرب إلى سيناريو في الجسم الحي ، مما يساعد في تطوير الأدوية بشكل أسرع وأكثر موثوقية. أيضا ، يمكن استخدام هذا النظام لدراسة الإشارات الجزيئية المرتبطة بالاستجابة للأدوية ومقاومة الأدوية.
Protocol
Representative Results
Discussion
تستخدم النماذج القائمة على خط الخلايا على نطاق واسع لدراسة عملية التسرطن. تستمر مزارع الخلايا أحادية الطبقة في تقديم رؤى ثاقبة حول مسارات الإشارات الجزيئية المختلفة التي تتوسط التغيرات المميزة في الخلايا السرطانية32. تم الإبلاغ لأول مرة عن دراسات حول دور الجينات السرطانية ا?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونشكر مرفق الفحص المجهري التابع للمعهد الدولي للدراسات الاستراتيجية في بيون على إمكانية الوصول إلى المعدات والبنية التحتية ودعم التجارب. تم دعم هذه الدراسة من خلال منحة من وزارة التكنولوجيا الحيوية (DBT) ، حكومة الهند (BT / PR8699 / MED/30/1018/2013) ، مجلس أبحاث العلوم والهندسة (SERB) ، حكومة الهند (EMR / 2016 / 001974) وجزئيا من قبل IISER، تمويل Pune Core. تم تمويل A. K. من قبل زمالة CSIR-SRF ، وتم تمويل لوس أنجلوس من خلال زمالة DST-INSPIRE ، وتم تمويل V.C بواسطة DBT (BT / PR8699 / MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. 암 연구학. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

