Far-rød fluorescerende senescens-associeret β-galactosidase sonde til identifikation og berigelse af senescent tumorceller ved flow cytometri
Summary
En protokol for fluorescerende, flowcytometrisk kvantificering af senescente kræftceller induceret af kemoterapilægemidler i cellekultur eller i murine tumormodeller præsenteres. Valgfrie procedurer omfatter co-immunostaining, prøvefiksering for at lette analyse af store batch- eller tidspunkter og berigelse af levedygtige senescente celler ved flowcytometrisk sortering.
Abstract
Cellulær ældning er en tilstand af proliferativ anholdelse induceret af biologisk skade, der normalt opstår over år i aldrende celler, men kan også opstå hurtigt i tumorceller som et svar på skader induceret af forskellige kræftbehandlinger. Tumorcelleældning betragtes generelt som uønsket, da senescente celler bliver resistente over for døden og blokerer tumorremission, mens de forværrer tumormalignitet og behandlingsresistens. Derfor er identifikationen af senescent tumorceller af løbende interesse for kræftforskningsmiljøet. Der findes forskellige ældningsassays, mange baseret på aktiviteten af den velkendte ældningsmarkør, ældningsassocieret beta-galactosidase (SA-β-Gal).
Typisk udføres SA-β-Gal-analysen ved hjælp af et kromogent substrat (X-Gal) på faste celler med langsom og subjektiv optælling af “blå” senescente celler ved lysmikroskopi. Forbedrede assays ved hjælp af cellepermeant, fluorescerende SA-β-Gal-substrater, herunder C12-FDG (grøn) og DDAO-Galactoside (DDAOG; far-red), har muliggjort analyse af levende celler og tilladt brugen af fluorescerende analyseplatforme med høj kapacitet, herunder flowcytometre. C12-FDG er en veldokumenteret sonde til SA-β-Gal, men dens grønne fluorescerende emission overlapper med iboende cellulær autofluorescens (AF), der opstår under ældning på grund af akkumulering af lipofuscinaggregater. Ved at bruge den langt røde SA-β-Gal-sonde DDAOG kan grøn cellulær autofluorescens bruges som en sekundær parameter til at bekræfte ældning, hvilket tilføjer pålidelighed til analysen. De resterende fluorescenskanaler kan bruges til cellelevedygtighedsfarvning eller valgfri fluorescerende immunmærkning.
Ved hjælp af flowcytometri demonstrerer vi brugen af DDAOG og lipofuscin autofluorescens som et dobbeltparameterassay til identifikation af senescent tumorceller. Kvantificering af procentdelen af levedygtige senescente celler udføres. Hvis det ønskes, kan et valgfrit immunmærkningstrin inkluderes for at evaluere celleoverfladeantigener af interesse. Identificerede senescente celler kan også flowcytometrisk sorteres og indsamles til downstream-analyse. Indsamlede senescente celler kan straks lyseres (f.eks. til immunassays eller ‘omics-analyse) eller yderligere dyrkes.
Introduction
Senescente celler akkumuleres normalt i organismer over år under normal biologisk aldring, men kan også udvikle sig hurtigt i tumorceller som et svar på skader induceret af forskellige kræftbehandlinger, herunder stråling og kemoterapi. Selvom de ikke længere formerer sig, kan terapiinducerede senescent (TIS) tumorceller bidrage til behandlingsresistens og drive gentagelse 1,2,3. Faktorer udskilt af TIS-celler kan forværre tumormalignitet ved at fremme immununddragelse eller metastase 4,5. TIS-celler udvikler komplekse, kontekstspecifikke fænotyper, ændrede metaboliske profiler og unikke immunresponser 6,7,8. Derfor er identifikation og karakterisering af TIS tumorceller induceret af forskellige kræftbehandlingsmetoder et emne af løbende interesse for kræftforskningssamfundet.
Til påvisning af TIS-tumorceller anvendes konventionelle ældningsassays i vid udstrækning, primært baseret på påvisning af øget aktivitet af ældningsmarkørenzymet, den lysosomale beta-galactosidase GLB19. Detektion ved en næsten neutral (snarere end sur) lysosomal pH muliggør specifik påvisning af ældningsassocieret beta-galactosidase (SA-β-Gal)10. Et standard SA-β-Gal-assay, der er blevet brugt i flere årtier, bruger X-Gal (5-brom-4-chlor-3-indolyl-β-D-galactopyranosid), et blåt kromogent beta-galactosidasesubstrat, til at detektere SA-β-Gal i faste celler ved lysmikroskopi11. X-Gal-analysen muliggør kvalitativ visuel bekræftelse af TIS ved hjælp af almindeligt tilgængelige reagenser og laboratorieudstyr. Et grundlæggende transmitteret lysmikroskop er den eneste instrumentering, der kræves for at evaluere tilstedeværelsen af det blå kromogen. X-Gal-farvningsproceduren kan dog mangle følsomhed, hvilket nogle gange kræver mere end 24 timer, før farven udvikler sig. Farvning efterfølges af subjektiv scoring med lav gennemstrømning af individuelle senescente celler baseret på tælling af cellerne, der udviser en vis intensitet af det blå kromogen under et lysmikroskop. Da X-Gal er celle-uigennemtrængelig, kræver dette assay opløsningsmiddelfikserede celler, som ikke kan genvindes til downstream-analyse. Når du arbejder med begrænsede prøver fra dyr eller patienter, kan dette være en stor ulempe.
Forbedrede SA-β-Gal-assays ved anvendelse af cellepermeant, fluorescerende enzymsubstrater, herunder C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranosid, grøn) og DDAOG (9H-(1,3-dichlor-9,9-dimethylacridin-2-en-7-yl) β-D-Galactopyranosid, far-red) har tidligere optrådt i litteraturen12,13,14,15. DDAOG’s kemiske sondestruktur og optiske egenskaber er vist i supplerende figur S1. Disse cellepermeanerede sonder tillader analyse af levende (snarere end faste) celler, og fluorescerende snarere end kromogene sonder letter brugen af hurtige fluorescerende analyseplatforme med høj kapacitet, herunder screeningsinstrumenter med højt indhold og flowcytometre. Sortering af flowcytometre muliggør genopretning af berigede populationer af levende senescente celler fra cellekulturer eller tumorer til downstream-analyse (f.eks. Western blotting, ELISA eller ‘omics). Fluorescensanalyse giver også et kvantitativt signal, der giver mulighed for mere nøjagtig bestemmelse af procentdelen af senescente celler i en given prøve. Yderligere fluorescerende sonder, herunder levedygtighedssonder og fluorophoremærkede antistoffer, kan let tilføjes til multipleksanalyse af mål ud over SA-β-Gal.
I lighed med DDAOG er C12-FDG en fluorescerende sonde til SA-β-Gal, men dens grønne fluorescerende emission overlapper med iboende cellulær AF, som opstår under ældning på grund af akkumulering af lipofuscinaggregater i celler16. Ved at bruge den langt røde DDAOG-sonde kan grøn cellulær AF bruges som en sekundær parameter til at bekræfte ældning17. Dette forbedrer analysepålideligheden ved at bruge en anden markør ud over SA-β-Gal, som ofte kan være upålidelig som en enkelt markør for ældning18. Da påvisning af endogen AF i senescente celler er en etiketfri tilgang, er det en hurtig og enkel måde at udvide specificiteten af vores DDAOG-baserede assay.
I denne protokol demonstrerer vi brugen af DDAOG og AF som et hurtigt flowcytometriassay med to parametre til identifikation af levedygtige TIS-tumorceller fra in vitro-kulturer eller isoleret fra lægemiddelbehandlede tumorer etableret hos mus (figur 1). Protokollen bruger fluorophorer, der er kompatible med en bred vifte af standard kommercielle flowcytometrianalysatorer og sorterere (tabel 1). Kvantificering af procentdelen af levedygtige senescentceller ved hjælp af standard flowcytometrianalyse er aktiveret. Hvis det ønskes, kan der udføres et valgfrit immunmærkningstrin for at evaluere celleoverfladeantigener af interesse samtidig med ældning. Identificerede senescente celler kan også beriges ved hjælp af standard fluorescensaktiveret cellesorteringsmetode (FACS).
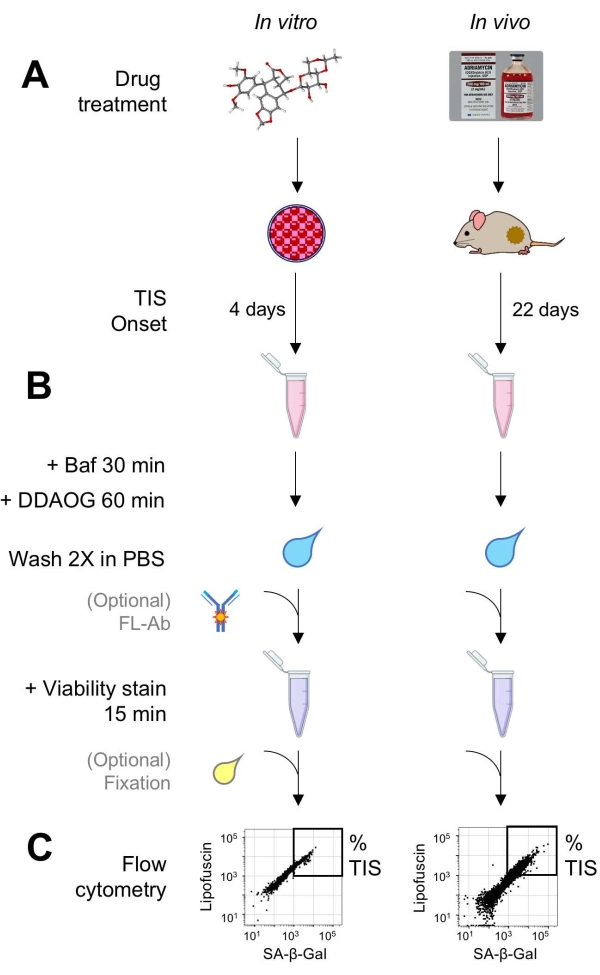
Figur 1: Eksperimentel arbejdsgang. En skematisk opsummering af nøglepunkter i DDAOG-analysen. (A) Et TIS-inducerende lægemiddel tilsættes til pattedyrsdyrkede celler eller administreres til tumorbærende mus. Der er derefter tid til at begynde med TIS: for celler, 4 dage efter behandling; for mus, 22 dage i alt, med tre behandlinger hver 5. dag plus 7 dages restitution. Celler høstes, eller tumorer dissocieres i suspension. (B) Prøver behandles med Baf for at justere lysosomal pH til påvisning af SA-β-Gal i 30 min. derefter tilsættes DDAOG-sonde i 60 minutter for at detektere SA-β-Gal. Prøver vaskes 2x i PBS, og der tilsættes kort en levedygtighedsplet (15 min). Eventuelt kan prøver farves med fluorescerende antistoffer i åbne fluorescenskanaler og / eller fastgøres til senere analyse. (C) Prøver analyseres ved hjælp af et standard flowcytometer. Levedygtige celler visualiseres i prikplotter, der viser rød DDAOG (indikerer SA-β-Gal) versus grøn autofluorescens (lipofuscin). En port til bestemmelse af procentdelen af TIS-celler etableres baseret på ubehandlede kontrolprøver (ikke vist). Hvis der anvendes et sorteringscytometer (FACS), kan TIS-celler opsamles og placeres tilbage i kultur til yderligere in vitro-assays eller lyseres og behandles til molekylærbiologiske assays. Forkortelser: DDAO = 9H-(1,3-dichlor-9,9-dimethylacridin-2-on); DDAOG = DDAO-Galactoside; TIS = terapiinduceret ældning; FL-Ab = fluorophorekonjugeret antistof; Baf = Bafilomycin A1; SA-β-Gal = ældningsassocieret beta-galactosidase; PBS = fosfatbufferet saltvand; FACS = fluorescensaktiveret cellesortering. Klik her for at se en større version af denne figur.
| Fluorophore | Registrerer | Eks/Em (nm) | Cytometer laser (nm) | Cytometerdetektor / båndpasfilter (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscin | < 600 | 488 | 525 / 50 |
| CV450 | Levedygtighed | 408/450 | 405 | 450 / 50 |
| PE | Antistof/overflademarkør | 565/578 | 561 | 582 / 15 |
Tabel 1: Fluoroforer og cytometer optiske specifikationer. Cytometerspecifikationer, der anvendes i denne protokol, er angivet for et instrument med i alt 4 lasere og 15 emissionsdetektorer. DDAOG detekteret ved 645/660 nm er formen af sonden spaltet af SA-β-Gal1. Uncleaved DDAOG kan udvise fluorescens på lavt niveau ved 460/610 nm, men fjernes ved vasketrin i protokollen. Forkortelser: DDAO = 9H-(1,3-dichlor-9,9-dimethylacridin-2-on); DDAOG = DDAO-Galactoside; AF = autofluorescens; PE = phycoerythrin; SA-β-Gal = ældningsassocieret beta-galactosidase.
Protocol
Representative Results
Discussion
I løbet af det sidste årti eller deromkring er flowcytometri blevet en mere almindelig analyseplatform inden for kræftforskning på grund af den nye popularitet af tumorimmunologi, udviklingen af billigere flowcytometre og forbedringen af delte instrumenteringsfaciliteter på akademiske institutioner. Flerfarvede assays er nu standard, da de fleste nyere instrumenter er udstyret med violette, blågrønne og røde til langt røde optiske arrays. Således vil denne DDAOG-protokol sandsynligvis være kompatibel med en la…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker cytometri og antistofkernefacilitet ved University of Chicago for støtte til flowcytometriinstrumentering. Animal Research Center ved University of Chicago leverede dyreboliger.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

