Sonde β-galactosidase associée à la sénescence fluorescente rouge lointain pour l’identification et l’enrichissement de cellules tumorales sénescentes par cytométrie en flux
Summary
Un protocole de quantification fluorescente par cytométrie en flux des cellules cancéreuses sénescentes induites par des médicaments de chimiothérapie en culture cellulaire ou dans des modèles tumoraux murins est présenté. Les procédures facultatives comprennent le co-immunomarquage, la fixation d’échantillons pour faciliter l’analyse de grands lots ou de points temporels, et l’enrichissement de cellules sénescentes viables par tri cytométrique en flux.
Abstract
La sénescence cellulaire est un état d’arrêt prolifératif induit par des dommages biologiques qui s’accumulent normalement au fil des ans dans les cellules vieillissantes, mais qui peut également émerger rapidement dans les cellules tumorales en réponse aux dommages induits par divers traitements contre le cancer. La sénescence des cellules tumorales est généralement considérée comme indésirable, car les cellules sénescentes deviennent résistantes à la mort et bloquent la rémission tumorale tout en exacerbant la tumeur maligne et la résistance au traitement. Par conséquent, l’identification des cellules tumorales sénescentes est d’un intérêt continu pour la communauté de recherche sur le cancer. Il existe divers tests de sénescence, dont beaucoup sont basés sur l’activité du marqueur de sénescence bien connu, la bêta-galactosidase associée à la sénescence (SA-β-Gal).
Typiquement, le test SA-β-Gal est réalisé à l’aide d’un substrat chromogène (X-Gal) sur des cellules fixes, avec le dénombrement lent et subjectif des cellules sénescentes « bleues » par microscopie optique. Des tests améliorés utilisant des substrats fluorescents SA-β-Gal perméables aux cellules, y compris C12-FDG (vert) et DDAO-Galactoside (DDAOG; rouge lointain), ont permis l’analyse de cellules vivantes et l’utilisation de plates-formes d’analyse fluorescentes à haut débit, y compris des cytomètres en flux. C12-FDG est une sonde bien documentée pour SA-β-Gal, mais son émission fluorescente verte chevauche l’autofluorescence cellulaire intrinsèque (AF) qui survient pendant la sénescence en raison de l’accumulation d’agrégats de lipofuscine. En utilisant la sonde rouge lointain SA-β-Gal DDAOG, l’autofluorescence cellulaire verte peut être utilisée comme paramètre secondaire pour confirmer la sénescence, ajoutant ainsi de la fiabilité au test. Les canaux de fluorescence restants peuvent être utilisés pour la coloration de la viabilité cellulaire ou l’immunomarquage fluorescent facultatif.
En utilisant la cytométrie en flux, nous démontrons l’utilisation de DDAOG et de l’autofluorescence de la lipofuscine comme test à double paramètre pour l’identification des cellules tumorales sénescentes. La quantification du pourcentage de cellules sénescentes viables est effectuée. Si vous le souhaitez, une étape facultative d’immunomarquage peut être incluse pour évaluer les antigènes de surface cellulaire d’intérêt. Les cellules sénescentes identifiées peuvent également être triées cytométriquement en flux et collectées pour analyse en aval. Les cellules sénescentes collectées peuvent être immédiatement lysées (par exemple, pour des tests immunologiques ou des analyses omiques) ou cultivées.
Introduction
Les cellules sénescentes s’accumulent normalement dans les organismes au fil des ans au cours du vieillissement biologique normal, mais peuvent également se développer rapidement dans les cellules tumorales en réponse aux dommages induits par divers traitements contre le cancer, y compris la radiothérapie et la chimiothérapie. Bien qu’elles ne prolifèrent plus, les cellules tumorales sénescentes induites par le traitement (TIS) peuvent contribuer à la résistance au traitement et entraîner une récidive 1,2,3. Les facteurs sécrétés par les cellules TIS peuvent exacerber la tumeur maligne en favorisant l’évasion immunitaire ou les métastases 4,5. Les cellules TIS développent des phénotypes complexes et spécifiques au contexte, des profils métaboliques modifiés et des réponses immunitaires uniques 6,7,8. Par conséquent, l’identification et la caractérisation des cellules tumorales TIS induites par diverses approches de traitement du cancer est un sujet d’intérêt continu pour la communauté de recherche sur le cancer.
Pour détecter les cellules tumorales TIS, les tests de sénescence conventionnels sont largement utilisés, principalement basés sur la détection d’une activité accrue de l’enzyme marqueur de sénescence, la bêta-galactosidase lysosomale GLB19. La détection à un pH lysosomal presque neutre (plutôt qu’acide) permet une détection spécifique de la bêta-galactosidase associée à la sénescence (SA-β-Gal)10. Un test SA-β-Gal standard utilisé depuis plusieurs décennies utilise X-Gal (5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside), un substrat chromogène bleu de la bêta-galactosidase, pour détecter la SA-β-Gal dans les cellules fixes par microscopieoptique 11. Le test X-Gal permet la confirmation visuelle qualitative du TIS à l’aide de réactifs et d’équipements de laboratoire couramment disponibles. Un microscope optique transmis de base est le seul instrument nécessaire pour évaluer la présence du chromogène bleu. Cependant, la procédure de coloration X-Gal peut manquer de sensibilité, nécessitant parfois plus de 24 heures pour que la couleur se développe. La coloration est suivie d’un score subjectif à faible débit des cellules sénescentes individuelles basé sur le comptage des cellules présentant un certain niveau d’intensité du chromogène bleu au microscope optique. Comme X-Gal est imperméable aux cellules, ce test nécessite des cellules fixées au solvant, qui ne peuvent pas être récupérées pour une analyse en aval. Lorsque vous travaillez avec des échantillons limités d’animaux ou de patients, cela peut être un inconvénient majeur.
Des dosages SA-β-Gal améliorés utilisant des substrats enzymatiques fluorescents perméants aux cellules, y compris le C 12-FDG (5-dodécanoylaminofluorescéine Di-β-D-Galactopyranoside, vert) et le DDAOG (9H-(1,3-dichloro-9,9-diméthylacridin-2-one-7-yl) β-D-galactopyranoside, rouge lointain) ont déjà paru dans la littérature12,13,14,15. La structure chimique de la sonde et les caractéristiques optiques du DDAOG sont illustrées à la figure supplémentaire S1. Ces sondes perméables permettent l’analyse de cellules vivantes (plutôt que fixes), et les sondes fluorescentes plutôt que chromogènes facilitent l’utilisation de plates-formes d’analyse fluorescentes rapides à haut débit, y compris des instruments de dépistage à haute teneur et des cytomètres en flux. Les cytomètres de flux de tri permettent la récupération de populations enrichies de cellules sénescentes vivantes à partir de cultures cellulaires ou de tumeurs pour une analyse en aval (par exemple, Western blotting, ELISA ou « omiques »). L’analyse de fluorescence fournit également un signal quantitatif, permettant une détermination plus précise du pourcentage de cellules sénescentes dans un échantillon donné. Des sondes fluorescentes supplémentaires, y compris des sondes de viabilité et des anticorps marqués au fluorophore, peuvent facilement être ajoutées pour l’analyse multiplexée de cibles au-delà de SA-β-Gal.
Semblable au DDAOG, le C12-FDG est une sonde fluorescente pour SA-β-Gal, mais son émission fluorescente verte chevauche la FA cellulaire intrinsèque, qui survient lors de la sénescence en raison de l’accumulation d’agrégats de lipofuscine dans les cellules16. En utilisant la sonde DDAOG rouge lointain, la FA cellulaire verte peut être utilisée comme paramètre secondaire pour confirmer la sénescence17. Cela améliore la fiabilité du test en utilisant un deuxième marqueur en plus du SA-β-Gal, qui peut souvent être peu fiable en tant que marqueur unique de la sénescence18. Comme la détection de la FA endogène dans les cellules sénescentes est une approche sans marquage, il s’agit d’un moyen rapide et simple d’étendre la spécificité de notre test basé sur DDAOG.
Dans ce protocole, nous démontrons l’utilisation de DDAOG et de la FA comme test rapide de cytométrie en flux à double paramètre pour l’identification de cellules tumorales TIS viables à partir de cultures in vitro ou isolées de tumeurs traitées par des médicaments établies chez la souris (Figure 1). Le protocole utilise des fluorophores compatibles avec une large gamme d’analyseurs et de trieurs de cytométrie en flux commerciaux standard (tableau 1). La quantification du pourcentage de cellules sénescentes viables à l’aide de l’analyse par cytométrie en flux standard est activée. Si vous le souhaitez, une étape facultative d’immunomarquage peut être effectuée pour évaluer les antigènes de surface cellulaire d’intérêt en même temps que la sénescence. Les cellules sénescentes identifiées peuvent également être enrichies à l’aide de la méthodologie standard de tri cellulaire activé par fluorescence (FACS).
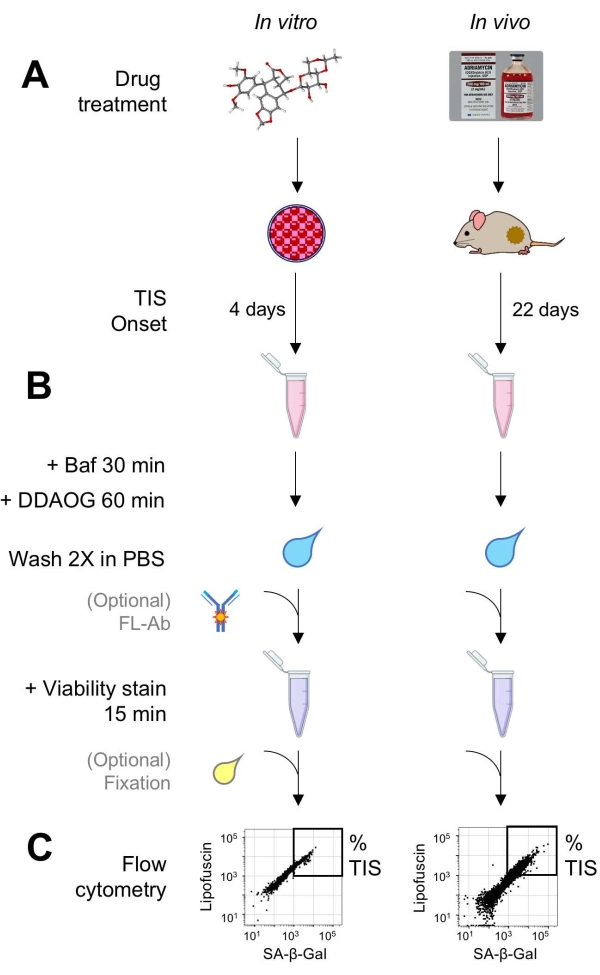
Figure 1 : Flux de travail expérimental. Un schéma résumant les points clés du test DDAOG. (A) Un médicament inducteur de TIS est ajouté à des cellules cultivées de mammifères ou administré à des souris porteuses de tumeurs. Un délai est alors prévu pour l’apparition du TIS: pour les cellules, 4 jours après le traitement; pour les souris, 22 jours au total, avec trois traitements tous les 5 jours plus 7 jours de récupération. Les cellules sont récoltées ou les tumeurs sont dissociées en suspension. (B) Les échantillons sont traités avec Baf pour ajuster le pH lysosomal pour la détection de SA-β-Gal pendant 30 min; ensuite, la sonde DDAOG est ajoutée pendant 60 minutes pour détecter SA-β-Gal. Les échantillons sont lavés 2x dans du PBS, et une tache de viabilité est brièvement ajoutée (15 min). En option, les échantillons peuvent être colorés avec des anticorps fluorescents dans des canaux de fluorescence ouverts et / ou fixés pour une analyse ultérieure. (C) Les échantillons sont analysés à l’aide d’un cytomètre en flux standard. Les cellules viables sont visualisées dans des diagrammes de points montrant le DDAOG rouge (indiquant SA-β-Gal) par rapport à l’autofluorescence verte (lipofuscine). Une porte pour déterminer le pourcentage de cellules TIS est établie en fonction des échantillons témoins non traités (non représentés). Si un cytomètre de tri (FACS) est utilisé, les cellules TIS peuvent être collectées et remises en culture pour d’autres tests in vitro ou lysées et traitées pour des essais de biologie moléculaire. Abréviations : DDAO = 9H-(1,3-dichloro-9,9-diméthylacridin-2-one); DDAOG = DDAO-Galactoside; TIS = sénescence induite par la thérapie; FL-Ab = anticorps conjugué au fluorophore; Baf = Bafilomycine A1; SA-β-Gal = bêta-galactosidase associée à la sénescence; PBS = solution saline tamponnée au phosphate; FACS = tri cellulaire activé par fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Fluorophore | Détecte | Ex/Em (nm) | Cytomètre laser (nm) | Détecteur cytomètre / filtre passe-bande (nm) |
| Le | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscine | < 600 | 488 | 525 / 50 |
| CV450 | Viabilité | 408/450 | 405 | 450 / 50 |
| PE | Anticorps/marqueur de surface | 565/578 | 561 | 582 / 15 |
Tableau 1 : Fluorophores et spécifications optiques du cytomètre. Les spécifications du cytomètre utilisées dans ce protocole sont répertoriées pour un instrument avec un total de 4 lasers et 15 détecteurs d’émission. DDAOG détecté à 645/660 nm est la forme de la sonde clivée par SA-β-Gal1. Le DDAOG onculé peut présenter une fluorescence de faible niveau à 460/610 nm, mais il est éliminé par les étapes de lavage prévues dans le protocole. Abréviations : DDAO = 9H-(1,3-dichloro-9,9-diméthylacridin-2-one); DDAOG = DDAO-Galactoside; AF = autofluorescence; PE = phycoérythrine; SA-β-Gal = bêta-galactosidase associée à la sénescence.
Protocol
Representative Results
Discussion
Au cours de la dernière décennie, la cytométrie en flux est devenue une plate-forme de dosage plus courante dans la recherche sur le cancer en raison de la popularité émergente de l’immunologie tumorale, du développement de cytomètres en flux à moindre coût et de l’amélioration des installations d’instrumentation partagées dans les établissements universitaires. Les tests multicolores sont maintenant standard, car la plupart des nouveaux instruments sont équipés de réseaux optiques violet, bleu-vert …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions le Cytometry and Antibody Core Facility de l’Université de Chicago pour son soutien sur l’instrumentation de cytométrie en flux. Le Centre de recherche animale de l’Université de Chicago a fourni un logement pour animaux.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

