בדיקה פלואורסצנטית פלואורסצנטית β-גלקטוזידאז הקשורה לזיהוי והעשרה של תאי גידול סנסנטיים על ידי ציטומטריה של זרימה
Summary
פרוטוקול לכימות ציטומטרי פלואורסצנטי, זרימה של תאים סרטניים סנסנטיים המושרים על ידי תרופות כימותרפיות בתרבית תאים או במודלים של גידולי מורין. הליכים אופציונליים כוללים co-immunostaining, קיבוע דגימה כדי להקל על אצווה גדולה או ניתוח נקודת זמן, והעשרה של תאים senescent קיימא על ידי מיון ציטומטרי זרימה.
Abstract
סנסנציה תאית היא מצב של מעצר שגשוג הנגרם על ידי נזק ביולוגי שבדרך כלל מצטבר לאורך שנים בתאים מזדקנים, אך עשוי להופיע במהירות גם בתאי הגידול כתגובה לנזק הנגרם על ידי טיפולים שונים בסרטן. סנסנציה של תאי גידול נחשבת בדרך כלל לבלתי רצויה, שכן תאים סנסנטיים הופכים עמידים למוות וחוסמים את הפוגה של הגידול תוך החרפת ממאירות הגידול ועמידות לטיפול. לכן, זיהוי של תאים סרטניים סנסנטיים הוא עניין מתמשך לקהילת חקר הסרטן. קיימים מבחני סנסנציה שונים, רבים מהם מבוססים על פעילותו של סמן הסנסנציה הידוע, בטא-גלקטוזידאז הקשור לסנסנציה (SA-β-Gal).
בדרך כלל, בדיקת SA-β-Gal מבוצעת באמצעות מצע כרומוגני (X-Gal) על תאים קבועים, עם ספירה איטית וסובייקטיבית של תאים סנסנטיים “כחולים” על ידי מיקרוסקופיית אור. בדיקות משופרות המשתמשות במצעי SA-β-Gal פלואורסצנטיים החודשים לתאים, כולל C12-FDG (ירוק) ו-DDAO-Galactoside (DDAOG; אדום-רחוק), אפשרו ניתוח של תאים חיים ואפשרו שימוש בפלטפורמות ניתוח פלואורסצנטיות בתפוקה גבוהה, כולל ציטומטרים של זרימה. C12-FDG היא בדיקה מתועדת היטב עבור SA-β-Gal, אך פליטת הפלואורסצנט הירוקה שלה חופפת לאוטופלואורסצנציה תאית פנימית (AF) המתעוררת במהלך סנסנציה עקב הצטברות של אגרגטים ליפופוסצין. על ידי שימוש בגשושית SA-β-Gal האדומה הרחוקה DDAOG, ניתן להשתמש ב-autofluorescence של תאים ירוקים כפרמטר משני כדי לאשר את הסנסנציה, ולהוסיף אמינות לבדיקה. ניתן להשתמש בתעלות הפלואורסצנטיות הנותרות לצורך צביעת כדאיות התאים או לתיוג חיסוני פלואורסצנטי אופציונלי.
באמצעות ציטומטריה של זרימה, אנו מדגימים את השימוש ב- DDAOG וב- lipofuscin autofluorescence כבדיקה דו-פרמטרית לזיהוי תאי גידול סנסנטיים. כמות של אחוז התאים senescent קיימא מבוצעת. אם תרצה, ניתן לכלול שלב אופציונלי של תיוג חיסוני כדי להעריך אנטיגנים מעניינים על פני התא. תאים סנסנטיים מזוהים יכולים גם להיות ממוינים בצורה ציטומטרית ונאספים לניתוח במורד הזרם. תאים סנסנטיים שנאספו יכולים להיות שוכבים באופן מיידי (למשל, לצורך בדיקות חיסוניות או ‘ניתוח אומיקה’) או בתרבית נוספת.
Introduction
תאים סנסנטיים בדרך כלל מצטברים באורגניזמים במשך שנים במהלך הזדקנות ביולוגית רגילה, אך עשויים גם להתפתח במהירות בתאי הגידול כתגובה לנזק הנגרם על ידי טיפולים שונים בסרטן, כולל הקרנות וכימותרפיה. למרות שאינם מתרבים עוד, תאי גידול סנסנטיים (TIS) הנגרמים על ידי טיפול עשויים לתרום לעמידות לטיפול ולהניע הישנותשל 1,2,3. גורמים המופרשים על ידי תאי TIS יכולים להחמיר את ממאירות הגידול על ידי קידום התחמקות חיסונית או גרורות 4,5. תאי TIS מפתחים פנוטיפים מורכבים וספציפיים להקשר, פרופילים מטבוליים משתנים ותגובות חיסוניות ייחודיות 6,7,8. לכן, זיהוי ואפיון של תאי גידול מסוג TIS המושרים על ידי גישות שונות לטיפול בסרטן הוא נושא שמעניין באופן שוטף את קהילת חקר הסרטן.
כדי לזהות תאים סרטניים מסוג TIS, נעשה שימוש נרחב במבחני סנסנציה קונבנציונליים, המבוססים בעיקר על גילוי פעילות מוגברת של אנזים סמן הסנסנציה, הבטא-גלקטוזידאז הליזוזומלי GLB19. זיהוי ב-pH ליזוזומלי כמעט נייטרלי (ולא חומצי) מאפשר זיהוי ספציפי של בטא-גלקטוזידאז (SA-β-Gal) הקשור לסנסנציה10. בדיקת SA-β-Gal סטנדרטית שנמצאת בשימוש כבר כמה עשורים משתמשת ב-X-Gal (5-ברומו-4-כלורו-3-אינדוליל-β-D-גלקטופירנוסייד), מצע בטא-גלקטוזידאז כרומוגני כחול, כדי לזהות SA-β-Gal בתאים קבועים על ידי מיקרוסקופיית אור11. בדיקת X-Gal מאפשרת אישור חזותי איכותי של TIS תוך שימוש בריאגנטים ובציוד מעבדה זמינים בדרך כלל. מיקרוסקופ אור בסיסי המועבר הוא המכשור היחיד הנדרש להערכת נוכחותו של הכרומוגן הכחול. עם זאת, הליך צביעת X-Gal עלול להיות חסר רגישות, ולעתים נדרשות יותר מ-24 שעות להתפתחות צבע. לאחר מכן מכתים ניקוד סובייקטיבי בעל תפוקה נמוכה של תאים סנסנטיים בודדים בהתבסס על ספירת התאים המציגים רמה מסוימת של עוצמה של הכרומוגן הכחול תחת מיקרוסקופ אור. מכיוון ש-X-Gal הוא אטום לתאים, בדיקה זו דורשת תאים קבועים בממס, שלא ניתן לשחזר לצורך ניתוח במורד הזרם. כאשר עובדים עם דגימות מוגבלות מבעלי חיים או מחולים, זה יכול להיות חיסרון גדול.
מבחני SA-β-Gal משופרים המשתמשים בסובסטרטים של אנזימים פלואורסצנטיים חדירים לתאים, כולל C 12-FDG (5-דודקנוילאמינופלואורסצין Di-β-D-גלקטופירנוזיד, ירוק) ו-DDAOG (9H-(1,3-דיכלורו-9,9-דימתיל-אקרידין-2-אחד-7-yl) β-D-גלקטופירנוסייד, אדום רחוק) הופיעו בעבר בספרות12,13,14,15. מבנה הגשושית הכימית והמאפיינים האופטיים של DDAOG מוצגים באיור משלים S1. גשושיות אלה, המיועדות לתאים, מאפשרות ניתוח של תאים חיים (ולא קבועים), וגשושיות פלואורסצנטיות ולא כרומוגניות מאפשרות שימוש בפלטפורמות ניתוח פלואורסצנטיות מהירות בתפוקה גבוהה, כולל מכשירי סינון בעלי תוכן גבוה וציטומטרים של זרימה. מיון ציטומטרים של זרימה מאפשר התאוששות של אוכלוסיות מועשרות של תאים חיים מתרביות תאים או גידולים לניתוח במורד הזרם (למשל, כתם מערבי, ELISA או ‘אומיקה’). ניתוח פלואורסצנטי מספק גם אות כמותי, המאפשר קביעה מדויקת יותר של אחוז התאים הסנסנטיים בתוך דגימה נתונה. ניתן להוסיף בקלות בדיקות פלואורסצנטיות נוספות, כולל בדיקות כדאיות ונוגדנים המסומנים בפלואורופור, לניתוח מרובב של מטרות מעבר ל-SA-β-Gal.
בדומה ל-DDAOG, C12-FDG היא בדיקה פלואורסצנטית עבור SA-β-Gal, אך פליטת הפלואורסצנט הירוקה שלה חופפת למיקוד אוטומטי תאי פנימי, המתעורר במהלך סנסנציה עקב הצטברות של אגרגטים ליפופוסצין בתאים16. על ידי שימוש בגשושית DDAOG בצבע אדום רחוק, ניתן להשתמש במיקוד אוטומטי תאי ירוק כפרמטר משני לאישור סנסנציה17. זה משפר את אמינות הבדיקה על ידי שימוש בסמן שני בנוסף ל- SA-β-Gal, שלעתים קרובות יכול להיות לא אמין כסמן יחיד עבור senescence18. מכיוון שזיהוי של AF אנדוגני בתאים סנסנטיים הוא גישה נטולת תוויות, זוהי דרך מהירה ופשוטה להרחיב את הספציפיות של הבדיקה מבוססת ה- DDAOG שלנו.
בפרוטוקול זה, אנו מדגימים את השימוש ב-DDAOG וב-AF כבדיקת ציטומטריה מהירה של זרימה דו-פרמטרית לזיהוי תאי גידול TIS בני קיימא מתרביות מבחנה או מבודדים מגידולים שטופלו בתרופות שהוקמו בעכברים (איור 1). הפרוטוקול משתמש בפלואורופורים התואמים למגוון רחב של מנתחי וממיינים סטנדרטיים של ציטומטריה של זרימה מסחרית (טבלה 1). כמות של אחוז התאים הסנסוניים בני קיימא באמצעות ניתוח ציטומטריה של זרימה סטנדרטית מופעלת. אם תרצה, ניתן לבצע שלב חיסוני אופציונלי כדי להעריך אנטיגנים בעלי עניין על פני התא במקביל לסנסנציה. ניתן גם להעשיר תאים סנסנטיים מזוהים באמצעות מתודולוגיית מיון תאים פלואורסצנטית סטנדרטית (FACS).
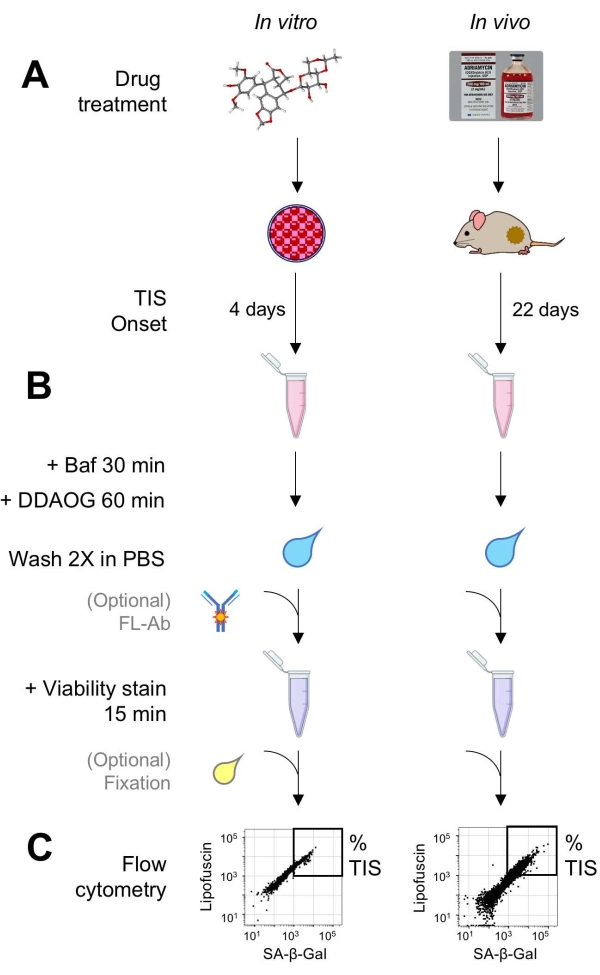
איור 1: זרימת עבודה ניסיונית. סכמטי המסכם נקודות מפתח של מבחן DDAOG. (A) תרופה הגורמת ל-TIS מתווספת לתאים בתרבית של יונקים או ניתנת לעכברים נושאי גידול. לאחר מכן הזמן מותר להופעת TIS: לתאים, 4 ימים לאחר הטיפול; עבור עכברים, 22 ימים בסך הכל, עם שלושה טיפולים כל 5 ימים ועוד 7 ימי התאוששות. תאים נקצרים או גידולים מנותקים לתוך ההשעיה. (B) דגימות מטופלות ב-Baf כדי להתאים את ה-pH הליזוזומלי לזיהוי SA-β-Gal למשך 30 דקות; לאחר מכן, גשושית DDAOG מתווספת למשך 60 דקות כדי לזהות SA-β-Gal. דגימות נשטפות 2x ב- PBS, וכתם כדאיות מתווסף לזמן קצר (15 דקות). לחלופין, ניתן להכתים דגימות בנוגדנים פלואורסצנטיים בתעלות פלואורסצנטיות פתוחות ו/או לתקן אותן לצורך ניתוח מאוחר יותר. (C) דגימות מנותחות באמצעות ציטומטר זרימה סטנדרטי. תאים בני קיימא מוצגים באופן חזותי בחלקות נקודות המציגות DDAOG אדום (המציין SA-β-Gal) לעומת אוטופלואורסצנציה ירוקה (lipofuscin). שער לקביעת אחוז תאי ה- TIS נקבע על סמך דגימות בקרה לא מטופלות (לא מוצגות). אם נעשה שימוש בציטומטר מיון (FACS), ניתן לאסוף תאי TIS ולהחזירם לתרבית לצורך בדיקות נוספות במבחנה או לשכב ולעבד אותם למבחני ביולוגיה מולקולרית. קיצורים: DDAO = 9H-(1,3-dichloro-9,9-dimethylacridin-2-one); DDAOG = DDAO-גלקטוסייד; TIS = סנסנציה הנגרמת על ידי טיפול; FL-Ab = נוגדן מצומד פלואורופור; Baf = Bafilomycin A1; SA-β-Gal = בטא-גלקטוזידאז הקשור לסנסנציה; PBS = מלח חצוב פוספט; FACS = מיון תאים המופעל על ידי פלואורסצנציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| פלואורופור | מזהה | Ex/Em (ננומטר) | לייזר ציטומטר (ננומטר) | גלאי ציטומטר / מסנן פס פס (nm) |
| DDAOG | SA-β-גל | 645/6601 | 640 | 670 / 30 |
| מיקוד אוטומטי | ליפופוסקין | < 600 | 488 | 525 / 50 |
| CV450 | כדאיות | 408/450 | 405 | 450 / 50 |
| PE | נוגדן/סמן פני השטח | 565/578 | 561 | 582 / 15 |
טבלה 1: מפרטים אופטיים של פלואורופורים וציטומטר. מפרטי ציטומטר המשמשים בפרוטוקול זה מפורטים עבור מכשיר עם סך של 4 לייזרים ו -15 גלאי פליטה. DDAOG שזוהה ב-645/660 ננומטר הוא הצורה של הגשושית שנבקעה על ידי SA-β-Gal1. DDAOG לא יציב יכול להפגין פלואורסצנטיות ברמה נמוכה ב-460/610 ננומטר, אך הוא מוסר על ידי שלבי שטיפה בפרוטוקול. קיצורים: DDAO = 9H-(1,3-dichloro-9,9-dimethylacridin-2-one); DDAOG = DDAO-גלקטוסייד; AF = אוטופלואורסצנציה; PE = פיקואריתרין; SA-β-Gal = בטא-גלקטוזידאז הקשור לסנסנציה.
Protocol
Representative Results
Discussion
במהלך העשור האחרון לערך, ציטומטריה של זרימה הפכה לפלטפורמת בדיקה נפוצה יותר בחקר הסרטן בשל הפופולריות המתפתחת של אימונולוגיה של גידולים, פיתוח ציטומטרים של זרימה בעלות נמוכה יותר ושיפור מתקני מכשור משותפים במוסדות אקדמיים. בדיקות צבעוניות הן כעת סטנדרטיות, מכיוון שרוב המכשירים החדשים מ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים למתקן ליבת הציטומטריה והנוגדנים באוניברסיטת שיקגו על התמיכה במכשור ציטומטריה של זרימה. המרכז לחקר בעלי חיים באוניברסיטת שיקגו סיפק דיור לבעלי חיים.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

